
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •Вопрос 10. Хим св-ва алкенов и алкинов.
- •Вопрос11. Циклоалканы- это циклические предельные углевоороды. СnH2n-общ формула. (строение их см в тет)
- •Вопрос12 Арены-это углеводородные производные бензола,включая сам бензол(с6h6).Впервые бензол был открыт Фарадеем.
- •Вопрос13. Алкадиены. Диены-орг.Соед-ия,молекулы кот сост.Из ат. С и н и помимо простых б-связей содержат еще и две двойные п-св. Их общ.Формула СnH2n-2.
- •Вопрос14.Реакции полимеризации диеновых у/в.
- •Вопрос16.Сравнительная хар-ка хим св-в алиф-их и аромат-их галогенуглеводородов
- •27Оксикислоты
- •Вопрос 33. Монасахариды-сахароподобные,сладкие на вкус и не подверженные гидролизу до более простых соединений индивидуальные в-ва.
- •Вопрос 34. Дисахариды- углеводы, кот сод-ат 2 остатка моносахаридов,связанных между собой простой эфирной гликозидной связью.
- •Вопрос 53
- •Вопрос 54.
- •Нахождение в природе
- •Вопрос 55
27Оксикислоты
Оксикислотаминазываются органические карбоновые кислоты,
содержащие кроме карбоксильных групп одну или несколько гидроксильных
групп. Число карбоксильных групп определяет основностьоксикислоты. По
числу гидроксилов, включая и входящие в состав карбоксильных групп,
определяют атомность оксикислот.
Простейшие оксикислоты обычно называют поих природным
источником.
Например:
-молочная кислота – одноосновная, двухатомная кислота;
была открыта Шeeле в прокисшем молоке, откуда и получила свое название.
HOOC-CH2-CН COOH
OH -яблочная, двухосновная, трехосновная
(содержится в яблоках).
HOOC-CH-CН COOH
НO OH -винная кислота, двухосновная, четырехатомная
(была выделена из «винного камня» - отхода, получаемого при изготовлении
и выдержке виноградных вин).
НOOC-CH2-C СН2СOOH
OH
COOH
-лимонная кислота, трехосновная,
четырехатомная, была выделена из листьев лимона.
Очень часто оксикислоты получают названия как оксипроизводные
соответствующих карбоновых кислот. В зависимости от положения
оксигруппы по отношению к карбоксильной различают α-, β-, γ- и т.д.
оксикислоты (гидрокси – по ИЮПАК).
Способы получения
1. Гидролизгалогензамещенныхкислот.
Это удобный способ синтеза α-оксикислот, из-за доступности α-
галогензамещенных кислот.
2. Получениеизальдегидов, кетонов(циангидринный синтез, получение α-
оксикислот).
3. Восстановлениеоксокислот.
4. Изаминокислот.
5. Изнепредельныхкислот.
6. Окислениеоксиальдегидов (альдоли) и гликолей.
Например, окисью серебра в аммиачном растворе, получают оксикислоты
с различным строением в зависимости от положения соответствующих групп
в исходном соединении:
7. Окислениекислот с третичныматомомуглерода, находящимсяв α-
положении к карбоксилу.
8. Гидролизлактонов.
циклогексанон-капролактон 6-гидроксигексановая кислота
Многие из оксикислот получают специфическими методами или же
извлекают из растительных и животных продуктов.
Физические и химические свойства оксикислот
Оксикислоты – жидкости или большей частью кристаллические
вещества. В воде они растворимы лучше, чем соответствующие карбоновые
кислоты, не содержащие гидроксила. Низшие оксикислоты смешиваются с
водой в любых соотношениях.
Химическое поведение оксикислот, как и других
гетерофункциональных соединений, то есть соединений, содержащих в
молекуле разные функциональные группы, определяется природой этих
групп. Оксикислоты вступают в большинство химических реакций,
характерных для кислот (-COOH) и спиртов (-OH). Строение
углеводородного радикала также сказывается на их химическом поведении:
ароматические кислоты (например, салициловая кислота) вступают во
многие реакции, характерные для соответствующих производных бензола. В
одних реакциях каждая из функциональных групп может участвовать
независимо друг от друга, в других ход реакции и характер образующихся
продуктов зависит от взаимного влияния этих групп, в некоторых случаях
окси- и карбоксильная группы могут взаимодействовать одновременно или
между собой.
1. Кислотныесвойства.
По сравнению с карбоновыми кислотами с тем же числом углеродных атомов
оксикислоты (в особенности α-кислоты) обнаруживают более сильно
выраженные кислотные свойства. Так, константа диссоциации гликолиевой
кислоты в 8,5 раз больше, чем уксусной.
2. Какспирты.
Вступление в реакцию спиртового или кислотного гидроксила
определяется выбором реагента и условиями реакций. Так, при действии НСl
замещается гидроксил спиртовой, а при действии PCl5 и кислотный и
спиртовой. Во всех превращениях оксикислот приходится считаться с
взаимным влиянием гидроксильной (-ОН) и карбоксильной (-СООН) групп.
3. α-Оксикислотылегковосстанавливаются в карбоновыекислоты.
4. Термическоеповедениеоксикислот.
Отщепление Н2О при температуре происходит легко, причем в
зависимости от положения гидроксильной группы образуются различные
вещества.
28АЛЬДЕГИДОКИСЛОТЫ И КЕТОКИСЛОТЫ, органические соединения, в молекулах к-рых, наряду с присущей кислотам карбоксильной группой
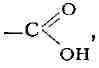 содержится
группа
содержится
группа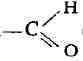 (альдегидокислоты) либо группа
(альдегидокислоты) либо группа![]()
(кетокислоты). Примером альдегидокислоты может служить глиоксиловая к-та (I), а кетокислоты - пировиноградная к-та (II).
![]()
![]()
А. и к. встречаются в природных продуктах, нек-рые из них играют важную роль в обмене веществ, являются промежуточными продуктами при спиртовом брожении Сахаров.
АЛЬДЕГИДЫ, класс органич. соединений, содержащих карбонильную группу
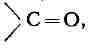 связанную
с органич. радикалом (R) и с атомом
водорода,
связанную
с органич. радикалом (R) и с атомом
водорода,
Свойства
А. во многом сходны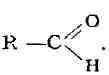 со свойствами кетонов, также содержащих
карбонильную группу, но связанную с
двумя радикалами, R2CO.
Назв. "А." обычно производят от
назв. соответствующих кислот. Так,
муравьиной кислоте НСООН соответствует
муравьиный альдегид, или формальдегид
НСНО; уксусной кислоте - уксусный
альдегид, или ацеталь-дегидСНзСНО. Так,
при окислении первичных спиртов или
при осторожном восстановлении
хлорангидридов кислот образуются А.:
со свойствами кетонов, также содержащих
карбонильную группу, но связанную с
двумя радикалами, R2CO.
Назв. "А." обычно производят от
назв. соответствующих кислот. Так,
муравьиной кислоте НСООН соответствует
муравьиный альдегид, или формальдегид
НСНО; уксусной кислоте - уксусный
альдегид, или ацеталь-дегидСНзСНО. Так,
при окислении первичных спиртов или
при осторожном восстановлении
хлорангидридов кислот образуются А.:
![]()
Промежуточному положению А. отвечает и их способность к реакциям окисления-восстановления; напр., в присутствии спиртового раствора едкой щёлочи А. превращаются в смесь спирта и кислоты
![]()
А. могут быть получены также пиролизом смешанных кальциевых солей муравьиной и к.-л. другой карбоновой к-ты:
![]()
Осторожным окислением ароматич. соединений, содержащих метильную группу,получают ароматич. А.
![]()
Технич. значение имеет аналогичный способ получения простейшего ненасыщенного А.- акролеина - из пропилена:
![]()
Метод синтеза ацетальдегида, имеющий пром. значение, состоит в гидратации ацетилена в присутствии солей ртути (см. Кучерова реакция):
![]()
А. склонны к полимеризации; формальдегид, напр., легко превращается в пара-формальдегид, ацетальдегид - в цик-лич. тример, т. н. паральдегид. При конденсации 2 молей А. образуются альдоли:
![]()
(см. Альдольная конденсация), к-рые с отщеплением воды могут образовать ненасыщенные альдегиды:
![]()
Еще химсв-ва :
Гидрирование (присоед водорода) по двойной связи карбонильной группы легко протек при пропускании паров оксосоед над Ni или Pd катализатором. При этом кетоны образ вторич спирты а альжегиды первичные :
Присоединение реактивов Гриньяра по двойной связи карбонильной группы
Присоединение HCN к карбонильной группе альдегидов и кетонов
Присоединение Н2О характерно только для наиболее активных альдегидов
Присоединение спиртов
Присоединение бисульфата
Замещение карбонильного кислорода на галоген
Р-я галогенирования
Альдольная и кротоновая конденсации оксосоедин
Простейшая альдегидокислота – глиоксалевая кислота HC(=O)–COOH – может быть получена гидролизом дихлоруксусной кислоты или электролитическим восстановлением щавелевой кислоты. Она встречается в природе в незрелых плодах. Простейшая -кетокислота – пировиноградная кислота CH3COCOOH – является важным промежуточным веществом в окислительном и ферментативном расщеплении сахаров (в гликолизе) живыми организмами. Ее можно получить, используя общие реакции, ведущие к образованию -кетокислот:
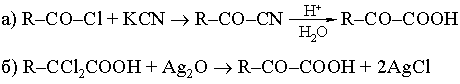
-Кетокислоты легко окисляются:
![]()
Они также очень чувствительны к действию концентрированной серной кислоты, вызывающей реакцию
![]()
-Кетокислоты. Свободные -кетокислоты при нагревании легко выделяют углекислый газ, образуя кетоны:
![]()
Однако их эфиры вполне устойчивы. Их можно получить из сложных эфиров конденсацией Клайзена:
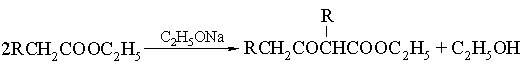
Их простейший представитель – ацетоуксусный эфир CH3COCH2COOC2H5 – имеет большое значение для органического синтеза. Его натриевая соль CH3–CO–CHNa–COOC2H5, получаемая действием этилата натрия, легко реагирует с алкилгалогенидами, давая алкилацетоуксусные эфиры, CH3COCHRCOOC2H5. Их в свою очередь можно проалкилировать до диалкилпроизводных CH3COCRRCOOC2H5. Расщепление таких эфиров до замещенных уксусных кислот можно осуществить действием сильных щелочей:
![]()
Расщепление до замещенных ацетонов достигается обработкой разбавленными кислотами или щелочами:
![]()
29. Липиды- сложные эфиры трехатомного спирта глицерина в высших карбоновых кислот. По строению их подразделяют на сложные и простые. Твердые жиры- обычно глицериды предельных к-т: миристиновой( С14), пальмитиновой (С16) и т д. Жидкие жиры- сложные эфиры непред к-т: чаще всего олеиновой.
Химическиесв-васложных липидов
Как к-ты, благодаря наличию карбокс групп в сос-ве молекул, они реагируют со щелочами, спиртами, аммиаком и образуют при этом соли, эфиры, амиды и т д
Как спирты, благодаря наличию спиртового гидроксила, оксикислотыреагир с металлич натром, образуя алкоголяты.
Гидролиз в зав-ти от условий бывает:
-водный( без катализ-ра, при высоких t , P)
-кислотный ( в присут кислоты в кач-ве катализатора)
- ферментативный
-щелочной
Р-я присоеднинения водорода
Присоединение галогенов
Ф-ии жиров в организме. Энергетическая, Структурная, Защитная.
Липиды входят в состав или служат источником многих важных веществ.
Липиды — важный пластический материал
Способы получения
30. Еще в XIX веке было отмечено, что некоторые органические вещества в жидком состоянии и в растворе способны вращать плоскость поляризации плоскополяризованного света (оптическая активность), причем одни отклоняют ее вправо, а другие – влево. Эта способность впервые была обнаружена Пастером в 1848 г. у винных кислот. С тех пор это явление называется оптической изомерией. Сейчас известно, что оптическая активность связана с наличием в молекуле sp3-гибридизированного атома углерода, связанного с четырьмя различными заместителями. Такой атом углерода называется асимметрическим или хиральным.
Так, например, в молекуле молочной кислоты содержится асимметрический атом углерода (хиральный атом углерода обозначают С*), связанный с четырьмя различными группами.
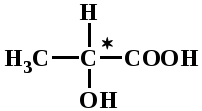
Наличие асимметрического атома углерода приводит к образованию двух зеркальных изомеров. Они отличаются друг от друга, как предмет от своего изображения в зеркале (как левая и правая руки).
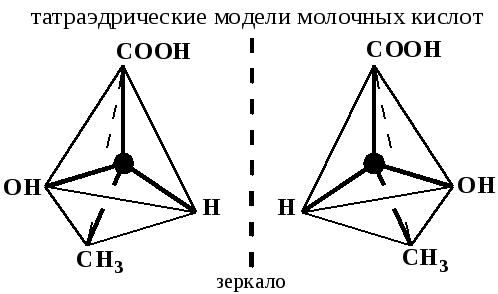
Если тетраэдрические модели молочной кислоты спроектировать на плоскость, то получаются проекционные формулы, названные формуламиФишера по имени ученого, предложившего их:
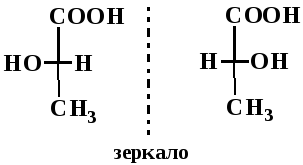
При использовании формул Фишера нужно помнить, что верхняя и нижняя групп ы (для молочной кислоты это -СООН и -СН3) лежат за плоскостью чертежа, а боковые (для молочной кислоты это -Н и -ОН) – перед плоскостью чертежа. Асимметрический атом углерода находится на пересечении прямых, связывающих эти группы. Такие модели нельзя совместить при вращении в плоскости чертежа (они относятся друг к другу, как предмет к своему зеркальному изображению или как левая и правая руки). Подобные пространственные изомеры называются зеркальными изомерами, энантиомерами или оптическими антиподами. Общее число стереоизомеров N вычисляется по формуле N=2n, где n – количество С*.
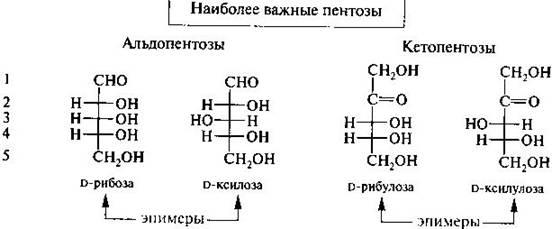
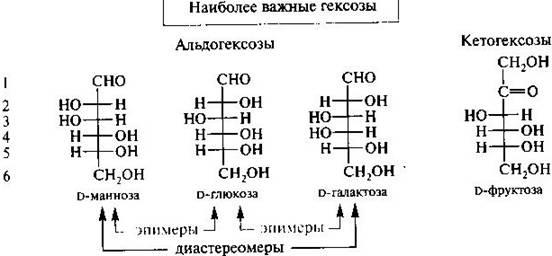
31. Моносахариды – это сахароподобные, сладкие на вкус и не подверженные гидролизу до более простых соединений индивидуалного в-ва.Альдозы – многоатомные спирты с альдегидной функциональной группой у первого углеродного атома. По кол-ву атомов углерода альдозы подразделяют: альдотриозы, альдотетрозы, альдопентозы, альдогексозы. Пространственное строение углеводов иллюстрирует существование глицеринового альдегида в виде двух антиподов D (+) L(-) , отличающ расположением спиртового гидроксила у асиметричного атома углерода :
Если строение монозы выводить из глицеринового альдегида, то отнесение любого углевода к D или Lгенетич ряду определ конфигурацией его предпоследнего ассиметрического атома углерода : так, если гидроксил находится справа, то это D –ряд, а если гидроксил слева – L ряд.
Циклические формы альдопетоз и гексопентоз
Циклические формы
При этом открытые и закрытые формы находятся в динамическом равновесии
Пример на маннозе
Кетозы- общее название моносахаридов, содерж помимо гидроксильных еще и кетонную С=О группировку в сос-ве молекулы и способных реагировать как кетонополиспирты. Это излмерныеальдозам соединения, которые по числу атомов углерода подразд: кетотетрозы, кетопентозы, кетогексозы. Кетозысодерж на один ассиметрич атом углерода меньше альдоз. Подобно альдозам принадлежность к D или Lгенетич ряду определ положением спиртового гидроксила у предпоследнего, считая с функцион С=О группы, ассиметрич атома углерода. Эритрулоза :
Кетозы, подобно альдозам, в растворах сущ как в открытой , так и в циклич форме, которые наход в динамич равновесии по отношению друг к другу. На примере D –фруктозы
32. . Моносахариды – это сахароподобные, сладкие на вкус и не подверженные гидролизу до более простых соединений индивидуалного в-ва. Альдозы – многоатомные спирты с альдегидной функциональной группой у первого углеродного атома. По кол-ву атомов углерода альдозы подразделяют: альдотриозы, альдотетрозы, альдопентозы, альдогексозы. Кетозы- общее название моносахаридов, содерж помимо гидроксильных еще и кетонную С=О группировку в сос-ве молекулы и способных реагировать как кетонополиспирты. Это излмерныеальдозам соединения, которые по числу атомов углерода подразд: кетотетрозы, кетопентозы, кетогексозы.
Химсв-ва: 1. Реакционноспособностьполуацетального гидроксила.
2. Р-я алкилирования
3. Эпимеризация моноз
4. Р-я ацилирования
5. Восстановление моноз
33.
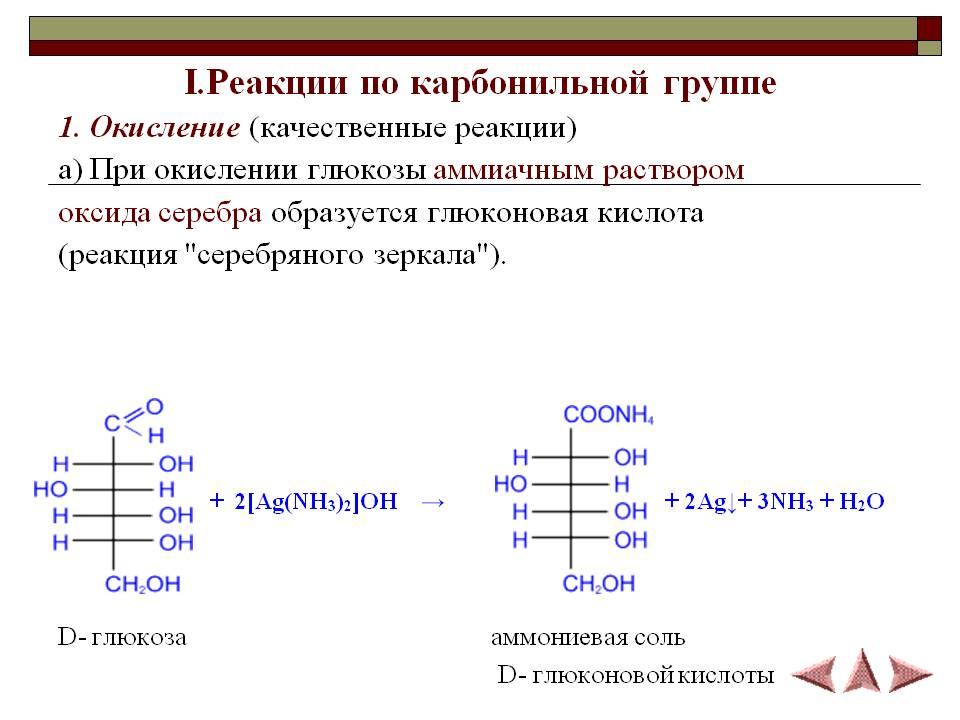
Окисление в кислой среде
Окисление аммиачным р-ом оксида серебра
