
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •Вопрос 10. Хим св-ва алкенов и алкинов.
- •Вопрос11. Циклоалканы- это циклические предельные углевоороды. СnH2n-общ формула. (строение их см в тет)
- •Вопрос12 Арены-это углеводородные производные бензола,включая сам бензол(с6h6).Впервые бензол был открыт Фарадеем.
- •Вопрос13. Алкадиены. Диены-орг.Соед-ия,молекулы кот сост.Из ат. С и н и помимо простых б-связей содержат еще и две двойные п-св. Их общ.Формула СnH2n-2.
- •Вопрос14.Реакции полимеризации диеновых у/в.
- •Вопрос16.Сравнительная хар-ка хим св-в алиф-их и аромат-их галогенуглеводородов
- •27Оксикислоты
- •Вопрос 33. Монасахариды-сахароподобные,сладкие на вкус и не подверженные гидролизу до более простых соединений индивидуальные в-ва.
- •Вопрос 34. Дисахариды- углеводы, кот сод-ат 2 остатка моносахаридов,связанных между собой простой эфирной гликозидной связью.
- •Вопрос 53
- •Вопрос 54.
- •Нахождение в природе
- •Вопрос 55
Вопрос16.Сравнительная хар-ка хим св-в алиф-их и аромат-их галогенуглеводородов
Вопрос17. Спирты и фенолы *Спирты-такие гидроксильный соед-ия,у кот ОН-гр.никогда не соединена с ат.С бензольного кольца. СnH2n+1OH-общ формула. Классификация: Многоатомные (2 и более он-гр.)и одноатомные(одна ОН-гр) дел-ся на первич,вторич,третич.
Изомерия: все виды изом углеродного скелета, изом положения он-гр.в углеродной цепи(пентанол-2,пентанол-3). Номенклатура июпак: прибавление к названию родонач-го у/в суфф.-ол. Если в спирте есть более старшие ф-ии,то ОН-гр обознач префиксом(окси) нумерация проводится ближе к тому концу,где расположена он-гр.
Способы получения:1.гидратация алкенов(т.е.+воды) под действием t и Н3РО4: СН2=СН2(этилен)+НОН СН3-СН2ОН-этанол. 2.гидролиз моногалогенуглеводородов СН3-СН2Вr+ +H2O НВr+СН3-СН2ОН(этанол). 3. окисление алканов (-вода) CH3-CH2-CH3+O2 CH3-CH-CH3-пропанол-2
Хим св-ва:1.р-ии замещения атН в ОН-гр
2.замещение ОН-гр
3.дегидратация
4.окисление
*Фенолы-гидроксильные соед-ия,у кот ОН-гр.всегда соединена с ат.С бензольного кольца. По кол-ву ОН-гр.все фенолы подразд-ся на одно-,двух-, трехатомные. Номенклатура:
Методы получения:1. Процесс «Дау»
2.Р-я Сергеева
Хи.св-ва: 1.р-и замещ ОН-гр нет
2.р-и замещ ат. Н в ОН-гр
3.Р-и замещ атН бенз кольца
Вопрос
18. Многоатомные спирты и фенолы.
*Многоатомные
спирты-это содержащие 2 и более функц-ых
ОН-гр в сос-ве мол-лы. В зависимости от
кол-ва ОН-гр разделяют на
двух-,трех-,четырехатомные.Двухатомные
спирты(гликоли) нестабильны,в момент
образ-я теряют мол-лы воды и превращ-ся
в альдегиды,кетоны и к-ты.
Хим.св-ва.
Реагируют со щелочами, образуя соли.
Например, этиленгликоль реагирует не
только с щелочными металлами, но и с
гидроксидами тяжелых металлов:
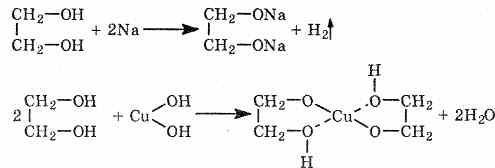
Гликоли со спиртами обра-т продукты моно-(спиртоэфиры) и дизамещения(простые эфиры):
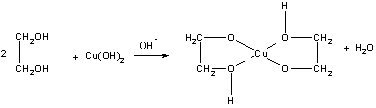
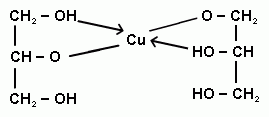
Физич.св-ва: бесцветные сиропообразные жидкости сладковатого вкуса, хорошо растворимы в воде, плохо — в органических растворителях; имеют высокие температуры кипения. Например, tкип этиленгликоля 198°С, плотность= 1,11 г/см3; tкип глицерина = 290°С, плот=1,26г/см3. Качественная реакция. Замещ-е атН в гликолях на ионы тяж.металлов приводик к образ-ю ярко окрашенных в синий цвет внутрикомплексных хелатного типа соед. Свежеосажденный гидроксид меди с гликолями дает:
*Фенолы гидроксильные соед-ия,у кот ОН-гр.всегда соединена с ат.С бензольного кольца. По кол-ву ОН-гр.все фенолы подразд-ся на одно-,двух-, трехатомные. Хим.св-ва1.р-и замещ ОН-гр нет 2.р-и замещ ат. Н в ОН-гр
3.Р-и замещ атН бенз-го кольца. а)взаимод. Со щелочами б)р-ии замещ. Ат Н бенз-го кольца Физич.св-ва: Большинство фенолов — бесцветные твердые вещества. Фенол плавится при t°=41°C. Присутствие воды в феноле понижает его температуру плавления. Смесь фенола с водой при ком-натной t° — жидкост, обладает характерным запахом. При нагревании до 70°С растворяется полностью.Фенол — антисептик, его водный раствор используется для дезинфекции и называется карболовой кислотой. Качественная реакция:В водных р-рах одноат. фенолы взаимод-ют с хлоридом железа (III) с образ-ем комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты. 6C6H5OH + FeCl3 = H3[Fe(C6H5O)6] + 3HCl
Вопрос 19. Кач. р-ции на многоатомные спирты и первич.аминогруппу Качественная реакция на многоат. спирты: Замещ-е атН в гликолях на ионы тяж.металлов приводик к образ-ю ярко окрашенных в синий цвет внутрикомплексных хелатного типа соед. Свежеосажденный гидроксид меди с гликолями дает:
Качественная
реакция на первичную аминогруппу:
Алкилирование- При взаимодействии
аминокислот с избытком алкилгалогенида
происходит исчерпывающее алкилирование
аминогруппы и образуются внутренние
соли.
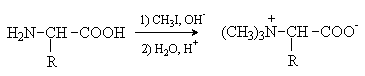
Вопрос 20. Р-ии присоед-я по карбоскильной гр: присоед Н, NaHSO3,HCN,CH3MgCl
Вопрос 21.Р-и замещ.карбон-го О2 у альдегидов и кетонов: взаимод.с PCl5, NH3, NH2NH2, NH2OH. Альдегиды-карбонил-е соед., содер-ие альдегид-ю гр. Кетоны-органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Вопрос 22.Монокарбоновые кислоты. Изомерия, номенклатура, способы получения. Строение карбоксильной группы, хим.св-ва. Монокарбоновые кислоты-одноосновные карбоновые кислоты содержат одну карбоксильную группу, связанную с углеводородным радикалом (предельным, непредельным, ароматическим).
Способы получения:1.Окисление соответствующих альдегидов. 2.Гидролиз гимениальных тригалогенуглеводородов.
3.Гидролиз нитрилов.
Строение
карбоксильной группы:
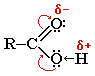
Хим.св-ва: 1.Р-ии замещ. Ат Н ОН-гр. Взаимод-е со щелочами.(р-я нейтрализации).
2.Р-ии замещ. ОН-гр. а)Образов-е сложных эфиров:
б)образ-е ангидридов:
в)образ-е галогенангидридов:
3.Потеря ОН-гр
4.Р-я по радикалу R
Вопрос 23.Как зависит кислотность карбоновых кислот от величины и хар-ра радикала. Как влияет присутствие акцепторных заместителей и их положение в мол-ле? Ответ обоснуйте.
Вопрос
24. Функциональные производные карбоновых
кислот: соли, слож.эфиры,ангидриды и
галогенангидриды, амиды, нитрилы.
Получение и св-ва.
Карбоновые
к-ты проявляют высокую реакционную
способность. Они вступают в р-ии с
различными вещ-ми и образуют разнообразные
соед-ия, среди кот. большое знач. имеют
функц-ые производные, т.е. соединения,
полученные в рез-те р-ий по карбоксильной
группе.
1.
Образование солей.
а) при взаимодействии с металлами:
2RCOOH + Mg ® (RCOO)2Mg + H2
б) в реакциях с
гидроксидами металлов: 2RCOOH + NaOH ® RCOONa +
H2O
2.
Образование сложных эфиров
R'–COOR": (р-я этерификации )Сложные
эфиры низших карб. к-т и простейших
одноат. спиртов — летучие бесцвет.
жидк.с характерным фруктовым запахом.
Слож. эфиры высших карб. к-т — бесцвет.
Тв. вещ-ва, темп.плав. зависит как от
длин углеродных цепей ацильного и
спиртового остатков, так и от их
структуры.
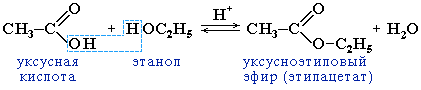 3.Образование
ангидридов.
Уксусный ангидрид представляет собой
бесцветную прозрачную подвижную жидкость
с резким запахом.
Уксусный ангидрид часто применяется в
реакциях ацилирования.
3.Образование
ангидридов.
Уксусный ангидрид представляет собой
бесцветную прозрачную подвижную жидкость
с резким запахом.
Уксусный ангидрид часто применяется в
реакциях ацилирования.
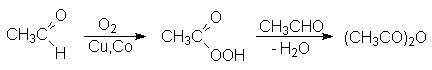
4.Образование
галогенангидридов. Галогенангидриды
являются высокореакционноспособными
веществами и широко используются в
органическом синтезе для введения
ацильной группы (реакция ацилирования).
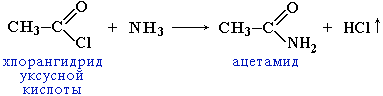
5.
Образование амидов. Амид
муравьиной к-ты — жидкость, амиды всех
др. к-т — белые кристалл-ие вещ-ва. Низшие
амиды хорошо растворимы в воде. Водные
р-ры амидов дают нейтральную р-ию на
лакмус.Важнейшее
св-во амидов — способ-ть их к гидролизу
в присутствии кислот и щелочей
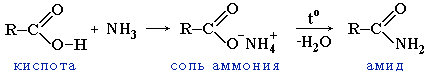
6.Образование
нитрилов(дегидратацией
амидов)
![]()
25. Дикарбоновые кис-ты- орган. Соединения, содерж в своем сос-ве молекул две карбоксильные группы. Формула :HOOC-R-COOH. Способы получения. При окислении этиленгликоля образуется щавеливая к-та HO-CH2CH2-OH
Гидролиз динитрилов :N=C-CH2CH2-C=NNH2OC-CH2CH2-CONH2 HOOC-CH2CH2-COOH
Окисление циклических кетонов при помощи конц азотной к-ты
Химические св-ваHOOC –R- COOH + CH3OHHOOC – R- C-O-CH3 + H2O
HOOC-R-C-OCH3 + CH3OH CH3 –O-C-R-C-O-CH3
Нагревание щавелевой и малоновой к-т с выделением CO2 и образованием монокарбоновых к-т
HOOC-COOH HCOOK + CO2 HOOC-CH2-COOH CH3- COOH +CO2
Малоновая к-та и ее диэтиловый эфир .
Терефталевая к-та –твердое кристаллическое, высокоплавкое, белого цвета в-во; получается окислением n-ксилола
Непредельные к-ты содержат в своем сос-ве одну или несколько кратных связей. Для них харак-ны все известные р-ии по карбоксильной группе и все р-ии, присущие соедин. Этиленового ряда. Акриловая к-та- 1-й член гомол ряда непредк-т, получается окислением акролеина
В промышленности из окиси этилена и синильной к-ты
Взаимное влияние П –связей и в а –положении орган радикала и П- связи С=О группы карбоксила приводит к поляризации первой, что вызывает ориентацию присоедгалогенуглеводородов против правила Марковникова :
Акрилонитрил-продукт многотоннажногохим синтеза; поучают дегидратацией оксинитрила либо каталитприсоедин синильной к-ты к ацетилену при 80 С
Фумаровая и малеиновая к-ты- изомерные соедин-я, получаемые дегидротацией яблочной к-ты
Геометрические изомеры образуют и длинноцепочечные высшие жирные к-ты. Например, жидкая и маслянистая олеиновая к-та в процессе медленного нагревания в присуткаталитич количеств NO2 изомеризуется с образ уже твердого в обычных условиях транс- изомера – элаидиновой к-ты строения:
26. Важнейшие функц группы в орг химии. Спирты- это производные углеводородов, содерж в молекуле одну или несколько гидроксил групп-ОН у насыщенных атомов углерода.Кислородосодерж орган соединения. По строению делятся на предельные (алканолы) СН3ОН метанол , ароматические –фенилметанол, непредельные : алкенолы СН2=СН-СН2ОН пропен-2-ол-1, алкинолы НС С-СН2ОН Пропин-2-ол-1качеств р-я на одноатомные первичные спирты - оксид меди (прокаленная медная проволока). Спирты при этом окисляются до альдегидов, на проволоке образуется слой восстановленной меди. Сн3 - СН2 - ОН + СuO =CH3 - COH + Cu + H2Oна многоатомные
 Простейшая
качественная реакция на спирты —
окисление спирта оксидом меди. Для этого
пары спирта пропускают над раскаленным
оксидом меди. Затем полученный альдегид
улавливают фуксинсернистой кислотой,
раствор становится фиолетовым:
CH3-CH2-OH
+ CuO —t—> CH3-CHO
+ Cu + H2OСпирты
идентифицируются пробой Лукаса — конц.
раствор соляной кислоты и хлорида цинка.
При пропускании вторичного или третичного
спирта в такой раствор образуется
маслянистый осадок соответствующего
алкилхлорида:
CH3-CHOH-CH3
+ HCl —ZnCl2—>
CH3-CHCl-CH3↓
+ H2O
Первичные спирты в реакцию не
вступают.Еще одним известным методом
является иодоформная проба:
CH3-CH2-OH
+ 4I2
+ 6NaOH ——> CHI3↓
+ 5NaI + HCOONa + 5H2OКачественные
реакции на многоатомные спирты.
Наиболее
известная качественная реакция на
многоатомные спирты — взаимодействие
их с гидроксидом меди (II). Гидроксид
растворяется, образуется хелатный
комплекс темно-синего цвета. Обратите
внимание на то, что в отличии от альдегидов
многоатомные спирты реагируют с
гидроксидом меди (II) без нагревания. К
примеру, при приливании глицерина
образуется глицерат меди (II):
Простейшая
качественная реакция на спирты —
окисление спирта оксидом меди. Для этого
пары спирта пропускают над раскаленным
оксидом меди. Затем полученный альдегид
улавливают фуксинсернистой кислотой,
раствор становится фиолетовым:
CH3-CH2-OH
+ CuO —t—> CH3-CHO
+ Cu + H2OСпирты
идентифицируются пробой Лукаса — конц.
раствор соляной кислоты и хлорида цинка.
При пропускании вторичного или третичного
спирта в такой раствор образуется
маслянистый осадок соответствующего
алкилхлорида:
CH3-CHOH-CH3
+ HCl —ZnCl2—>
CH3-CHCl-CH3↓
+ H2O
Первичные спирты в реакцию не
вступают.Еще одним известным методом
является иодоформная проба:
CH3-CH2-OH
+ 4I2
+ 6NaOH ——> CHI3↓
+ 5NaI + HCOONa + 5H2OКачественные
реакции на многоатомные спирты.
Наиболее
известная качественная реакция на
многоатомные спирты — взаимодействие
их с гидроксидом меди (II). Гидроксид
растворяется, образуется хелатный
комплекс темно-синего цвета. Обратите
внимание на то, что в отличии от альдегидов
многоатомные спирты реагируют с
гидроксидом меди (II) без нагревания. К
примеру, при приливании глицерина
образуется глицерат меди (II):
 Карбонильные
соединения( оксосоединения)- это
производные УВ, содерж в молекуле
карбонил группу С=О
Карбонильные
соединения( оксосоединения)- это
производные УВ, содерж в молекуле
карбонил группу С=О
Оксосоед делятся на альдегиды и кетоны. Альдегиды-это орган соед-я, молекулы которых содержат альдегидную группу, связанную с УВ радикалом С=О Р-я с аммиачны раствором оксида серебра(1) и щелочным раствором сульфата меди (2) явл-ся качественными р-ями.
CH3-CHO + 2[Ag(NH3)2]OH —t—>CH3-COOH + 2Ag↓ + 4NH3↑ + H2Oреакцией серебряного зеркалаВ ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду: HCOOH + 2[Ag(NH3)2]OH —t—> CO2↑ + 2H2O + 4NH3↑ + 2Ag↓ Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь: CuSO4 + 2NaOH ——> Na2SO4 + Cu(OH)2↓ CH3-CHO + 2Cu(OH)2 —t—> CH3-COOH + Cu2O↓ + 2H2O Выпадает оксид меди (I) Cu2O — осадок красного цвета.Еще один метод определения альдегидов — реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера: CH3-CHO + K2[HgI4] + 3KOH ——> CH3-COOK + Hg↓ + 4KI + 2H2Карбоновые кислоты- это производные УВ, содержфункцион карбоксил группу СООН. Формула: В зависимости от строения углеводородного радикала карбоновые к-ты делятся на предельные R=алкил, непредельные- производные непредельных УВ, ароматические. Азотосодержащие органические соединения. Амины- это производные аммиака(NH3), в молекуле которого один, два или три атома водорода замещены УВ радикалами. Аминокислоты-это произодные УВ, содерж аминогруппы( -NH2) и карбокс группы Качественные реакции на амины. На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO2. Для начала нужно ее приготовить, а затем добавить амин: NaNO2 + HCl ——>NaCl + HNO2Первичные дают азот N2:CH3-NH2 + HNO2 ——>CH3-OH + N2↑ + H2OВторичные — алкилнитрозоамины — вещества с резким запахом (на примере диметилнитрозоамина): CH3-NH-CH3 + HNO2 ——> CH3-N(NO)-CH3 + H2OТретичные амины в мягких условиях с HNO2 не реагируют.Анилин образует осадок при добавлении бромной воды: C6H5NH2 + 3Br2 ——> C6H2NH2(Br)3↓ + 3HBr
