
- •В.Н. Красноухова
- •Раздел I. Механика 7
- •Раздел I. Механика Кинематика материальной точки. Основные понятия и уравнения кинематики
- •Динамика. Основные законы и уравнения динамики
- •Законы сохранения
- •Механические колебания и волны
- •Примеры решения задач по механике
- •Задачи для самостоятельного решения по механике
- •Раздел II. Молекулярная физика Основные понятия и уравнения молекулярной физики
- •Изопроцессы идеального газа
- •Явления переноса
- •Примеры решения задач по молекулярной физике
- •Задачи для самостоятельного решения по молекулярной физике
- •Раздел III. Электричество и магнетизм Основные понятия и уравнения электродинамики
- •Электрический заряд. Электростатическое поле
- •Электроемкость конденсатора
- •Постоянный электрический ток
- •Электрический ток в растворах электролитов
- •Магнитное поле тока
- •Явление электромагнитной индукции. Самоиндукция
- •Электромагнитные колебания
- •Примеры решения задач по электродинамике
- •Задачи для самостоятельного решения по электродинамике
- •Раздел IV. Оптика Основные понятия и уравнения оптики
- •Основные световые характеристики. Фотометрия
- •Законы геометрической оптики
- •Основные точки и плоскости оптической системы
- •Построение оптических изображений
- •Волновая оптика. Интерференция света
- •Интерференция в тонких пленках
- •Дифракция света. Дифракция Френеля
- •Поляризация света
- •Примеры решения задач по оптике
- •Задачи для самостоятельного решения по оптике
- •Раздел V. Квантовая физика. Физика атома и ядра Тепловое излучение
- •Квантовые свойства света
- •Строение атома
- •Атомное ядро
- •Радиоактивность
- •Примеры решения задач по квантовой и атомной физике
- •Задачи для самостоятельного решения по квантовой и атомной физике
- •Литература
Примеры решения задач по молекулярной физике
Задача 1.
Какое число молекул содержится в идеальном газе, если он имеет при давлении Р=200 кПа и температуре Т=280 К объем, равный V=40 л?
|
N- ? |
СИ |
|
Р = 200 кПа Т = 280 К V=40 л Na= 6,02∙1023моль-1 R=8,31 Дж/(моль∙К)
|
2∙105Па
4∙10-2м3 |
Число молекул можно найти по формуле
![]() ,
(1)
,
(1)
где Na– число Авогадро. Количество вещества
ν найдем из уравнения Менделеева-Клапейрона
для идеального газа![]() ,
откуда
,
откуда![]() .
(2)
.
(2)
Выражаем из (1) Nи с учетом
(2) получаем:![]() .
.
Проверим размерность

Проведем вычисления:
![]() (шт).
(шт).
Ответ: число молекул при заданных условияхN=2,07∙1024шт.
Задача 2.
Некоторая масса одноатомного идеального газа изобарно нагревается, а затем, после изотермического сжатия и изохорного охлаждения возвращается в исходное состояние. Изобразить данный цикл в координатах P(V), P(T) и V(T).
|
Графики P(V),P(T) V(T). |
СИ |
|
Изобарное нагревание. Изотермическое сжатие. Изохорное охлаждение.
|
|
При изобарном нагревании для координат
Р(V) и Р(Т) проводим линию
перпендикулярно оси давления Р. Согласно![]() для изобарного процесса, имеется
линейная возрастаниеVиT(рис. а-в, участок 1).
для изобарного процесса, имеется
линейная возрастаниеVиT(рис. а-в, участок 1).
Изотермическое сжатие в координатах
Р(V) имеет вид гиперболы,
согласно![]() .
Для координат Р(Т) иV(Т)
- это прямая, перпендикулярная оси
температуры Т (рис.а-в, участок 2).
.
Для координат Р(Т) иV(Т)
- это прямая, перпендикулярная оси
температуры Т (рис.а-в, участок 2).

При изохорном охлаждении, так как
температура понижается, то согласно
![]() ,
давление (в координатах Р(Т)) также будет
линейно понижаться до первоначального
значения. Для координат Р(V)
иV(Т) - это прямая,
перпендикулярная оси объемаV(рис.а-в, участок 3).
,
давление (в координатах Р(Т)) также будет
линейно понижаться до первоначального
значения. Для координат Р(V)
иV(Т) - это прямая,
перпендикулярная оси объемаV(рис.а-в, участок 3).
Задача 3.
В баллоне находится азот при температуре 15ºС. Во сколько раз изменится давление газа, если из баллона выпустить 40% его массы, а температура при этом понизится на 8ºС?
|
Р2/Р1- ? |
СИ |
|
Т1= 15ºС Δm=40% ΔТ =8ºС
|
288 К
8 К |
Данная задача легко решается с применением
уравнения Менделеева-Клапейрона ![]() .
.
Запишем его для первого состояния газа:
![]() .
(1)
.
(1)
И для второго состояния (когда часть
газа выпущена):
![]() . (2)
. (2)
Считаем, что размер баллона не меняется, следовательно, процесс изохорный V1=V2=V. Учтем также, что Т2=Т1-8, аm2=m1-0,4m1=0,6m1.
Поделим уравнение (2) на уравнение (1):
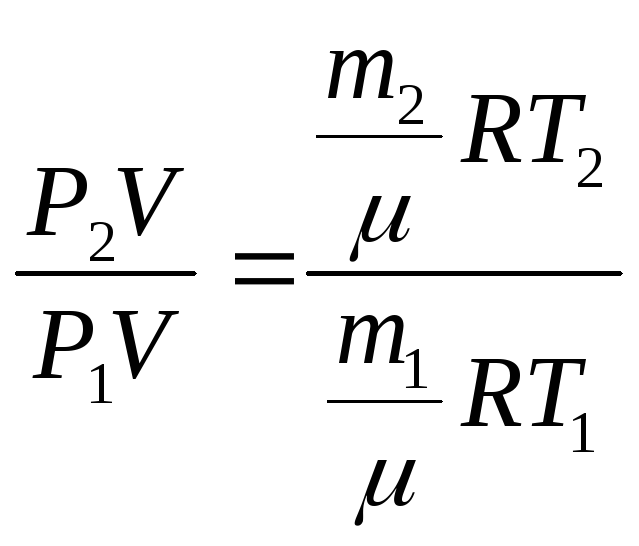 ,
,![]() .
.
Проверка размерности:
![]() .
.
Вычислим отношение:
![]() .
.
Ответ: давление уменьшится в 1,72 раза.
Задача 4.
Кислород массой m=2 кг занимает объем V1=1 м3 и находится под давлением Р1=2,02∙105 Па. Газ был последовательно нагрет при постоянном давлении до объема V2 = 3 м3, а затем при постоянном объеме до давления Р3=5∙105 Па. Найти изменение внутренней энергии ΔU, работу газа А и переданное газу количество теплоты Q.
|
ΔU- ? А- ? Q - ? |
СИ |
|
m=2 кг V1= 1 м3 Р1= 2∙105Па V2= 3 м3 Р2=Р1 Р3= 5∙105Па V3=V2 R=8,31 Дж/(моль∙К) i=5 μ=32∙10-3кг/моль
|
|
Изменение внутренней энергии ΔUнаходится по формуле:
![]() ,
(1)
,
(1)
где μ-молярная масса кислорода, а i- число степеней свободы. Так как кислород в нормальных условиях - двухатомная молекула, следовательно,i=5.
Полное изменение внутренней энергии
будет зависеть только от разности
начальной и конечной температуры Т1и Т3, которые найдем через уравнение
Менделеева-Клапейрона![]() .
.
Откуда ![]() . (2)
. (2)
Подставляя в (2) соответствующие значения Р и V, получим значения температуры:
![]() (К).
(К).![]() (К).
(К).
Подставляя в (1) числовые значения величин, получаем:
![]() (Дж).
(Дж).
Работа газа будет равна сумме работ
газа на каждом участке: А=Аизоб+Аизохор. Работа газа в изохорном
процессе равна 0, следовательно,![]() . (3)
. (3)
Температуру Т2найдем по формуле (2):
![]() (К).
(К).
Проведем расчет по формуле (3) и получим значение работы:
![]() (Дж).
(Дж).
Согласно первому началу термодинамики,
количество теплоты Q,
полученное газом, равно сумме работы
А, совершенной газом, и изменению
внутренней энергии ΔU:![]() .
.
Проведя вычисления, получим:
![]() (Дж).
(Дж).
Ответ: ΔU=3,25 МДж, А=0,4 МДж,Q=3,65 МДж.
Задача 5.
Тепловая машина совершает работу по циклу Карно. Температура нагревателя Т1=230ºС, холодильника Т2=300 К, причем холодильник этой тепловой машины служит нагревателем другой тепловой машины. У какой из машин КПД больше и во сколько раз, если разность температур нагревателя и холодильника у обеих машин одинакова?
|
η1/η2 - ? |
СИ |
|
Т1= 230ºС Т2= 300 К
|
503 К
|
КПД идеальной тепловой машины, работающий
по циклу Карно, находится по формуле
![]() ,
где Т1- температура, нагревателя,
а Т2– температура холодильника.
КПД первой машины:
,
где Т1- температура, нагревателя,
а Т2– температура холодильника.
КПД первой машины:![]() .
КПД второй машины:
.
КПД второй машины:![]() ,
так как разность температур Т1-Т2остается такой же, а температура
нагревателя Т’1, равна температуре
холодильника первой машины Т2.
Найдем необходимое отношение:
,
так как разность температур Т1-Т2остается такой же, а температура
нагревателя Т’1, равна температуре
холодильника первой машины Т2.
Найдем необходимое отношение:
 .
.
Проведем вычисление:
![]() .
.
Ответ: КПД второй машины в 1,68 раз больше, чем КПД первой тепловой машины.
Задача 6.
В калориметр с теплоемкостью 70 Дж/К было налито 0,3 л масла плотностью ρ=0,9 г/см3 при температуре 12ºС. После опускания в масло стального бруска (с=0,46 кДж/(кг∙К)) массой 400 г, имеющего температуру 120ºС, установилась общая температура 37ºС. Найти удельную теплоемкость масла.
|
смас - ? |
СИ |
|
С = 70 Дж/К V=0,3 л ρ= 0,9 г/см3 mст=400 г Т1= 12ºС Т2= 120ºС Т3= 37ºС сст=0,46 кДж/(кг∙К) |
0,3∙10-3м3 0,9∙103кг/м3 0,4 кг 285 К 393 К 310 К 460 Дж/(кг∙К) |
При опускании горячего металлического бруска происходит передача некоторого количества теплоты Qмаслу и калориметру. При этом брусок охлаждается до температуры Т3, а масло и калориметр нагреваются до Т3. Считая, что система изолирована от внешних источников тепла, составим уравнение теплового баланса:
Q1+Q2+Q3=0, (1)
где Q1- количество
теплоты, отдаваемое стальным бруском![]() ,Q2– количество
теплоты, получаемое калориметром
,Q2– количество
теплоты, получаемое калориметром![]() ,
аQ3– количество
теплоты, получаемое маслом
,
аQ3– количество
теплоты, получаемое маслом![]() .
Массу масла найдем через значения
объема и плотности:
.
Массу масла найдем через значения
объема и плотности:![]() . (2)
. (2)
Запишем уравнение (1) с учетом выражений для Q1,Q2,Q3и (2):
![]() ,
,
откуда выразим смас:
![]() .
.
Проверим размерность:
![]() .
.
Проведем вычисление:
![]() Дж/(кг∙К).
Дж/(кг∙К).
Ответ:удельная теплоемкость масла равна смас=2 кДж/(кг∙К).
Задача 7.
Определить изменение энтропии ΔS при изотермическом и изобарном расширении азота массой m=100 г от объема 20 л до 148 л.
|
ΔSизот - ? ΔSизобар - ? |
СИ |
|
m=100 г V1= 20 л V2= 148 л μ=28∙10-3кг/моль R=8,31Дж/(моль∙К) i= 5
|
0,1 кг 0,02 м3 0,148 м3 |
Выражение для нахождения энтропии:
![]() . (1)
. (1)
а) При изотермическом процессе Т=const, следовательно, ее выносим за знак интеграла. Тогда (1) применительно к изотермическому процессу примет вид:
![]() . (2)
. (2)
В изотермическом процессе
![]() .
Следовательно, выражение для
изменения энтропии в изотермическом
процессе (2) примет окончательный вид:
.
Следовательно, выражение для
изменения энтропии в изотермическом
процессе (2) примет окончательный вид:
 .
.
Проверим размерность:
![]() .
.
Проведем вычисление:
![]() (Дж/К).
(Дж/К).
б) В изобарном процессе Р=const,
а
![]() .
Внесем данное значение в выражение
(1):
.
Внесем данное значение в выражение
(1):![]() . (3)
. (3)
Так как в изобарном процессе изменение
температуры пропорционально изменению
объема
![]() ,
следовательно, выражение (3) примет вид:
,
следовательно, выражение (3) примет вид:
![]() .
.
Проведем вычисление:
![]() (Дж/К).
(Дж/К).
Ответ:изменение энтропии в изотермическом процессе ΔSизот=59,4 Дж/К, а в изобарном – ΔSизобар=207,75 Дж/К.
