
Принцип метода гель электрофореза
..pdf
должен охватывать весь диапазон молекулярных масс в данной системе. Образец маркерных молекул вносят в отдельную лунку, расположенную вблизи одного из краев пластинки (или в две лунки у двух разных краев). Логарифм относительной молекулярной массы маркера линейно связан с его электрофоретической подвижностью Rf — величиной, равной отношению расстояний, пройденных маркерной молекулой и красителем (фронтом растворителя). Построив график зависимости логарифма относительных молекулярных масс маркеров от Rf, можно найти относительную молекулярную массу каждого компонента образца. Относительная мол. масса белков измеряется в дальтонах, двухцепочечных нуклеиновых кислот - в числе пар нуклеотидов, одноцепочечных — в числе нуклеотидов.
Напряжённость электрического поля.
Разумный компромисс между скоростью и качеством фореза для высококачественных или препаративных форезов: ~2V/cm. Для анал и- тических форезов приемлемое качество сохр аняется до ~6V/cm.
Буфер для внесения. Выбор красителя:
Бромфеноловый синий и ксиленцианол - могут заметно мешать наблюдению фрагментов под UV.
Cresol red - совместим с ферментативными реакциями, пра к- тически не мешает наблюдению под UV.
OrangeG – наиболее подвижный краситель, практически вс е- гда находится вне "рабочей зоны". Заметен под UV.
Краситель в буфере нужен лишь для того, чтобы образец был легко з а- метен в лунке и в геле.
Буфер для внесения 10х :
SDS |
0.5% |
|
|
|
|
EDTA, pH8.0 |
0.1M |
|
|
|
|
глицерол |
50% |
|
|
|
|
H2 O |
|
|
|
Особенно широко агарозные гели применяются для электрофоретического разделения нуклеиновых кислот.
Нуклеиновые кислоты обладают значительным по величине отр и- цательным зарядом, величина которого мало зависит от рН окружа ю- щей среды, а отношение заряда к массе практически одинаково для всех нуклеиновых кислот. Поэтому фракционирование идет за счет ра з- личия в размерах молекул. Выбор буфера в данной ситуации не играет
11
существенной роли. Используют 0,089М Трис -боратный, 0,05 Трисфосфатный и Трис-ацетатный буфер.
Широкий диапазон молекулярных масс исследуемых фра г- ментов нуклеиновых кислот определяет широкий диапазон концентр и- рованности ПААГ и агарозного геля. Примеры определения процентн о- сти гелей приведены выше в соответствующем разделе. Однако необ ходимо отметить, что обычные варианты гель -электрофореза не позволяют разделить фрагменты ДНК, размер которых превышает 50 т.п.н. Данное затруднение удалось преодолеть после того, как в 1984г. Был разработан метод гель-электрофорез с пульсирующим полем ( pulsed field gel electrophoresis, PFGE), называемый также пульс -электрофорез. Показано, что если с некоторой частотой менять определенным образом направление электрического поля, то молекулы ДНК размером до 10млн. п.н. приобретают способность переориентирова ться и проходить
через поры в обычном агарозном геле. Гель помещается в ячейку, им е- ющую форму шестиугольника, на каждой стороне которого расп оложено по 4 электрода. Периодическое изменение направления вектора электрического поля под углом 120 0 обеспечивает возможность разделения гигантских молекул ДНК. Пульс -электрофорез явился новым мощным методом изучения молекулярной организации гигантских ДНК. Редкощепящие рестриктазы, узнающие последовательность из 8п.н., гидролизуют ДНК, как правило, с образованием оч ень крупных
фрагментов, которые удается разделить только с помощью этого мет о- да. Эти фрагменты можно переносить из геля на нитроцеллюлозную мембрану по Саузерну. Для этого ДНК фрагментируют в геле, облучая после окраски бромистым этидием или расщепляя хими чески. Объединение пульс-электрофореза с блоттингом по Саузерну позволяет карт и- ровать гены, анализировать перестройки в хромосомах, выявить инт е- грацию чужеродных последовательностей в определенные хромосомы, изучать библиотеки клонирования крупных фрагмент ов ДНК и т.д.
Электрофорез нуклеиновых кислот сильно зависит от вт о- ричной структуры. Двунитевая молекула имеет более жесткую структ у- ру, труднее изгибается, проходя через пространственную сетку геля. Однако для молекул с молекулярной массой больше 3,5млн.д альтон ситуация обратная: двунитевая молекула обладает достаточной гибк о- стью, чтобы проходить через сетку геля, в то время как однонитевая молекула той же длины сворачивается в хаотический клубок такого размера, что ее продвижение затрудняется. Вирусные и митохондриальные двунитевые ДНК, а также плазмиды бактерий могут иметь структуру замкнутого двунитевого кольца. Нативное состояние такого кольца - «сверхскрученое». Кольцо в целом сворачивается в «жгут», что сильно увеличивает его компактность (форма1). Ес ли же хотя бы в одной нити кольца имеется единичный разрыв, то жгут разворачивается и силами электростатического отталкивания фосфатных групп кольцо расправляется. Компактность молекулы становится меньше, размеры
12
увеличиваются (форма2). Форма1 при электроф орезе всегда мигрирует быстрее формы2. Линейная двунитевая молекула ДНК (форма3) может мигрировать быстрее или медленнее, чем сверскрученое кольцо один а- ковой с ней молекулярной массы, в зависимости от среднего размера пор геля. Для крупнопористого геля име ет значение размер молекулы, а для мелкопористого - большая гибкость линейной молекулы. Чем больше напряженность электрического поля, тем при более низкой концентрации геля агарозы проявляется преимущество гибкости фо р- мы3. Скорость миграции линейных двун итевых молекул ДНК уменьшается с увеличением их молекулярной ма ссы, но лишь до определенного предела. При молекулярной массе более 5млн. в 1,6% -ном геле агарозы и более 12млн. в 0,8%-ном геле линейные молекулы ДНК мигрируют с одинаковой скоростью независимо от их молекулярной массы и, след о- вательно, не могут быть разделены электрофорезом. Это происходит вследствие гибкости длинных мол екул ДНК, их противоположные ко н- цы мигрируют в электрическом поле независимо друг от друга, и вся молекула, извиваясь, проходит через гель одинаково при всей ее длине. Для разделения таких молекул используется уже рассмотренный выше пульс-электрофорез. РНК может иметь существенно более нев ы- годную для миграции в геле втори чную структуру, чем ДНК. У крупных молекул РНК эта структур а представлена многочисленными, то р- чащими во все стороны «шпильками». Такая молекула не может прох о- дить через поры геля «извиваясь ужом». Поэтому, например, РНК с массой 0,7млн. дальтон даже не входит в 5% -ный ПААГ. Нечто аналогичное может происходить и пр и частичной денатурации ДНК.
Во многих случаях электрофореза бывает желательно оц е- нить молекулярные размеры фракционируемых нуклеиновых кислот. Для этого удобно иметь набор молекул того же типа, но известной дл и- ны. В настоящее время имеется большое количе ство коммерческих маркеров на основе фага лямбда или DNA ladders, дающие при электрофорезе ряд последовательных полос на треке, соответствующих фрагментам определенной массы. В качестве лидирующих красителей используют бромфеноловый синий и ксиленцианол.
Так, для регистрации продуктов реакции амплификации ДНК и с- пользуют электрофорез в агарозном геле в присутствии бромистого этидия. Бромистый этидий образует с фрагментами ДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФ-излучением с длиной волны 290 -330 нм.
В лунки геля наносится амплификат, уже содержащий лидиру ю- щий краситель. Форму с гелем, содержащим нанесенные образцы пер е- носят в камеру для электрофореза, заполненную буфером, камеру по д- ключают к источнику питания (напряжение 10 -15 В/см длины геля), и проводят электрофоретическое разделение продуктов амплификации в
13
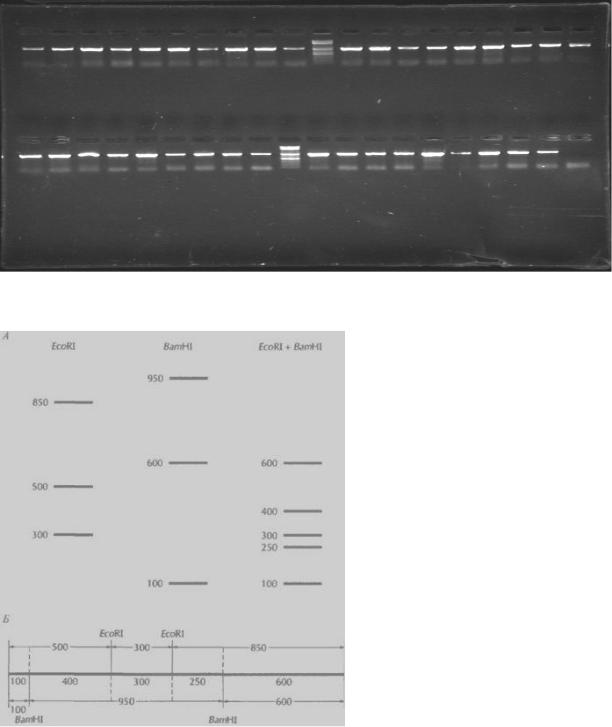
направлении от катода к аноду. Контроль за электрофоретическим ра з- деление осуществляется визуально по движению полосы красителя. По окончании электрофоретического разделения вынимают гель из формы и просматривают в ультрафиолетовом свете с помощью УФ - трансиллюминатора (желательно фотографируют). Фрагменты анализ и- руемой ДНК проявляются в виде светящихся оранжево -красных полос.
Рис.2. Электрофорез продуктов амплификации ДНК.
Рис.3 Картирование сайтов рестрикции. А. Результаты гельэлектрофореза фрагментов ДНК, полученных ее расщеплением указа н-
14
ными ферментами. Очищенную ДНК гидролизовали рестриктазами EcoRI и BamHI раздельно, а затем их смесью, проводили гель - электрофорез и визуализировали продукты о крашиванием бромистым этидием. Числа слева от горизонтальных полос -длина фрагментов в парах оснований.
Б. Рестрикционная карта, построенная по электрофоретическим данным. Числа — расстояние между сайтами узнавания соответству ю- щих ферментов.
Преимущества агарозного геля в качестве твердого носителя для электрофореза:
прочность агарозного геля;
крупнопористость (позволяющая разделять особенно крупные молекулы, в частности нуклеиновые кислоты);
агарозный гель является очень мягким носителем (т.е. в о т- личие от электрофореза на бумаге, например, при нем не происходит инактивации белков, что позволяет определять активность отдельных фракций белков после проведения электрофореза);
приготовление агарозного геля значительно проще, чем крахмального и полиакриламидного;
относительно небольшая продолжительность электрофореза (сильно варьирует в зависимости от варианта метода);
относительная дешевизна метода.
Таким образом, электрофорез в агарозном геле в различных мод и- фикациях широко применяется как метод разделения макромолекул в биологии и медицине.
15
