
- •Кафедра биоорганической химии БГМУ
- •Эпиграф к курсу лекций по БОХ
- •БИООРГАНИЧЕСКАЯ ХИМИЯ
- •Цель изучения биоорганической химии -
- •История становления биоорганической химии
- •Этапы развития химии природных соединений
- •Этапы развития органической химии
- •Этапы развития органической химии.
- •Химические и биологические процессы
- •БИОЛОГИЧЕСКИЕ ПРОЦЕССЫ
- •Биологические процессы
- •акад. Виталий Гольданский
- •Уровни исследования живых организмов
- •Специфика биоорганического подхода к изучению жизнедеятельности
- •Объекты, изучаемые биоорганической химией
- •Объекты, изучаемые биоорганической химией
- •Теоретическая основа БОХ
- •ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ. СТЕРЕОИЗОМЕРИЯ
- •Химическое строение и структура
- •I валентное состояние - sp3 - гибридизация
- •МОДЕЛИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Тетраэдрический угол 109,5 °
- •СТЕРЕОХИМИЯ
- •Изомеры
- •Стереоизомеры – это соединения, в молекулах которых имеется одинаковая последовательность атомов и химических
- •Основы стереохимии заложены работами Вант-Гоффа и Ле Беля (1874 г.), которые независимо друг
- •КЛАССИФИКАЦИЯ СТЕРЕОИЗОМЕРОВ
- •Конформационные стереоизомеры
- •Энергетическая характеристика конформаций этана
- •Определение конформаций
- •В стереохимии молекулу рассматривают как геометрическое тело в трехмерном пространстве
- •Элементы симметрии :
- •ОСЬ СИММЕТРИИ
- •Плоскость симметрии – это плоскость, проходящая через молекулу или атом с его заместителями,
- •4 оси 3-го порядка
- •бутанол-2
- •ХИРАЛЬНОСТЬ
- •ХИРАЛЬНЫЕ МОЛЕКУЛЫ
- •ОПТИЧЕСКАЯ АКТИВНОСТЬ
- •общая схема поляриметра
- •Поляризованный свет
- •Один из стереоизомеров вращает плоскость поляризованного света по часовой стрелке и называется правовращающим
- •МОЛОЧНАЯ КИСЛОТА
- •ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА
- •ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА
- •Относительная D-, L- номенклатура
- •ЭНАНТИОМЕРЫ МОЛОЧНОЙ КИСЛОТЫ
- •Определение конфигурации
- •ЭНАНТИОМЕРИЯ
- •РАЦЕМИЧЕСКАЯ СМЕСЬ
- •СТЕРЕОИЗОМЕРЫ ЯБЛОЧНОЙ КИСЛОТЫ
- •Стереоизомеры винной кислоты
- •СOOH
- •D- и L – винные кислоты - энантиомеры
- •Абсолютная конфигурация стереоизомеров
- •R,S-номенклатура (КИП)
- •R,S-НОМЕНКЛАТУРА
- •R,S-номенклатура
- •R,S-номенклатура
- •СВЯЗЬ ПРОСТРАНСТВЕННОГО СТРОЕНИЯ СОЕДИНЕНИЙ С ИХ
- •Определение комплементарности
- •ТЕОРИЯ ФИШЕРА
- •Теория индуцированного соответствия Кошленда
- •Связь пространственного строения соединений
- •Схема взаимодействия энантиомеров адреналина с рецептором
- •талидомид
- •ДЕТИ – ЖЕРТВЫ ТАЛИДОМИДА
- •СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВ
- •СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВ
- •СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВ
- •АФФИННАЯ ХРОМАТОГРАФИЯ
- •ПЕДФАКУ ПОСВЯЩАЕТСЯ
- •В завершение лекции
- •БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- •R,S-НОМЕНКЛАТУРА
- •бутанол-2
- •М. Ломоносов 1751
- •Для выделения соединения из биологического материала
- •Особенности биоорганического подхода
- •Уровни изучения живого
- •К теории топохимического соответствия

Химическое строение и структура
Химическое строение (по А.М.Бутлерову -конституция) - последовательность соединения атомов в молекуле с учетом характера химических связей между ними.
В современное понятие Структура включают как химическое строение , так и взаимное пространственное расположение атомов (их ядер) друг относительно друга – конфигурацию и конформации.
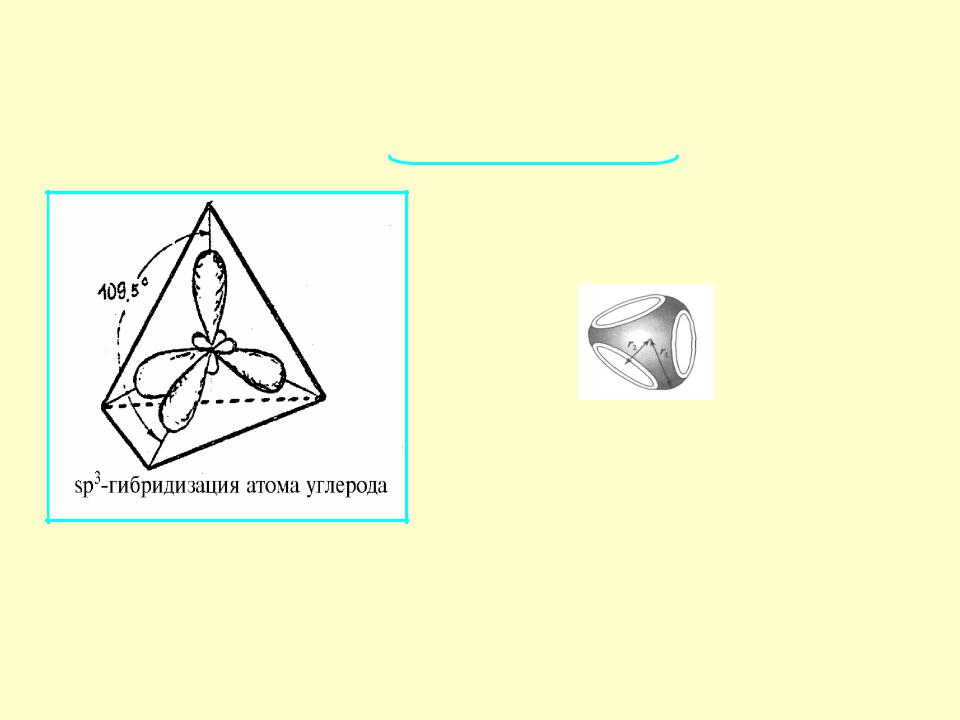
I валентное состояние - sp3 - гибридизация
1s22s12px12py12pz1
sp3
Атом углерода- тетрагональный
или тетраэдрический
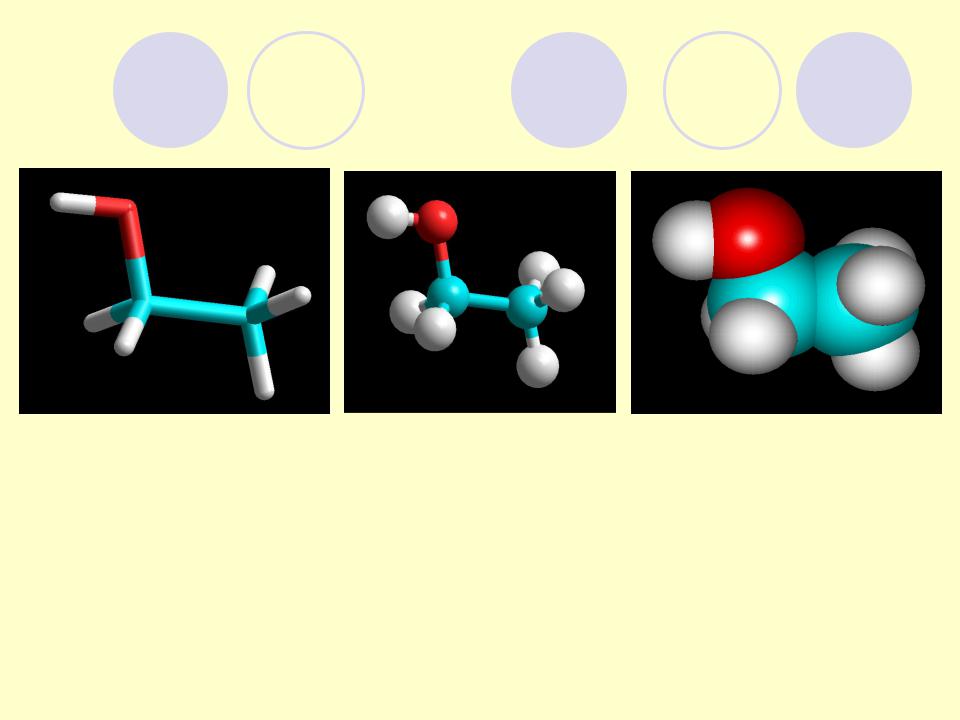
МОДЕЛИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1 |
2 |
3 |
1 |
1-скелетные, 2-шаростержневые (Кекуле), полусферические (Стюарта- Бриглеба).
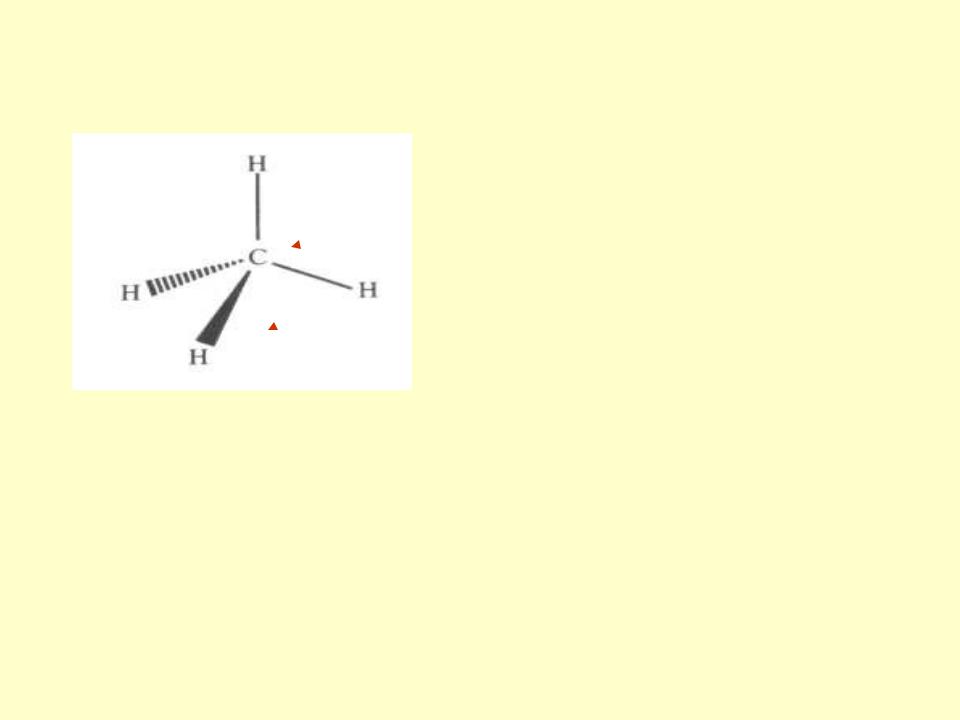
Тетраэдрический угол  109,5 °
109,5 °
«клиновидная» стереохимическая формула

СТЕРЕОХИМИЯ
–раздел химической науки, изучающий
пространственное строение органических соединений и его влияние на физические и химические свойства, механизм реакций.
Изомерами называются соединения с одинаковым элементным составом, но отличающиеся последовательностью связывания атомов и (или) расположением их в пространстве
Изомеры
Изомеры строения |
|
Пространственные |
|
|
(стереоизомеры) |
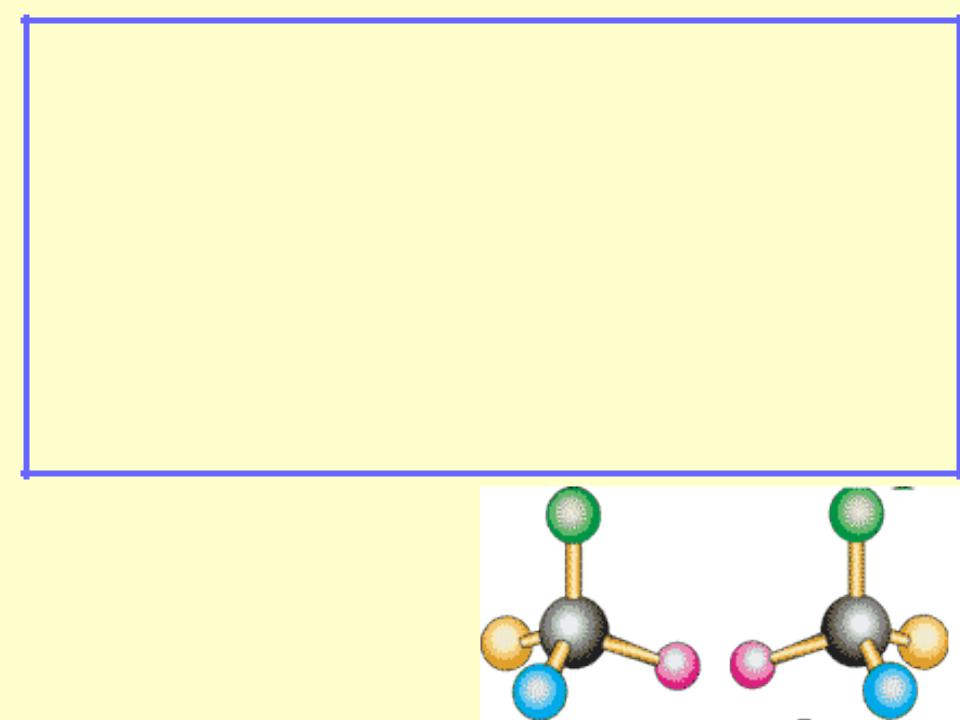
 Стереоизомеры – это соединения, в молекулах которых имеется одинаковая последовательность атомов и химических связей между ними, но различное
Стереоизомеры – это соединения, в молекулах которых имеется одинаковая последовательность атомов и химических связей между ними, но различное
расположение этих атомов относительно хирального центра или плоскости двойной связи.

 Основы стереохимии заложены работами Вант-Гоффа и Ле Беля (1874 г.), которые независимо друг от друга высказали мысль
Основы стереохимии заложены работами Вант-Гоффа и Ле Беля (1874 г.), которые независимо друг от друга высказали мысль
|
о тетраэдрической направленности |
|
|
валентных орбиталей атома С |
|
Вант-Гофф |
(конфигурации sp3-гибридного |
|
|
атома углерода ) |
Ле Бель |
|
|
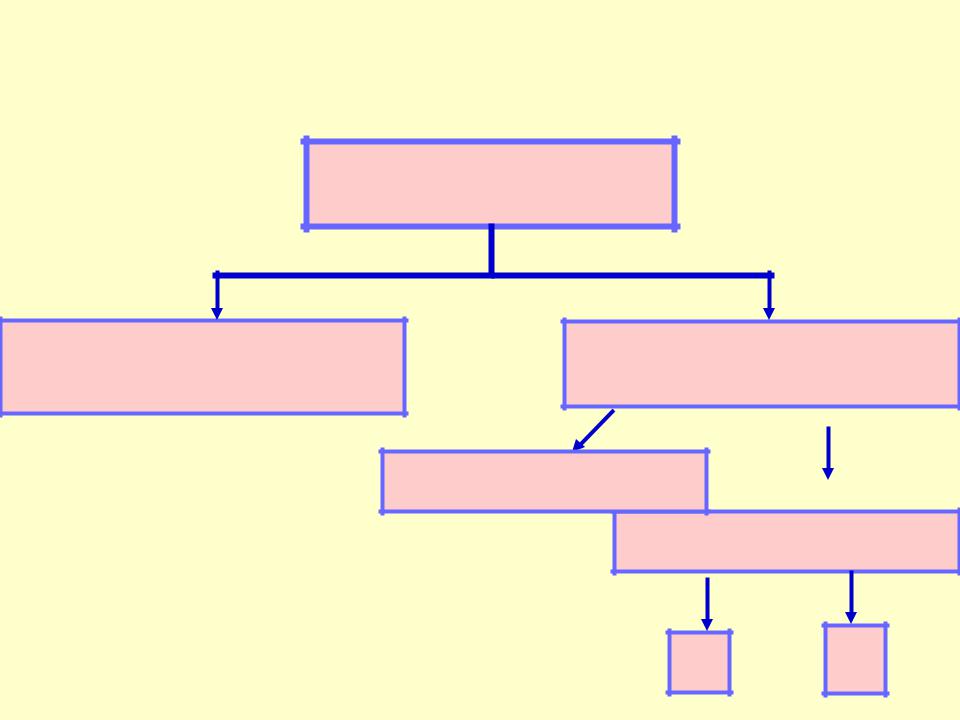
КЛАССИФИКАЦИЯ СТЕРЕОИЗОМЕРОВ
Стереоизомеры
Конформационные Конфигурационные
энантиомеры
диастереомеры
σ- π-
l – 0,109 нм
С Н |
Е – 414 кДж/моль |
|
|
|
|
|
|
|
l – 0,154 нм |
С |
|
С |
||||
|
|
Е – 348 кДж/моль |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
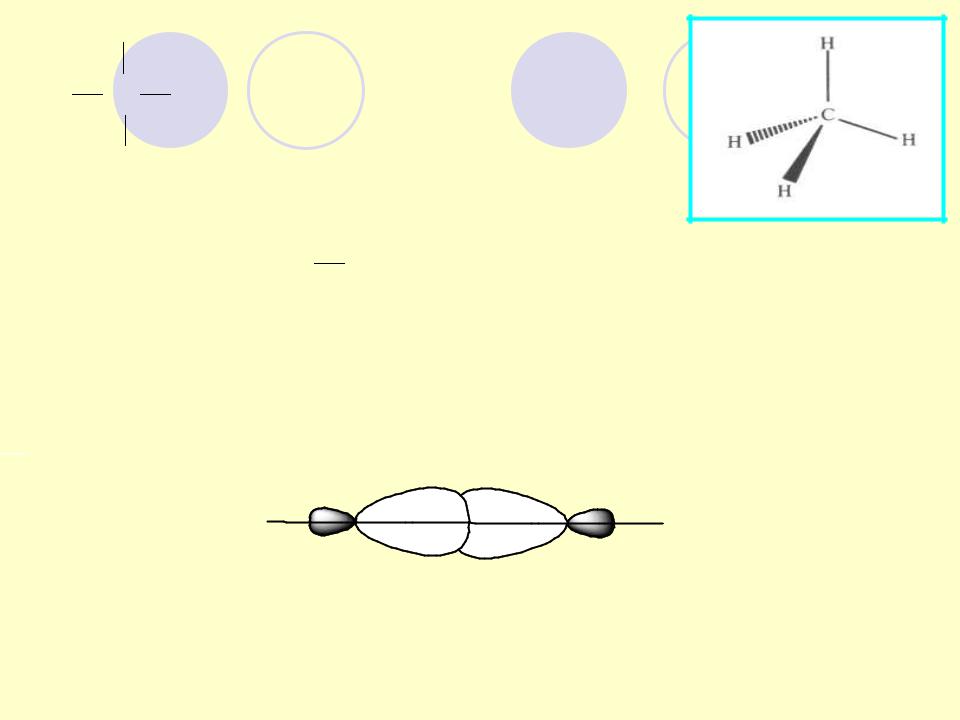
σ-связь – ковалентная связь, образованная при перекрывании атомных орбиталей по оси, соединяющей ядра двух связываемых
атомов с максимумом перекрывания на этой оси
σ-связь имеет вращательную ось симметрии
