- •Государственное образовательное учреждение
- •Содержание
- •Список сокращений
- •Гнг - глюконеогенез
- •Тгфк – тетрагидрофолиевая кислота ттг – тиротропный гормон
- •1. Строение печени
- •2. Функции печени
- •2.1. Участие печени в углеводном обмене
- •Гликолиз удф-глюкуроновая гл Мононуклеотиды кислота пг
- •Между обменами глюкозы и этанола в печени
- •2.2. Роль печени в метаболизме липидов
- •2.3. Печень и обмен азотсодержащих соединений
- •2.4. Роль печени в судьбе витаминов
- •2.5. Функции печени в минеральном обмене
- •2.6. Значение печени в регуляции
- •2.7. Биотрансформационная функция печени
- •3. Лабораторная диагностика заболеваний печени
- •Функциональные пробы печени
- •4. Основные клинико-лабораторные синдромы при поражениях печени
- •4.1. Синдром цитолиза
- •4.2. Синдром холестаза
- •4.3. Синдром гепатодепрессии
- •4.4. Синдром воспаления
- •Биохимическая лабораторная диагностика синдрома воспаления:
- •4.5. Синдром шунтирования печени
- •4.6. Синдром регенерации
2.3. Печень и обмен азотсодержащих соединений
1.Для аминокислот, поступающих из кишечника или высвободившихся при гидролизе тканевых белков, печень исполняет роль диспетчера (схема 5). С её помощью поддерживается аминокислотный гомеостаз плазмы крови. Часть пула этих соединений орган использует для собственных нужд. И естественно, что некоторую невостребованную долю аминокислот печень стремится отложить про запас. Но так как данные вещества, являясь низкомолекулярными, при своём накоплении грозят ростом осмотического давления, гепатоциты находят следующий выход. Используя аналогию с накоплением гликогена с помощью полимеризации глюкозы, клетки синтезируют из аминокислот белки; правда, они их не удерживают в цитоплазме как вышеуказанный гомополисахарид, а отправляют в плазму крови. При потребности (например, при полном или белковом голодании) эти протеины служат источниками необходимых аминокислот. К слову, белки самой печени в норме обновляются полностью каждые 20 суток.
2.Все альбумины, 75-90% α-глобулинов, 50% β-глобулинов плазмы синтезируются гепатоцитами, лишь γ-глобулины производятся системой макрофагов, в том числе и клетками Купфера.
3.Печень – единственный орган, способный к генезу белковых факторов свертывания крови (протромбина, фибриногена, проконвертина, акцелератора глобулина, фактора Кристмаса, фактора Стюарта-Прауэра).
4.В то же время часть естественных основных антикоагулянтов (антитромбин III, протеин С и др.) также синтезируется в печени.
5.Гепатоциты также как эндотелий, моноциты, фибробласты и другие клетки участвуют в образовании некоторых ингибиторов фибринолиза.
6.Регуляторы эритропоэза – эритропоэтины – образуются в печени.
7.Гликопротеин гаптоглобин, вступающий в комплекс с гемоглобином для предупреждения его выделения почками (с возможным провоцированием острой почечной недостаточности), тоже имеет печёночное происхождение. Данное соединение принадлежит к белкам острой фазы воспаления, обладает пероксидазной активностью.
8.Церулоплазмин, также являющийся гликопротеином, синтезируемым печенью, можно считать внеклеточной супероксиддисмутазой, что позволяет защищать мембраны клеток; мало того, он стимулирует продукцию антител. Подобным действием, только на клеточный иммунитет, обладает трансферрин, полимеризация которого осуществляется гепатоцитами.
9.Ещё один углеводсодержащий белок, но с иммуносупрессивными свойствами, способен синтезироваться печенью – α-фетопротеин, рост концентрации которого в плазме крови служит ценным маркёром некоторых опухолей печени, яичек и яичников.
10.Среди α-глобулинов, синтезируемых печенью, следует выделить α1-антитрипсин, α2-макроглобулин – ингибиторы протеаз, белки острой фазы воспаления.
Аминокислоты Белки печени Белки
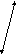 плазмы
крови
плазмы крови
плазмы
крови
плазмы крови



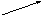 глутатион
глутатион


 Аминокислоты
Специфические КоА
Аминокислоты
Специфические КоА


 продукты
продукты


 ГНГ
креатин
ГНГ
креатин
Таурин Гем Этаноламин
Г люкозо-6-фосфат
люкозо-6-фосфат
Нуклеотиды
 NH3
Холин
NH3
Холин
 ТАГ
ТАГ



α-кето-
кислоты

 Ацил-КоА
Ацетил-КоА
Ацил-КоА
Ацетил-КоА

 ВЖК
Мочевина
ВЖК
Мочевина

 ОА
ОА

Фосфолипид ЦТК
Холестерин Кетоновые тела
Схема 5. Основные этапы превращений аминокислот в печени
11.Источниками большей части протеинов системы комплемента являются не только макрофаги, моноциты, но и гепатоциты.
12.В печени активно протекает метаболизм аминокислот (схема 5). Основная масса поступающих или образовавшихся с помощью транс-аминирования и других реакций (в которых участвует тетрагидрофолиевая кислота - ТГФК) аминокислот затрачивается на синтез различных специфических и неспецифических белков (см. выше).
Другая часть идет на синтез самых разных низкомолекулярных соединений. Так, гликогенные аминокислоты могут служить источниками не только глюкозо-6-фосфата (см. выше), но и глицеральдегид-3-фосфата, судьба которого имеет несколько направлений, в том числе может закончиться образованием глицерол-1-фосфата (см. выше). Из кетогенных аминокислот, как отмечено выше, синтезируются кетоновые тела.
Но в гепатоцитах отдельные аминокислоты подвергаются специфическим преобразованиям:
А) из серосодержащих аминокислот образуется таурин, который позднее включается в парные жёлчные кислоты (таурохолевая, тауродезоксихолевая), а также может служить антиоксидантом, связывая гипохлорит анион, стабилизировать мембраны клеток;
Б) в гепатоцитах происходит активация метионина, который в виде S-аденозилметионина служит источником метильных групп в следующих реакциях:
а) окончание генеза креатина:
 гуанидинацетат
+ SAМ
креатин + S-аденозилгомоцистеин;
гуанидинацетат
+ SAМ
креатин + S-аденозилгомоцистеин;
б) синтез холина для холинфосфатидов (липотропных веществ):
 этаноламин
+ SAМ
холин + S-аденозилгомоцистеин.
этаноламин
+ SAМ
холин + S-аденозилгомоцистеин.
13.По наличию гема (субстраты для его синтеза - сукцинил КоА и аминокислота глицин) печень занимает 2 место за эритроцитами, так как это соединение является облигатным компонентом цитохрома Р450 (гидроксилирующего ксенобиотики, см. ниже).
14.В печени завершается катаболизм многих азотсодержащих соединений. Все они служат источником аммиака (из –NH2), который при растворении дает сильную щёлочь – гидроксид аммония. Поэтому во всех клетках организма, где он образуется, в ответ начинают работать различные буферные системы, альфа-кетокислоты, которые его нейтрализуют. Но этот промежуточный процесс должен закончиться в печени инактивацией полученных соединений. Подобное химическое явление получило название орнитинового цикла синтеза мочевины (или цикла Кребса I по имени исследователя, описавшего его ключевые звенья) (схема 5).
15.Ароматические азотсодержащие соединения, в первую очередь пуриновые основания, являясь конденсированными гетероциклами, не способны подвергаться распаду. Поэтому после неоднократных гидроксилирований преобразуются в мочевую кислоту(точнее в её соли –ураты). Этот процесс, как и предыдущий, описан только в гепатоцитах.
16.Как известно, разрушение старых и больных эритроцитов осуществляется клетками РЭС, в том числе печени. При этом деградация гема завершается образованием билирубина – потенциально токсического соединения. Где бы ни синтезировался, он должен быть доставлен в гепатоциты для окончательной инактивации. Ключевую роль в этой ситуации играет фермент УДФ-глюкуронилтрансфераза (УДФГ-трансфераза), с помощью которой и получаются относительно растворимые билирубинмоно- и билирубиндиглюкурониды (связанный билирубин), выделяющиеся из организма в составе жёлчи.
При подавляющем большинстве заболеваний внутренних органов, сопровождающихся сдвигами в белковом обмене, обнаруживается гипопротеинемия, носящая обычно вторичный, приобретённый характер. Абсолютную гипопротеинемию, возникающую, как правило, из-за снижения величин альбуминов, обусловливают многочисленные причины (недостаточное поступление белков с пищей, их повышенный распад в организме, потеря с кровью и мочой, перемещение в другие ткани при формировании экссудатов и отёков, генетически детерминированные нарушения в генезе ферментов), а также подавление протеосинтетической функции печени. Последнее наблюдается при паренхиматозных гепатитах и циррозах.
Более половины всего количества белков плазмы (35-55 г/л) приходится на долю альбуминов, которые обновляются достаточно быстро: в течение суток образуется и разрушается 10-16 г подобных соединений. Благодаря значительной концентрации, высокой гидрофильности и небольшим размерам молекул они выполняют важную функцию по поддержанию коллоидоосмотического давления плазмы, тем самым участвуя в обмене воды между кровью и межтканевым пространством.
При содержании указанной фракции протеинов в плазме крови ниже 30 г/л онкотическое давление уменьшается настолько, что вода переходит из внутри- во внесосудистый сектор, что может обусловить возникновение отёков. Определение уровня альбуминов в сыворотке крови играет существенную роль для оценки тяжести течения заболеваний, сопровождающихся гипоальбуминемией, одной из причин которой является распад гепатоцитов.
Вторичная гипоальбуминемия наблюдается при альтерациях печени, портальном циррозе, длительной механической желтухе. Снижение цифр данных белков крови при хронических поражениях органа (тяжёлом длительном вирусном гепатите, циррозах печени) имеет прогностическое значение и служит неблагоприятным признаком. При острых повреждениях гепатоцитов определение содержания альбуминов в биологических жидкостях особого значения не имеет.
Для диагностики заболеваний внутренних органов большую значимость приобретает комплексная оценка количественных вариаций всех выявляемых белковых фракций. Принято выделять несколько, нередко разных по патофизиологической природе типов изменений в их спектре, отражающих как дис-, так и парапротеинемии. Отдельные типы электрофореграмм включают следующие сдвиги в профиле сывороточных протеинов (табл. 2):
Таблица 2. Типы протеинограмм, соответствующие определённым видам заболеваний внутренних органов
|
№ |
Тип протеинограммы, соответствующий |
Альбу-мины |
Глобулины | |||
|
α1 |
α2 |
β |
γ | |||
|
1. |
Острым воспалительным процессам |
|
|
|
|
|
|
2. |
Хроническому воспалению |
|
|
|
|
|
|
3. |
Нефротическому симптомокомплексу |
|
|
|
|
|
|
4. |
Злокачественным новообразованиям |
|
|
|
|
|
|
5. |
Гепатитам |
|
|
|
|
|
|
6. |
Циррозам печени |
|
|
|
|
|
|
7. |
Обтурационной желтухе
|
|
|
|
|
|

Примечание: - значительное увеличение; - умеренное увеличение;
 -
уровень не меняется;
-
уровень не меняется;

 -
значительное снижение; - умеренное
снижение;
-
значительное снижение; - умеренное
снижение;
1-й тип протеинограмм характеризуется резким снижением величин альбуминов и возрастанием уровня α-1- и α-2-глобулинов. Такая диспротеинемия обусловлена усиленным синтезом белков острой фазы (α-1- и α-2-глобулинов, составляющих группу гликопротеинов) и подавлением продукции альбуминов в гепатоцитах (вследствие интоксикации, отчасти компенсаторной). Чаще наблюдается при острых воспалительных процессах, а также при обширном свежем инфаркте миокарда, сепсисе, начальной стадии пневмонии, туберкулёзе лёгких, остром полиартрите.
2-й тип протеинограмм отличается умеренным падением доли альбуминов и значительным увеличением концентрации α-2- (нередко α-1-) и γ-глобулинов. Последние усиленно синтезируются системой мононуклеарных фагоцитов. Цифры общего белка и β-глобулинов в крови сохраняются в пределах нормы. Специфический признак – снижение коэффициента альбумины/(α-2- + γ-глобулины) менее 2,2. Встречается при синдроме хронического воспаления (холецистит, поздняя стадия пневмонии, хронические формы туберкулёза лёгких).
В 3-м типе протеинограмм регистрируется значительное уменьшение величин альбуминов, повышение значений α-2- и β-глобулинов при умеренном падении уровня γ-глобулинов. Данный тип изменений свойственен синдрому нарушения функции почечного фильтра.
У 4-го типа протеинограмм выявляется вилка, подобная 3-му типу, только фиксируется подъём количества всех глобулиновых фракций (вследствие их гиперпродукции в ответ на угнетение синтеза альбуминов, обусловленное синдромом интоксикации). Именуется типом злокачественных новообразований.
5-й тип протеинограмм связан с умеренным уменьшением концентрации альбуминов (из-за нарушения протеосинтетической функции гепатоцитов), ростом долей γ-глобулинов (в силу «раздражения» системы мононуклеарных фагоцитов и усиления продукции IgG, IgA, IgM) и менее выраженным накоплением β-фракции. Наблюдается при гепатитах, последствиях токсического повреждения печени. Уровень общего белка крови сохраняется в пределах нормальных границ.
6-й тип протеинограмм отличает глубокая гипоальбуминемия с параллельным падением в классе α-2-глобулинов (из-за глубоких дистрофических повреждений гепатоцитов) при сильном увеличении (отчасти компенсаторном) цифр γ-глобулинов (за счёт IgA, IgG). Обнаруживается при циррозе печени.
7-й тип протеинограмм включает уменьшение содержания альбуминов с небольшим повышением величин α-2-, β- и γ-глобулинов. Встречается при обтурационной желтухе, вызванной наличием камней в общем жёлчном протоке, закупоркой его раковой опухолью, злокачественным новообразованием в головке pancreas (что создаёт механическое препятствие оттоку жёлчи).