
- •Введение в обмен веществ
- •Основные особенности разных фаз метаболизма
- •Глава I. Энергетический обмен
- •1.1. Свободная энергия и законы термодинамики
- •1.1. Макроэргические соединения
- •Стандартная свободная энергия гидролиза органических фосфатов
- •1.1.2. Пути синтеза атф и его роль
- •1.1.3. Окислительно – восстановительное равновесие, окислительно –восстановительный потенциал
- •Стандартные потенциалы некоторых окислительно- восстановительных систем
- •1.2. Биологическое окисление
- •1.2.1. Характеристика биологического окисления
- •Строение комплексов полиферментного ансамбля дыхательной цепи митохондрий
- •1.2.2. Сопряжение биологического окисления и окислительного фосфорилирования
- •1.2.3. Регуляция скорости дыхания митохондрий
- •1.2.4. Разобщение дыхания и фосфорилирования
- •Краткая характеристика некоторых ионо(протоно)форов
- •1.2.5. Патология биоэнергетических процессов
- •II. Наследственные и приобретенные дефекты в работе промежуточных переносчиков этц:
- •III. Недостаток кислорода (гипоксия):
- •IV. Наличие разобщителей биологического окисления и фосфорилирования.
- •1.2.6. Механизмы защиты от токсического действия кислорода
- •А) Антиоксиданты ферментативной природы
- •Б) Антиоксиданты неферментативной природы
- •Роль катионов металлов с переменной валентностью в свободно-радикальных реакциях
- •В) Антиоксиданты внеклеточных жидкостей
- •1.3. Микросомальное окисление
- •Глава II
- •2.1.2. Регуляция процесса окисления пирувата
- •2.1.3. Патология декарбоксилирования пирувата
- •2.2. Цикл трикарбоновых кислот
- •2.2.1. Последовательность реакций цтк
- •2.2.2. Энергетическая ценность процесса
- •Образование макроэргических соединений в цтк
- •2.2.3. Участие витаминов в цтк
- •2.2.4. Биологические функции цикла Кребса
- •2.2.5. Регуляция превращений цитрата
Глава II
ОБЩИЕ ПУТИ КАТАБОЛИЗМА
В пище человека практически не содержатся готовые первичные доноры водорода, служащие субстратами для биологического окисления. Они образуются в ходе катаболизма; причем именно в его последней стадии - неспецифическом распаде. Следовательно, метаболиты окислительного декарбоксилирования пирувата и цитратного цикла выполняют роль необходимых субстратов.
2.1. Окислительное декарбоксилирование ПВК
2.1.1. Сущность преобразований пирувата
П

Таблица 7.
Ферменты пируватдегидрогеназного комплекса
|
Название фермента-протомера |
Обозначение |
Простетическая группа |
Катализируемая реакция |
|
Пируватдегидрогеназа ( декарбоксилирующая) |
Е1 |
Тиаминдифосфат (ТДФ) |
Декарбоксилирование ПВК |
|
Дигидролипоилтрансацетилаза (дигидролипоилацетилтрансфераза) |
Е2 |
Липоамид |
Окисление С2- фрагмента и перенос его наHS-KoA |
|
Дигидролипоилдегидрогеназа |
Е3 |
Флавинадениннуклеотид(ФАД) |
Регенерация окисленного липоамида |
Этот процесс практически необратим, так как он сопровождается выделением свободной энергии, равной 33,5 кДж. С каталитической целью используется несколько протеинов, работающих в определенной последовательности и объединенных в мультиферментный пируватдегидрогеназный комплекс. Он включает три энзима (табл. 7), каждый из которых является сложным белком.
Простетические группы представлены активными формами витаминов В1 (тиамина) в Е1, В2 (рибофлавина) в Е3 и витаминоподобным соединением (липоамидом) в Е2. В обеспечении нормального хода реакций участвуют и свободные коферменты: окисленный НАД+ и HS- KoA; с помощью первого передается на ЭТЦ восстановительный эквивалент, а второй транспортирует остаток уксусной кислоты в виде ацетил- КоА к системе энзимов цитратного цикла.
Строение пируватдегидрогеназного комплекса довольно сложно: включает до нескольких десятков субъединиц различных моноферментов. Данная система катализаторов характеризуется большим отрицательным редокс-потенциалом, который обеспечивает наряду с восстановлением кофермента (НАДН) образование макроэргической тиоэфирной связи в ацетил-КоА.
Процесс протекает в 4 стадии:
I. Взаимодействие ПВК с ТДФ-Е1: при этом происходит перенос гидроксиэтильной группы на тиазольное кольцо связанного с ферментом тиаминдифосфата. Движущей силой реакции является сродство электроноизбыточного α-положения тиазольного кольца молекулы активированного витамина В1 к элек-
трофильному центру пирувата.
Как видно из схемы, α-углеродный атом вследствие соседства гетероатомов проявляет СН-кислотность; в присутствии пирувата от него отщепляется протон, что превращает его в карбанион, который легко взаимодействует с α-кетокислотой. В образовавшемся промежуточном S-Е1-комплексе происходит смещение π-электронов в сопряженной системе к N+, что облегчает разрыв связи С-С и отщепление СО2:

II. Ионизированная гидроксиэтильная группа получившейся формы ТДФ, взаимодействуя с окисленным липоамидом, преобразуется в ацетиллипоамид–Е2. При этом ТДФ регенерирует, в качестве окислителя выступает -S-S-группа второго фермента:

Амид липоевой кислоты – (витаминоподобное соединение) с помощью амидной связи с аминогруппой лизина включена в состав дигидролипоилтрансацетилазы (Е2). Интересно, что простетическая группа фермента локализуется на конце гибкой цепи (поворотного кронштейна), что позволяет ей легко поворачиваться и взаимодействовать поочередно с Е1 и Е3.
I

IV. Завершается процесс окислением липоамида в реакции с флавопротеином – дигидролипоилдегидрогеназой (Е3). Восстановленный кофермент окисляется НАД+, который в свою очередь передаёт восстановительные эквиваленты на ЭТЦ:

Как видно из схемы, в третьем ферменте роль коэнзима выполняет окисленный ФАД, что иногда заставляет эту стадию раскладывать на две:
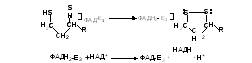
Так как в ЭТЦ передается восстановительный эквивалент НАДН+Н+, что позволяет энергии, выделившейся в цепи, трижды обеспечивать окислительное фосфорилирование, т.е. генерировать три молекулы АТФ.
