
- •Введение в обмен веществ
- •Основные особенности разных фаз метаболизма
- •Глава I. Энергетический обмен
- •1.1. Свободная энергия и законы термодинамики
- •1.1. Макроэргические соединения
- •Стандартная свободная энергия гидролиза органических фосфатов
- •1.1.2. Пути синтеза атф и его роль
- •1.1.3. Окислительно – восстановительное равновесие, окислительно –восстановительный потенциал
- •Стандартные потенциалы некоторых окислительно- восстановительных систем
- •1.2. Биологическое окисление
- •1.2.1. Характеристика биологического окисления
- •Строение комплексов полиферментного ансамбля дыхательной цепи митохондрий
- •1.2.2. Сопряжение биологического окисления и окислительного фосфорилирования
- •1.2.3. Регуляция скорости дыхания митохондрий
- •1.2.4. Разобщение дыхания и фосфорилирования
- •Краткая характеристика некоторых ионо(протоно)форов
- •1.2.5. Патология биоэнергетических процессов
- •II. Наследственные и приобретенные дефекты в работе промежуточных переносчиков этц:
- •III. Недостаток кислорода (гипоксия):
- •IV. Наличие разобщителей биологического окисления и фосфорилирования.
- •1.2.6. Механизмы защиты от токсического действия кислорода
- •А) Антиоксиданты ферментативной природы
- •Б) Антиоксиданты неферментативной природы
- •Роль катионов металлов с переменной валентностью в свободно-радикальных реакциях
- •В) Антиоксиданты внеклеточных жидкостей
- •1.3. Микросомальное окисление
- •Глава II
- •2.1.2. Регуляция процесса окисления пирувата
- •2.1.3. Патология декарбоксилирования пирувата
- •2.2. Цикл трикарбоновых кислот
- •2.2.1. Последовательность реакций цтк
- •2.2.2. Энергетическая ценность процесса
- •Образование макроэргических соединений в цтк
- •2.2.3. Участие витаминов в цтк
- •2.2.4. Биологические функции цикла Кребса
- •2.2.5. Регуляция превращений цитрата
Роль катионов металлов с переменной валентностью в свободно-радикальных реакциях
Исходное вещество
Катионы металла
Образующийся продукт
Н2О2
Fe/Cu
ֹ
НO•
Пероксиды липидов
Fe/Cu
Перокси- и алкоксирадикалы,
цитотоксические
альдегиды
Tиолы(R-SH) Fe/Cu
O•-
, H2O2,
RS•,
НO•
Аскорбиновая кислота
Fe
и Сu
НO•,
семидегидроаскорбат
ность резко снижена, что служит важным механизмом антиоксидантной защиты. В плазме крови транспорт ионов металлов с переменной валентностью осуществляют специальные белки-переносчики (см. ниже). В цитозоле многих клеток эукариот (особенно в печени, почках и кишечнике) присутствуют металлотионеины. Эти низкомолекулярные, богатые цистеином протеины способны связывать Сu2+, Cd2+, Hg2+и др., что также обеспечивает антиоксидантный эффект.
В) Антиоксиданты внеклеточных жидкостей
Внеклеточные жидкости человека (плазма крови, лимфа, ликвор, синовиальная, межклеточная жидкость) содержат очень мало (или не содержит вовсе) ферментов, разрушающих активные формы кислорода. Считается, что их основная стратегия антиоксидантной защиты заключается в связывании катионов металлов с переменной валентностью в формы, неспособные к стимуляции свободнорадикальных реакций.
Подобным образом действует плазменный белок трансферрин, насыщенный железом, что сводит к нулю уровень ионизированной формы металла в плазме. Аналогичным эффектом обладает лактоферрин, секретируемый фагоцитами. Синтезируемый печенью гаптоглобин, связываясь с гемоглобином, снижает способность свободных катионов железа стимулировать реакции перекисного окисления липидов.
Медь-содержащий белок плазмы крови церулоплазмин (ЦП) также участвует в метаболизме этого металла. Он обладает ферроксидазной активностью, переводя двухвалентное железо в трехвалентное, что подавляет способность последнего генерировать радикалы и стимулировать перекисное окисление липидов.
1.3. Микросомальное окисление
В отличие от митохондрий, где окисление осуществляется с помощью отщепления ē и Н+, в эндоплазматическом ретикулуме в основе подобной реакции лежит включение кислорода в молекулу субстрата без высвобождения энергии. Он называется свободным окислением и обеспечивается работой двух групп энзимов: монооксигеназ (гидроксилаз) и диоксигеназ.
Энзимы первого вида называются оксигеназами смешанного типа, т.к. катализируют реакции гидроксилирования ароматических соединений, сопровождающиеся с образованием воды. Они активируют молекулярный кислород, один атом которого внедряется в молекулу субстрата, а другой окисляет восстановленные коферменты НАДН или НАДФН:
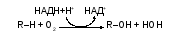
Примером подобных реакций является гидроксилирование триптофана, фенилаланина. Биологическое значение каждого процесса определяется его продуктом. Триптофан превращается в серотонин (5-гидрокситриптофан) – нейромедиатор, регулирующий многие формы поведения, сон, температуру. Продуктом поэтапного гидроксилирования фенилаланина и тирозина является дигидроксифенилаланин (ДОФА) – предшественник дофамина и норадреналина. Оба соединения выполняют разнообразные регуляторные функции в центральной нервной системе. Дофамин часто называют «гормоном удовольствия», норадреналин служит нейромедиатором в постганглионарных симпатических нервных окончаниях, а в хромаффинных клетках – является предшественником гормона адреналина.
Нарушение синтеза катехоламинов приводит к многочисленным нейропсихическим заболеваниям. При дефиците дофамина развивается болезнь Паркинсона (см. выше). Если отсутствует фенилаланингидроксилаза, то происходит накопление фенилаланина в мозге, при этом он превращается в фенилпируват (фенилпировиноградную кислоту), который токсично действует на нейроны новорожденных. Если не принять своевременные меры у младенцев может развиться фенилпировиноградная олигофрения. Вот почему у детей с наследственной недостаточностью этого фермента необходимо жестко контролировать прием аминокислоты с пищей.
Микросомальное окисление стероидов, жёлчных и жирных кислот, простагландинов, лейкотриенов, биогенных аминов и ксенобиотиков осуществляется с участием цитохром Р450, который также относится к монооксигеназам смешанного типа. Ксенобиотиками (от греч. xenos - чужой и bios - жизнь) называют чужеродные для организма вещества, к числу которых относятся лекарства, яды, продукты промышленного загрязнения, пестициды, гербициды и т.д.
Увеличение полярности молекулы RH за счет включения кислорода повышает его гидрофильность, но снижает способность преодолевать мембраны. Подобная биотрансформация используется печенью для обезвреживания различных токсичных соединений экзо- и эндогенного происхождения (продуктов гниения аминокислот в кишечнике, билирубина и т.д.).
Г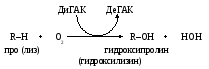 идроксилирование
остатков пролина и лизина в молекуле
проколлагена проводит пролил- и
лизилоксигеназы (гидроксилазы).
идроксилирование
остатков пролина и лизина в молекуле
проколлагена проводит пролил- и
лизилоксигеназы (гидроксилазы).
Это способствует дальнейшему превращению проколлагена в его зрелые формы. Кофактором данных ферментов служит аскорбиновая кислота (ДиГАК – дигидроаскорбат, восстановленная и ДеГАК – дегидроаскорбат, окисленная форма аскорбата). При недостатке её в пищевом рационе у человека развивается цинга, характерными признаками которой являются кровоточивость десен, расшатывание и выпадение зубов, появление подкожных точечных кровоизлияний, во многом обусловленных угнетением созревания коллагена.
Вторая группа ферментов, участвующих в реакциях свободного окисления органических соединений, – диоксигеназы. Они катализируют включение двух атомов кислорода в молекулу субстрата, чаще всего за счет разрыва двойной связи в ароматическом кольце, хотя описаны и другие варианты подобной реакции. Они катализируют включение двух атомов кислорода в молекулу субстрата, чаще всего за счет разрыва двойной связи в ароматическом кольце. С помощью триптофандиоксигеназы обеспечивается начальная стадия катаболизма триптофана - разрыв индольного кольца с образованием формил-L-кинуренина.

Контрольные тесты к главе I
I. Убихинон обеспечивает передачу электронов между комплексами:
1. I и II
2. III и IV, I и III
3. II и III, I и III
4. I и III
II. Цитохром c обеспечивает передачу электронов между комплексами:
1. I и II
2. III и IV
3. I и IV
4. I и III
III. Белок-протонофор бурой жировой ткани:
1. Грамицидин А
2. Транслоказа адениловых нуклеотидов
3. Термогенин
IV. Окислительное фосфорилирование- это
Электроно-транспортная цепь
Синтез АТФ из АДФ, неорганического фосфата с использованием энергии биологического окисления
Гидролиз АТФ
Синтез АТФ из двух молекул АДФ
V. Валиномицин - это:
1. Протонофор
2. Ингибитор дыхательной цепи
3. Ингибитор окислительного фосфорилирования
4. Активатор дыхательной цепи
5. Ионофор
VI. Общий продукт микросомального и митохондриального окисления:
1.НАДН
2.НАДФН
3. Эндогенная вода
4. Гидроксилированный продукт
5.АТФ
VII. Монооксигеназная система детоксикации ксенобиотиков локализована в клетках:
1. Почек
2. Коры надпочечников
3. Печени
4. Скелетной мышцы
5. Лейкоцитах
VIII. Кислота-антиоксидант:
1. Лимонная
2. Мочевая
3. Молочная
4. Яблочная
5. Янтарная
IX. Активные формы кислорода
О2-.
H2O2
3. НО–
4. НО˙
5. Н2О
X. Ферменты антиоксидантной защиты:
1. Глутатионпероксидаза
2. Супероксиддисмутаза
3. Каталаза
4. Монооксигеназа
5. Диоксигеназа
