
- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
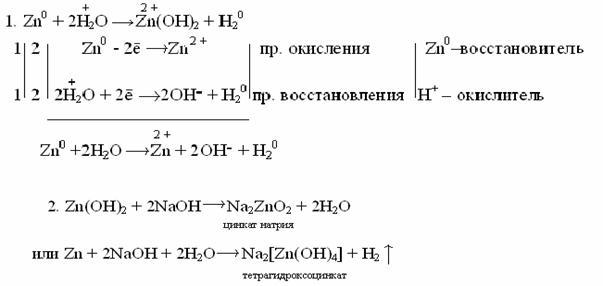
Действие щелочей на металлы
Щелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи.
Таким образом, реакция идет в две стадии:
в начало
Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Характерным химическим свойством металлов является их восстановительная способность. Они вступают в реакцию как с простыми веществами – неметаллами, так и со сложными веществами – водой, кислотой, щелочами и другими веществами.
Взаимодействие металлов с кислотами
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ АЗОТНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
Металл взаимодействует с хлороводородной кислотой, если энергия его ионизации меньше энергии ионизации водорода, а таковыми являются активные металлы, стоящие в ряду напряжений до водорода. При растворении в хлороводородной кислоте активных металлов образуется соль этого металла (хлорид) и выделяется водород. В этом случае в качестве окислителя выступает ион водорода (Н+) кислоты, который оттягивает электрон от атома восстановителя (металла).

Можно рассчитать ЭДС этой реакции.
ЭДС = Еокис-ля – Евос-ля = 0 – (-0,76) = 0,76 В.
Потенциалы находятся в ряду напряжений металлов.
![]()
![]()
в начало
Действие серной кислоты на металлы
Разбавленная серная кислота растворяет только активные металлы, т.е. реакции идут аналогично реакциям с хлороводородной кислотой. В результате реакции образуется соль металла (сульфат) и выделяется водород.
![]()
|
| |
|
|
|
![]()
![]()
![]() 1 2 Fe0 -
2ē → Fe+2 процесс
окисления Fe0 -
восстановитель
1 2 Fe0 -
2ē → Fe+2 процесс
окисления Fe0 -
восстановитель
1 2 2H+ + 2ē → H20 процесс восстановления Н+ - окислитель
![]()
Fe + 2H+ → Fe2+ + H2
![]()
ЭДС = 0 – (-0,44) = 0,44 В
Концентрированная серная кислота растворяет металлы, стоящие в ряду напряжений металлов до серебра (включительно). Не растворяется золото и платиновые элементы (Рt, Os, Ru, Ir, Rh, Pd).
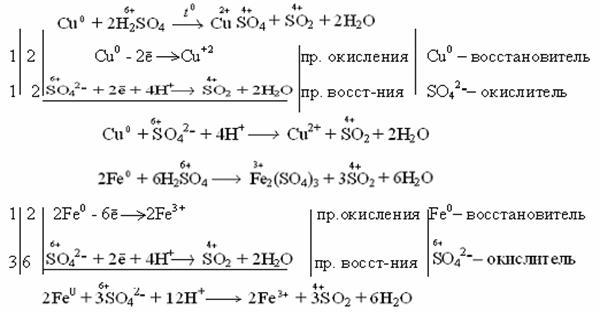
Окислителем
в этом случае является сера со степенью
окисления +6, которая в зависимости от
активности металла и от условий
(концентрация кислоты, температура)
может восстанавливаться до серы +4, +0,
-2. Таким образом, продуктами восстановления
серы серной кислоты могут быть ![]()
Например: неактивные и малоактивные металлы (Cu, Ag, Fe, Ni) восстанавливают серу +6 до серы +4 (SO2). Реакция идет при нагревании.
Как видно из реакций, разбавленная серная кислота окисляет железо до +2, а концентрированная до +3.
Более активные металлы восстанавливают серу +6 до свободной серы (S0) и сероводородной кислоты (H2S), где сера имеет степень окисления -2.
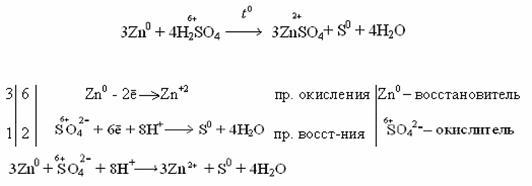
в начало
Действие азотной кислоты на металлы
Азотная кислота, являясь сильным окислителем, действует почти на все металлы (кроме Au, Pt, Ru, Rh, Ir, Os, Ta), превращая их в нитраты, а некоторые – в оксиды (пассивирование металлов).
Особенность действия азотной кислоты на металлы заключается в том, что она окисляет металлы без выделения водорода даже из разбавленного раствора кислоты, в отличие от серной. Глубина восстановления азота из азотной кислоты зависит от концентрации последней и от активности взаимодействующего с ней металла. Чем больше разбавлена кислота и чем активнее металл, тем глубже идет восстановление. Азот кислоты восстанавливается
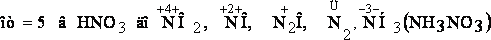
ÜРазберем некоторые примеры взаимодействия азотной кислоты с металлами.
При взаимодействии концентрированной азотной кислоты с неактивными металлами выделяется NO2:

Разбавленная азотная кислота с малоактивными и неактивными металлами (Pb, Cu, Ni, Ag, Fe) образует NO:
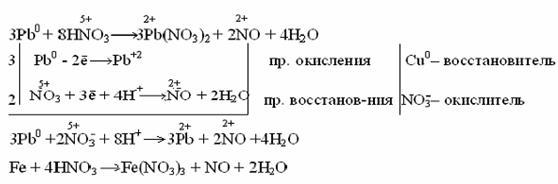
Очень разбавленная азотная кислота восстанавливается до аммиака (NH3) при взаимодействии с очень активным металлом, образующим в кислой среде ион аммония NH4+:
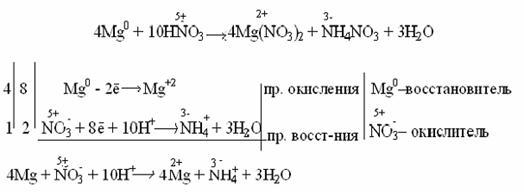
Концентрированная кислота пассивирует некоторые металлы (Al, Cr, Fe), что выражается в покрытии металлов тонкой оксидной пленкой:
![]()
Поэтому концентрированную азотную кислоту перевозят в алюминиевых цистернах, а разбавленную – в цистернах из кислотоупорной стали.
Металлы способны вытеснять друг друга из растворов солей. Возможность прохождения таких реакций определяется положением металлов в ряду напряжений: более активные металлы вытесняют из растворов их солей менее активные.
Например:
Zn + CuSO4 → ZnSO4 + Cu.
в начало
