
- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
Тема 9: основные закономерности протекания химических процессов
1. Закон сохранения массы вещества и энергии, как две составные части закона сохранения материи.
2. Внутренняя энергия системы. Энтальпия.
3. Термохимия, термохимические законы.
Закон сохранения массы вещества и энергии, как две составные части закона сохранения материи
В 1748 г. М.В. Ломоносов сформулировал закон сохранения массы веществ, а в 1756 г. экспериментально доказал этот закон. В настоящее время закон сохранения массы веществ формулируется так: «Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции».
![]() Zn +
1/2О2 ZnO
Zn +
1/2О2 ZnO
![]() 6.54
г + 1,60
г 8,14
г
6.54
г + 1,60
г 8,14
г
В 1843г. (почти 100 лет спустя) немецкий физик Мейер, англ. физик Джоуль и нем. физиолог Гельмгольц доказали экспериментально и сформулировали закон сохранения энергии: «Энергия не возникает из ничего и не исчезает бесследно, но отдельные ее виды могут переходить друг в друга по строго эквивалентным соотношениям».
Например: при зарядке аккумулятора электрическая энергия превращается в химическую, а при разрядке аккумулятора – наоборот, химическая – в электрическую.
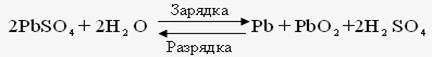
До начала ХХ века эти два закона (сохранения массы веществ и энергии) рассматривались отдельно друг от друга. Когда было доказано , что энергия обладает массой (Лебедев, 1900) эти два закона объединили в единый закон природы – закон сохранения материи: общее количество вещества (а вещество – это вид материи) до и после реакции остается неизменным , происходит лишь превращение одной формы материи в другую.
Раздел науки, изучающий переходы энергии из одной формы в другую, от системы к системе, а так же энергетические изменения при разных физических и химических процессах называется – термодинамикой.
Объектом изучения в термодинамике является – система. Системой называется совокупность веществ, находящихся во взаимодействии и обособленных от окружающей среды. Напр., это раствор в колбе, смесь газов в баллоне и др. В зависимости от характера взаимодействия системы с окружающей средой различают: открытые, закрытые и изолированные системы.
1. Открытая система – происходит обмен энергии и вещества с другими системами и окружающей средой.
2. Закрытая система – осуществляется обмен энергией, но не веществом.
3. Изолированная система – обмен энергией и веществом с внешней средой полностью исключён.
Состояние системы характеризуется термодинамическими параметрами T, V, P.
Если процессы происходят при const:
T-изотермический, V-изохорический, P-изобарический.
К важнейшим величинам, характеризующим химические системы, относятся: внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса(G).
Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
в начало
Внутренняя энергия системы. Энтальпия.
Внутренняя энергия системы – это полная энергия системы, складывающаяся из кинетической и потенциальной энергии частиц системы (это поступательные и вращательные движения молекул, колебательные движения атомов внутри молекул, движение электронов в атоме), кроме потенциальной и кинетической энергии системы в целом. Каждая система имеет внутреннюю энергию (U) , её измерить нельзя. Протекание химической реакции сопровождается изменением внутренней энергии, которая равна
U![]() -U
-U![]() =
=![]() U
U
где (1 – начальное состояние, 2 – конечное состояние).
Теплота, подведенная к системе, расходуется на увеличение внутренней энергии и на совершение работы системы против внешних сил.
Q=![]() U+A (I),
U+A (I),
где А- работа. A=p![]() V
.
V
.
![]() U=Q-A=Q-p
U=Q-A=Q-p![]() V (II).
V (II).
![]() V=V
V=V![]() -
V
-
V![]()
Уравнение (II) выражает первое начало термодинамики, согласно которому: изменение внутренней энергии равно теплоте, сообщенной зак-рытой системой извне, за вычётом работы, произведённой системой против внешних сил.
Первое начало термодинамики является формой выражения закона сохранения энергии.
Химические реакции могут протекать в условиях:
1. Т, V – const (изохорно-изотермический процесс).
![]() =0,
тогда А=0,
а
=0,
тогда А=0,
а![]()
То есть теплота, подведенная к системе идет на изменение внутренней энергии.
2. Т, P – const (изобарно-изотермический процесс).
Q![]() =
=![]() U+A=
U+A=![]() U+p
U+p![]() V= U
V= U![]() – U
– U![]() +p(V
+p(V![]() – V
– V![]() )= U
)= U![]() – U
– U![]() + pV
+ pV![]() – pV
– pV![]() =
(U
=
(U![]() +
+pV
+
+pV![]() )
– ( U
)
– ( U![]() + pV
+ pV![]() )
)
Сумму U+pV называют энтальпией системы и обозначают буквой H: H=U+pV.
Подставив
энтальпию в выражение ![]() ,
имеем
,
имеем ![]() ,
то есть теплота, подведенная
к системе при const давлении,
расходуется наизменение
энтальпии системы.
,
то есть теплота, подведенная
к системе при const давлении,
расходуется наизменение
энтальпии системы.
Энтальпию
измерить нельзя, как и внутреннюю
энергию, но можно найти изменение
энтальпии(![]() H)
при переходе системы из одного состояния
в другое.
H)
при переходе системы из одного состояния
в другое.
Измеряется ![]() H в
стандартных условиях и обозначается
H в
стандартных условиях и обозначается ![]()
![]() кДж/моль.
кДж/моль.
в начало
Термохимия, термохимические законы.
Раздел химии, посвященный количественному изучению тепловых эффектов реакций, называется термохимией.
Химические уравнения, в которых указаны тепловые эффекты, называются термохимическими.
Реакции, идущие с выделением тепла – экзотермические, а с поглощением тепла – эндотермические.
1. В
экзотермических реакциях H![]() > H
> H![]() ,
поэтому H
,
поэтому H![]() –H
–H![]() =
–
=
– ![]() H;
H;
A+B AB + Q (-![]() H).
H).
Например:
Zn(к)+H![]() SO
SO![]() Zn
SO
Zn
SO![]() (ж)
+ H
(ж)
+ H![]() (г)+143,0 кДж;
(г)+143,0 кДж;
![]()
![]() =-143,0 кДж
=-143,0 кДж
2. В
эндотермических реакциях H![]() < H
< H![]() ,
поэтому
,
поэтому
H![]() –H
–H![]() =+
=+![]() H; C+ДA-Q (+
H; C+ДA-Q (+![]() H).
H).
Например: N![]() (г)+О
(г)+О![]() (г) 2NO(г)-180,5
кДж;
(г) 2NO(г)-180,5
кДж;
![]()
![]() =180,5
кДж.
=180,5
кДж.
Особенности термохимических уравнений:
1. В уравнениях допускаются дробные коэффициенты, так как энтальпию относят к одному молю вещества.
2. В уравнениях указываются агрегатные состояния веществ, так как от агрегатного состояния зависит энтальпия реакции.
Например:
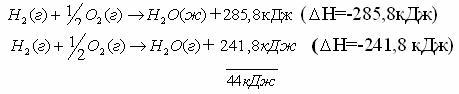
Разница в 44 кДж – это энтальпия перехода из одного агрегатного состояния в другое.
Изменение энтальпии химической реакции обратно по знаку тепловому эффекту реакции (P –const).
Найдены энтальпии различных процессов: нейтрализации, испарения, образования, сгорания и др.
Тепловой
эффект реакции образования одного моля
вещества из простых веществ в стандартных
условиях называют теплотой
образования илиэнтальпией
образования (![]()
![]() ).
).
Например:
![]()
![]()
![]() =
=![]() .
.
Энтальпию
образования простых веществ, устойчивых
в стандартных условиях, принимают равной нулю ![]()
В основу всех термохимических расчетов положены законы: Лавуазье – Лапласа (1780-1784) и Г.И. Гесса (1840).
Закон Лавуазье – Лапласа гласит: теплота разложения сложного вещества на простые равна теплоте его образования из тех же веществ, взятой с обратным законом.
AB A+B + Q![]() ;
;
A+B AB - Q![]() Q
Q![]() = Q
= Q![]() ; CaO(т)Ca
; CaO(т)Ca![]() (т)+1/2O
(т)+1/2O![]() (г)-635.5
кДж/моль;
(г)-635.5
кДж/моль;
Ca(т)+
1/2O![]() (г)CaО
(т)+635.5 кДж/моль.
(г)CaО
(т)+635.5 кДж/моль.
Закон Гесса является частым случаем закона сохранения энергии: тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий реакции.

Образование В![]() и
В
и
В![]() возможно:
возможно:
1.
Непосредственно из А![]() и
А
и
А![]() (тепловой
эффект ∆Н
(тепловой
эффект ∆Н![]() ).
).
2. Через промежуточные стадии, тепловые эффекты которых ∆Н1, ∆Н2, ∆Н3.
3. Через промежуточные стадии, тепловые эффекты которых ∆Н4, ∆Н5, ∆Н6.
Согласно
закону: ∆Н![]()
![]() =∆Н1+
∆Н2+∆Н3=∆Н4+∆Н5+∆Н6
=∆Н1+
∆Н2+∆Н3=∆Н4+∆Н5+∆Н6
Например.
Реакцию нейтрализации H![]() SO
SO![]() раствором NaOH можно
проводить:
раствором NaOH можно
проводить:
1. В одну стадию:
![]()
![]() .
.
2. Через промежуточные стадии:
а) ![]()
![]() ;
;
б) ![]()
![]()
![]()
Суммарный тепловой эффект в обоих случаях одинаковый.
В термохимических расчетах большое значение имеют следствия из закона Гесса.
Первое следствие из закона Гесса:
Тепловой эффект химических реакций равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ.
Вычисления проводятся с учетом стехиометрических коэффициентов перед веществами в уравнении реакции:
Например.
Вычислить энтальпию данной реакции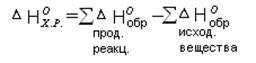
![]()
и решить вопрос эндо- или экзотермической является реакция.
Из таблицы берем энтальпии веществ:
![]()
![]()
![]() ;
;
![]()
![]() ;
;
![]() ;
;
![]() .
.
Реакция экзотермическая, т.к. ∆Н = -802,2 кДж.
Второе следствие из закона Гесса: тепловой эффект химической реакции равен сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Вычисления проводятся с учетом стехиометрических коэффициентов перед веществами в уравнении реакции:
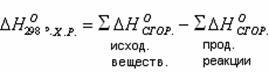
Энтальпия сгорания – тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов.
Третье следствие из закона Гесса: тепловой эффект перехода вещества из одного агрегатного состояния в другое равен разности между энтальпиями в одном и другом агрегатных состояниях. Например:
![]() +
+![]() ;
;
![]() +
+![]()
Разница в 44 КДж/моль – теплота перехода жидкой воды в пар и наоборот.
в начало
