
- •Общее знакомство с аптечным учреждением
- •Практика на рабочем месте провизора аналитика Знакомство с работой провизора – аналитика
- •Требования к провизору, занятому контролем качества лекарственных средств изготовленных в аптеке.
- •Обязанности провизора-аналитика.
- •Приказы и нд, используемые провизором- аналитиком.
- •Результаты анализов лекарственных форм
- •Фармакопейная статья
- •4.Никотиновая кислота:
4.Никотиновая кислота:
![]()
Абс.ошибка:
0,022 – 0,02= 0,002; Отн.ошибка:
![]() (по
П №305 допустимо 15%).
(по
П №305 допустимо 15%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp.: Solutionis Furacilini 0,02% - 100ml
D. S. Глазная примочка.
Состав:
Фурацилина 0,02
Натрия хлорида 0,9
Воды очищенной 100 мл.
Описание:на анализ поступила прозрачная жидкость без запаха лимонно-желтого цвета, сладковатого вкуса без механических включений в прозрачном бесцветном флаконе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Для подтверждения наличия фурацилинав растворе используется реакция расщепления фуранового цикла под действием щелочи. Для этого к 1-2 мл ЛФ прибавляют 2 мл раствора натрия гидроксида. Появляется оранжево-красное окрашивание.
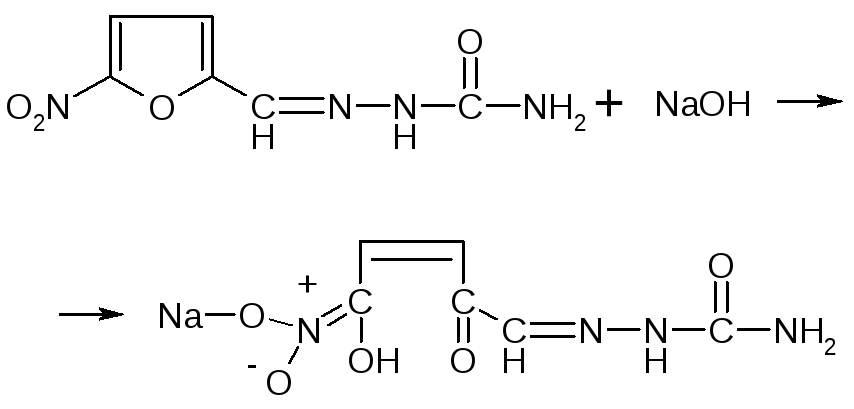
На Na+:реакция с цинк-уранил ацетатом (см. пропись № 2 за 18.04.08г).
На Cl-:реакция с серебра нитратом (см. пропись № 1 за 16.04.08г).
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Количественное содержание фурацилинав исследуемом растворе определяется методом фотоэлектроколориметрии, основанном на измерении оптической плотности окрашенного раствора.
Для увеличения интенсивности окраски сначала необходимо провести реакцию с раствором натрия гидроксида (реакцию см. выше).
Для этого к 0,5 мл раствора прибавляют точно 7,5 мл воды, 2 мл 0,1М раствора натрия гидроксида и перемешивают. Через 20 мин измеряют оптическую плотность (Dx) окрашенного раствора при длине волны 450 нм с толщиной слоя 3 мм. В качестве контрольного раствора используют воду очищенную.
Параллельно проводят реакцию с 0,5 мл 0,02% раствором фурацилина (стандартный раствор) аналогичным образом и измеряют оптическую плотность (Dst) при тех же условиях, что и исследуемый раствор.
Содержание фурацилина в граммах:
![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы до 0,02 (20%).
Определение натрия хлоридапроизводится методом аргентометрии (метод Мора). К 0,5 мл исследуемого раствора прибавляют 1 каплю калия хромата и титруют 0,1М раствором серебра нитрата до образования оранжево-коричневого окрашивания.
N![]()
![]() aCl
+ AgNO3
AgCl + NaNO3
aCl
+ AgNO3
AgCl + NaNO3
2![]() АgNO3+K2CrO4
2KNO3+
Ag2CrO4
АgNO3+K2CrO4
2KNO3+
Ag2CrO4
Fэкв=1
М![]() .м.
экв.NaCl = М.м.
NaCl . Fэкв.=
1. 58,44=58,44 г/моль
.м.
экв.NaCl = М.м.
NaCl . Fэкв.=
1. 58,44=58,44 г/моль
Расчет теоретического объема титранта:
Т.к. 0,9 грамма натрия хлорида содержится в 100 мл раствора, то в 0,5 мл содержится 0,0045 грамма.
![]()
На титрование ушло 0,78 мл 0,1М раствора серебра нитрата, соответственно содержание натрия хлорида в граммах:
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 5,0 (3%).
Вывод: ЛФ приготовлена удовлетворительно.
Дата: 19.04.13
Пропись № 1 Rp: Sol. Ac.nicotinici 1%-100ml
D.S. внутрь (после еды).
Кислоты никотиновой 1,0г
Воды очищенной 100 мл
Описание: Бесцветная, прозрачная жидкость со специфическим запахом. Объем 100мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
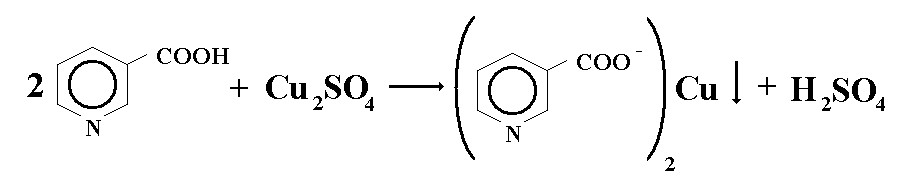
Кислота никотиновая: Реакция комплексообразования с сульфатом меди.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Никотиновую кислоту определяют алкалиметрически.
Берем навеску мл, добавляем 1-2 капли нейтрального-красного и титруют 0,1 н раствором натрия гидроксида до желтого окрашивания.
![]()
![]()
Т.к. в 100 мл ЛФ содержится 1г никотин.к-ты, то
1 мл - 0,01г
На титрование ушло 0,81 мл 0,1М раствора йода, соответственно содержание исследуемого вещества в граммах равно:
![]()
Расчет отклонения:
Абс.ошибка:1,0– 0,997= 0,003;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 (6%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Ribofavini 0,002 Рибофлавин 0,002
Kalii Iodidi 0,2 Калия йодид 0,2
Aquae purificatae 10 ml Вода очищенная 10мл
M.D.t.d. N 10
S. Глазные капли (ВАЗ).
Описание: представляет собой прозрачную жидкость зеленовато-желтого цвета, без запаха, соленого вкуса, без механических примесей. Общий объем – 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Рибофлавин. Раствор имеет яркую зеленовато-желтую окраску при дневном свете и зеленую флуоресценцию при облучении ультрафиолетовым светом. Флуоресценция исчезает при добавлении растворов кислот или щелочей, а под действием натрия гидросульфита исчезает и флуоресценция, и зеленая окраска раствора.
На К+: реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата, образуется желтый кристаллический осадок.
N![]() a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
На I-: Используется реакция с раствором свинца ацетата.
К 0,5 мл раствора прибавляют 2-3 капли раствора свинца ацетата. Образуется осадок желтого цвета.
KI + Pb(CH3COO)2 = PbI2 + CH3COOK
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Рибофлавин (фотоэлектроколориметрическим методом). Метод основан на способности раствора вещества поглощать немонохроматическое излучение света в видимой области спектра.
К 0,5 мл ЛФ прибавляют 9,5 мл воды очищенной и измеряют оптическую плотность раствора на фотоэлектроколриметре при длине волны 445 нм (синий светофильтр) в кювете с толщиной поглощающего слоя 10 мм.
Параллельно измеряют оптическую плотность эталонного раствора содержащего 2,5 мл 0,0004% стандартного раствора рибофлавина (0,0001) и 7,5 мл воды.
В качестве раствора сравнения используют воду.
Содержание рибофлавина в граммах (Х) определяют по формуле:
![]() ,
,
Расчет отклонения:
Абс.ошибка: 0,002 – 0,0019 = 0,0001;
Относит.ошибка:
![]() (по П №305 допустимо 20%)
(по П №305 допустимо 20%)
Калия йодид: для определения количественного содержания используется рефрактометрия, метод основанный на измерении показателя преломления света (n) исследуемого вещества.
n= 1,3356
F= 0,0013
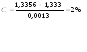
Ошибка не превышает допустимое приказом № 305 (10%)
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Дата: 22.04.13
Пропись № 1Rp.:Sol.Novocaini2% - 50,0
D.S.: для электрофореза Р-р Новокаина 2%-50 мл
Описание:бесцветная, прозрачная жидкость без запаха, без механических примесей. Общий объем – 50 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На новокаин: реакция азосочитания. К 1 мл раствора прибавляют 5 – 6 капель разведенной кислоты хлористоводородной, 2 – 3 капли 0,1М раствора натрия нитрита, а затем 10 капель натрия гидроксида. Появляется вишнево-красное окрашивание.

КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: аргентометрически методом Фаянса. Метод основан на способности соляной кислоты (новокаина гидрохлорид) реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл препарата прибавляют 1 каплю бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.
HCl + AgNO3 → AgCl↓ + HNO3
f![]() = 1
= 1
T= 0,1*272,8/1000 = 0,02728 г/мл
Vтеор. = 0,01/0,02728 = 0,37
Расчет отклонения:
Абс.ошибка:1,0 – 0,982 = 0,018;
Относит.ошибка:![]() (по
П №305 допустимо 6%).
(по
П №305 допустимо 6%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Rp:Sol.Ac.hydrochlorici10%-200mlР-р кислоты хлороводородной 10%-200мл
D.S. внутрь.
Описание:на анализ поступила бесцветная прозрачная жидкость без запаха и механических включений в прозрачном бесцветном флаконе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Хлороводородная кислота: К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
N![]() aCl
+AgNO3AgCl+NaNO3
aCl
+AgNO3AgCl+NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота хлористоводородная, анализ производится методом нейтрализации (алкалиметрия). Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл исследуемого раствора прибавляют 1 каплю метилового оранжевого и титруют 0,1 М раствором натрия гидроксида до желтой окраски.
H![]()
![]() Cl
+ NaOH NaCl + H2O,
Fэкв=1
Cl
+ NaOH NaCl + H2O,
Fэкв=1
Расчет теоретического объема титранта на 1 мл аликвоты раствора:
В 200 мл раствора - 20 мл кислоты хлороводородной
![]() 1 мл - 0,1 мл
1 мл - 0,1 мл
На титрование ушел 2,27мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:

Расчет отклонения:
Абс.ошибка:20,0 – 19,94 = 0,06;
Относит.ошибка:![]() (по
П №305 допустимо 8%).
(по
П №305 допустимо 8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Дата: 23.04.13
Пропись № 1Rp:Dimedroli0,12 Димедрол 0,12
Zincisulfatis0,15 Цинка сульфат 0,15
Sol.Ac.borici2%ad60mlР-р кислоты борной 2%-60мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 60 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Кислота борная. Выпаривают 5 капель раствора на водяной бане. К сухому остатку прибавляют 2 мл 96% этанола и поджигают. Наблюдают пламя с зеленой каймой.

Цинка сульфат. К 0,5 мл раствора прибавляют 2 капли раствора калия ферроцианида. Образуется белый студенистый осадок, нерастворимый в разведенной соляной кислоте.
![]()
Димедрол. К 0,5 мл препарата прибавляют по стенке концентрированную серную кислоту. Появляется желтое окрашивание, исчезающее при взбалтывании.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота борная (методом нейтрализации). Метод основан на реакции нейтрализации борной кислоты раствором натрия гидроксида.
К 0,5 мл раствора прибавляют 1 каплю фенолфталеина, 1 мл глицерина, титруют 0,1 моль/л раствором натрия гидроксида.
F![]() =1
=1
ТК.борной/NaOH=0,1*61,84/1000=0,006184г/мл
Vтеор. = 0,01/0,006184 = 1,62 мл
Абс.ошибка:
1,202 – 1,2= 0,002; Отн.ошибка:
![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Димедрол (аргентометрически методом Фаянса). Метод основан на способности соляной кислоты (димедрола гидрохлорид) реагировать с серебра нитратом с образованием серебра хлорида.
К 5 мл препарата прибавляют 1 каплю бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.
* HCl + AgNO3 → AgCl↓ + HNO3
f![]() = 1
= 1
T= 0,1*291,8/1000 = 0,02918 г/мл
Vтеор. = 0,01/0,02918 = 0,34
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 10%).
Цинка сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионамиZn2+.
К 5 мл ЛФ прибавляют гексаметилентетрамина до рН 5-6; 1-2 капли ксиленового-оранжевого и титруют 0,05 моль/л раствором Трилона Б.
Химизм смотри в прописи №1 за 16.04.08г
f![]() =1
=1
T= 0,05*287,4/1000 = 0,01437 г/мл
Vтеор. = 0,0125/0,01437 = 0,87 мл
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 10%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp:Iodidi1,0
Kaliiiodidi2,0
Aq.purificataead100ml
Описание: Серовато-черная жидкость, с характерным запахом. Объем ЛФ 100мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На К+: реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата, образуется желтый кристаллический осадок.
N![]() a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
На I-: Используется реакция с раствором свинца ацетата.
К 0,5 мл раствора прибавляют 2-3 капли раствора свинца ацетата. Образуется осадок желтого цвета.
KI + Pb(CH3COO)2 = PbI2 + CH3COOK
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Йод: 1мл ЛФ титруют 0,1н раствором натрия тиосульфата. В качестве индикатора используют крахмал, титрование ведут до обесцвечивания раствора.
Y2+2Na2S2O3→2NaY+ Na2S4O6
f=1
T= 0,1*253,8/1000 = 0,02538 г/мл
V![]() теор.
= 0,01/0,02538 = 0,39 мл
теор.
= 0,01/0,02538 = 0,39 мл
Расчет отклонения:
Отн.ошибка: 0% (по П №305 допустимо 6%).
Калия йодид и йод: сумму йодидов оттитровывают 0,1н раствором серебра. Берут 1 мл ЛФ добавляют несколько капель эозината натрия.
NaY+AgNO3→AgY↓ +NaNO3
KY + AgNO3→ AgY↓ + KNO3 F=1
T AgNO3/KY= 0,1*165,99/1000 = 0,016599 г/мл
T AgNO3/Y2= 0,1*253,8/1000 = 0,02538 г/мл
Расчет фактических навесок:
KY:Y2:
В 100 мл ЛФ – 2,0г калия йодида В 100 мл ЛФ – 1,0г йода
В 1 мл (навеска) – х г В 1 мл (навеска) – х г
х= 0,02 г х= 0,01г
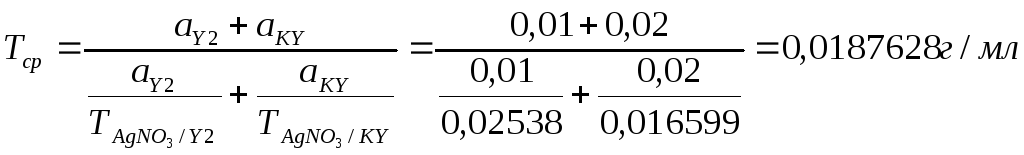
Vтеор. = 0,03/0,0187628= 1,59 мл
![]()
Отн.ошибка:0% (по П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 24.04.13
Пропись № 1Rp:Natriichloridi0,2
Natrii hydrocarbonatis
Natrii tetrabotatis aa 0,4
Aq.purificataead40,0ml
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 10 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия хлорид: см пропись №1 за 16.04.13г.
Натрия гидрокарбонат:
К 1мл ЛФ добавляем 2-3мл хлороводородной кислоты, выделяется углекислый газ. Затем добавлют гидроксид кальция по каплям, образуется белый осадок.
NaHCO3+HCl→ NaCl+CO2+H2O
С ф/ф дает слабо щелочную реакцию среды.
С сульфатом меди при нагревании.
2NaHCO3→ Na2CO3 +CO2+H2O
Na2CO3+MgSO4→MgCO3+Na2SO4 (при нагревании).
Натрия тетраборат: К 2-3 мл ЛФ добавляют 2 мл разб.серной кислоты, образуется борная кислота. Проводят реакции на борную кислоту
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Смесь титруют стандартным раствором кислоты хлороводородной, объем которой соответствует сумме натрия гидрокарбоната и натрия тетрабората.
NaHCO3+HCl→NaCl+CO2+H2O
Na2B4O7+2HCl+5H2O→ 4H3BO3+2NaCl
В ыделившуюся
борную кислоту в присутствии глицерина
титруют стандартным раствором натрия
гидроксида.
ыделившуюся
борную кислоту в присутствии глицерина
титруют стандартным раствором натрия
гидроксида.
Натрия хлорид: аргентометрия. К 1 мл раствора прибавляют 3-4 капли раствора бромфенолового синего и по каплям кислоту уксусную разведенную – до прекращения выделения пузырьков газа и появления зеленовато-желтого окрашивания и титруют 0,1 н раствором серебра нитрата до окрашивания осадка в фиолетовый цвет.
F![]() =1
=1
Т=0,1*58,44/1000=0,005844г/мл
Vтеор. = 0,005/0,005844 = 0,86 мл
Отн.ошибка: 0% (по П №305 допустимо 10%).
Натрия тетраборат и натрия гидрокарбонат: К 1мл раствора прибавляют 3 мл воды, 2-3 капли м/о и титруют 0,1 н раствором кислоты хлороводородной до появления розового окрашивания.
Оттитрованный раствор нагревают до кипения (для удаления углекислоты), охлаждают, прибавляют 2 мл нейтрализованного по ф/ф глицерина и титрубт 0,1 н растворо натрия гидроксида.
F![]() =1
=1
Т=0,1*381,36/1000*4=0,009534г/мл
Vтеор. = 0,01/0,009534= 1,05 мл
Отн.ошибка: 0% (по П №305 допустимо 8%).
![]()
Отн.ошибка: 0% (по П №305 допустимо 8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Zinci sulfatis 0,25% - 10 ml
Ac.borici0,2
Раствор цинка сульфата 0,25%-10 мл
Кислота борная 0,2
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 10 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Цинка сульфат: см пропись №1 за 23.04.13г.
Кислота борная: см пропись №1 за 23.04.13г.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота борная (методом нейтрализации). См.методику и химизм в прописи №1 за 23.04.13г.
F![]() =1
=1
ТК.борной/NaOH=0,1*61,84/1000=0,006184г/мл
Vтеор. = 0,01/0,006184 = 1,62 мл
Отн.ошибка: 0% (по П №305 допустимо 5%).
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Цинка сульфат (трилонометрически). К 1мл раствора прибавляют 5 мл раствора аммиачного буфера, 0,02 индикаторной смеси кислотного хром-черного специального и титруют 0,05М раствором ТрБ до синего окрашивания.
f=1
T![]() = 0,05*287,4/1000 = 0,01437 г/мл
= 0,05*287,4/1000 = 0,01437 г/мл
Vтеор. = 0,0125/0,01437 = 0,87 мл
Относит.ошибка: 0% (по П №305 допустимо 15%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 25.05.13
Пропись № 1Rp:Coffeini-natriibenzoatis1,0
Natrii bromidi 0,5
Aq. purificatae ad 100 ml
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия бромид.
К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr+AgNO3→AgBr↓светло-желт.+NaNO3
Кофеин-бензоат натрия:
Кофеин: в пробирку вносят 1-2 мл смеси, прибавляют 3-4 капли натрия гидроксида, 1 мл хлороформа.

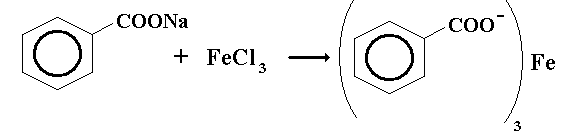
Бензойная кислота: с хлоридом железа.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия бромид. Определяются аргентометрическим методом.
К 1 мл исследуемого раствора прибавляют 5-7 капель раствора калия хромата и титруют 0,1н раствором нитрата серебра до оранжево-желтого окрашивания.
NaBr+AgNO3→AgBr↓светло-желт.+ NaNO3
T AgNO3/NaBr = 0,1*102,88/1000 = 0,010288 г/мл
Расчет фактических навесок:
NaBr:
![]() В
100 мл ЛФ – 0,5 г натрия бромида
В
100 мл ЛФ – 0,5 г натрия бромида
В 1 мл (навеска) – х г х= 0,005 г
Vтеор. = 0,005/0,010288 = 0,49мл
Отн.ошибка: 0% (по П №305 допустимо 8%).
Кофеин-бензоат натрия: прямая ацидиметрия.
Расчет теоретического объема титранта на 1 мл аликвоты раствора:
В 100 мл раствора - 1,0 г КБНатрия
![]() 1 мл - 0,01 г
1 мл - 0,01 г
Н а
титрование ушел 0,42 мл 0,1М раствора натрия
гидроксида, соответственно содержание
исследуемого вещества в граммах равно:
а
титрование ушел 0,42 мл 0,1М раствора натрия
гидроксида, соответственно содержание
исследуемого вещества в граммах равно:
![]()
Отн.ошибка: 0% (по П №305 допустимо 6%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Rp:Natriibromidi16,0
Natriithiosulfati20,0
Aq.purificataead100ml
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия бромид: см.предыдущую пропись.
Натрия тиосульфат.
К 1 мл раствора прибавляют по каплям 0,1 моль/л раствора йода. Раствор йода обесцвечивается.
2Na2S2O3+I2→Na2S4O6+ 2NaI
К 3 каплям раствора прибавляют по 1 мл воды и раствора серебра нитрата. Образуется белый осадок, быстро переходящий в желтый, бурый и черный.
Na2S2O3 + 2 AgNO3 → Ag2S2O3↓ + 2NaNO3
Ag2S2O3 → Ag2SO3 + S↓
Ag2SO3+S+H2O→Ag2S+H2SO4
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия бромид (аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида.
NaBr+AgNO3→AgBr↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f![]() = 1
= 1
Т = 0,1*102,9/1000 = 0,01029
Vтеор. = 0,08/0,01029 = 7,8
Расчет отклонения:
Абс.ошибка: 16,0 – 15,99 = 0,01;
Отн.ошибка:
![]() (по
П №305 допустимо 8%)
(по
П №305 допустимо 8%)
Натрия тиосульфат (рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Натрия тиосульфат n=1,3755
Вода очищенная n0=1,3330
![]()
Расчет отклонения:
Абс.ошибка: 20 – 19,96 = 0,04;
Отн.ошибка:
![]() (по
П №305 допустимо 8%)
(по
П №305 допустимо 8%)
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 26.04.13
Пропись № 1Rp.:Acidiglutaminici0,3 Кислота глутаминовая 0,3
Ac.Ascorbinici0,1 Кислота аскорбиновая 0,1
M.D.t.d№ 10
S.по 1 порошку утром.
Описание:на анализ поступил мелкокристаллический порошок белого цвета без запаха, завернутый в капсулу.
Т.к. согласно приказу № 214 физический контроль проводится с каждой серией фасовки в количестве не менее 3 упаковок. Для этого взвешивают 3 порошка, и определяют отклонение каждого от прописанной массы одного порошка.
M1=0,400
M2=0,400
M3=0,4100
Mср=(0,41+0,4+0,4):3=0,403 Отклонение.ср= (0,203-0,200):0,200. 100%=1,67%
Отклонение не превышает допустимое приказом № 305 отклонение для массы отдельных доз порошков от 0,1 до 0,3 (10%).
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Глутаминовая кислота:Берем навеску 0,1г, добавляем 2-3 мл воды и нагревают, образуется пирролидонкарбоновая кислота. Добавляем несколько кристаллов резорцина, образуется красно-фиолетовое окрашивание с зеленой флюоресценцией.
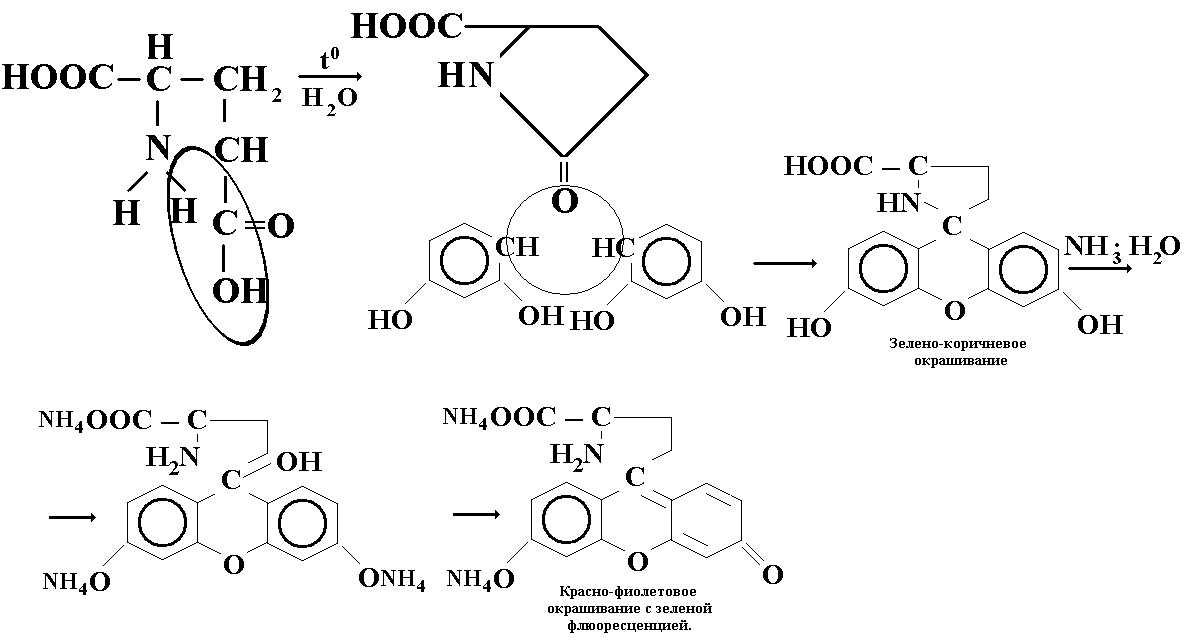
Кислота аскорбиновая:К 3мл исследуемого раствора прибавляют 0,5мл аммиачного раствора серебра, выпадает темный осадок.

КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Суммарное титрование: кислота глутаминовая и кислота аскорбиновая (алкалиметрия). К 0,1г ЛФ добавляют 5 мл воды и 2 капли нейтрального красного и титруют 0,1 н раствором гидроксида натрия до желтого окрашивания.
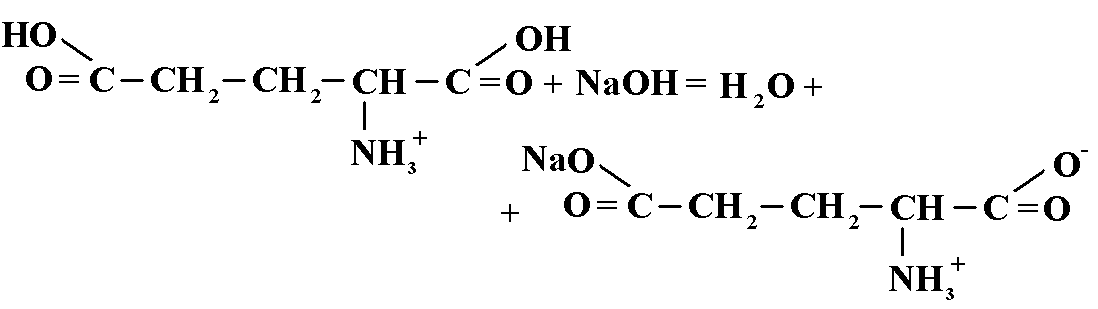

f=1
TNaOH/глютамин.к-те= 0,1*147,1/1000 = 0,01471 г/мл
TNaOH/аскорб.к-те= 0,1*176,12/1000 = 0,017612 г/мл
Vтеор. = 0,075/0,01471 = 5,1 млVтеор. = 0,025/0,017612 = 1,42 мл
Раздельное титрование: кислота аскорбиновая(определяется йодометрическим методом).
Берем навеску 0,1г и растворяем ее в 5мл воды, титруют 0,1 М раствором йода до синего окрашивания (индикатор крахмал).
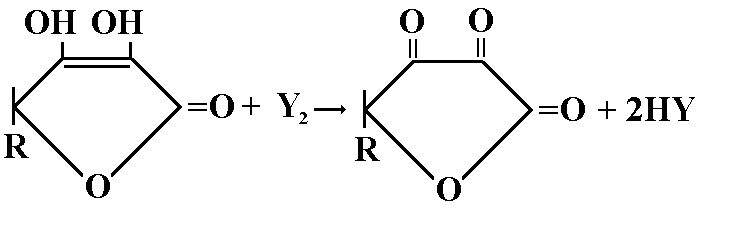
Fэкв=1/2
TY2/аскорб.= 0,1*176,12/1000 = 0,008806 г/млVтеор. = 0,025/0,008806 = 2,84 мл
![]()
Расчет отклонения:
Относит.ошибка: 0%
Ошибка не превышает допустимое приказом № 305 (15%).
![]()
Расчет отклонения:
Относит.ошибка: 0%
Ошибка не превышает допустимое приказом № 305 (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Rp.:Riboflavini0,002
Ac.ascorbinici0,02
Ac.nicotinici 0,03
Natrii chloridi 0,05
Aq. purificatae ad 10 ml
Описание:представляет собой прозрачную жидкость зеленовато-желтого цвета, без запаха, соленого вкуса, без механических примесей. Общий объем – 10 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Рибофлавин см.пропись №2 за 19.04.13г.
Кислота аскорбиновая см. предыдущую пропись.
Кислота никотиновая см.пропись №1 за 18.04.13г.
Натрия хлорид см.пропись №1 за24.04.13г.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Рибофлавин (фотоэлектроколориметрия). Методику см.пропись №2 за 19.04.13г.
Содержание рибофлавина в граммах (Х) определяют по формуле:
,![]()
Расчет отклонения:
Абс.ошибка: 0,002 – 0,0019 = 0,0001;
Относит.ошибка:
![]() (по П №305 допустимо 20%)
(по П №305 допустимо 20%)
С![]()
![]()
![]() уммарное
титрование: кислота аскорбиновая и
кислота никотиновая.Алкалиметрия.
уммарное
титрование: кислота аскорбиновая и
кислота никотиновая.Алкалиметрия.
![]()
Суммарный объем NaOH=0,57+1,22=1,79мл
Раздельное титрование: кислота аскорбиновая. Йодометрия. Методику и химизм смотри в предыдущей прописи.
Раздельное титрование: натрия хлорид.
А![]()
![]() ргентометрия.F
ргентометрия.F![]() =1
=1
Т=0,1*58,44/1000=0,005844г/мл
Vтеор. = 0,005/0,005844 = 0,86 мл
Отн.ошибка: 0% (по П №305 допустимо 10%).
![]()
![]()
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 29.04.13
Пропись № 1 Rp:Tinct.Menthae8,0 Н-ка Мяты 8,0
Tinct.Valerianae20,0 Н-ка Валерианы 20,0
Magnesiisulfatis1,6 Магния сульфат 1,6
Coffeini-natriibenzoates0,8 Кофеин-бензоат натрия 0,8
Natriibromidi6,0 Натрия бромид 6,0
Aq.purificatae400mlВода очищенная 400мл
Описание: Мутная жидкость с запахом мяты и валерианы. Общий объем 428 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Магния сульфат.
К 0,5 мл ЛФ прибавляют по 5-6 капель раствора аммония хлорида, натрия фосфата и 3-4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенной кислоте уксусной.
MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4↓ + Na2SO4 + H2O
К 0,5 мл ЛФ прибавляют 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
MgSO4+BaCl2→BaSO4↓ +MgCl2
Кофеин-бензоат натрия. К 0,5 мл ЛФ прибавляют 2 капли железа (III) хлорида. Образуется розовато-желтый осадок.
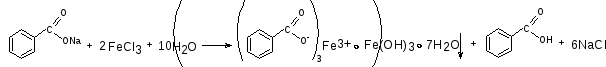
Натрия бромид. К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr+AgNO3→AgBr↓светло-желт.+NaNO3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Магния сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионамиMg2+.
К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,1 моль/л раствором Трилона Б до синего окрашивания.


В точке эквивалентности:

f![]() = 1
= 1
T= 0,1*123/1000 = 0,01234
Vтеор. = 0,002/0,01234 = 0,16
Расчет отклонения: Абс.отклонение:
1,585 – 1,6 = -0,015; Отн.отклонение:![]()
(по П №305 допустимо 5%).
Кофеин-бензоат натрия.
К 1 мл ЛФ прибавляют 3 мл эфира и титруют 0,1 моль/л раствором соляной кислоты (индикатор – метиловый оранжевый).

f![]() = 1
= 1
Т = 0,1*232/1000 = 0,02320 г/мл
Vтеор. = 0,002/0,02320 = 0,08
![]()
Расчет отклонения: Абс.отклонение: 0,794 – 0,8 = 0,006; Относит.отклонение:
(по П №305 допустимо 7%).
Натрия бромид (аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида.
NaBr+AgNO3→AgBr↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f![]() = 1
= 1
Т = 0,1*102,9/1000 = 0,01029
Vтеор. = 0,0075/0,01029 = 0,72
![]()
Расчет отклонения:Абс.отклонение: 6,16 – 6 = 0,16; Отн.отклонение:
(по П №305 допустимо 3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
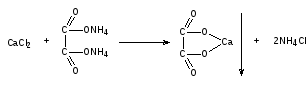
Пропись № 2 Rp: Sol. Calcii chloridi 1% – 50ml
Кальция хлорида 0,5
Воды очищенной 50 мл
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ
Хлорид-ион. К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
Cl-+Ag+→AgCl↓бел.
Кальций-ион. К 1 мл ЛФ прибавляют по 2 капли гидроксида аммония и хлорида аммония, 4 капли раствора аммония оксалата. Образуется белый осадок, растворимый в разведенных минеральных кислотах.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Кальция хлорид (Рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Кальция хлорид n=1,3342
Вода очищенная n0=1,3330
![]()
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 30.04.13
Пропись № 1 Rp:Inf.HerbaeLeonuriex12,0-200ml
Natriibromidi3,0
Natriibarbital2,0
Описание: Мутная жидкость с запахом мяты и валерианы. Общий объем 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия бромид. К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr+AgNO3→AgBr↓светло-желт.+NaNO3
Барбитал натрия. Реакция комплексообразования с нитратом кобальта в спирто-водной среде (для предотвращения гидролиза), в присутствии хлорида кальция, который играет роль буфера.

КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Барбитал натрий. Количественное содержание в растворе определяют методом нейтрализации (алкалиметрии) в неводном растворителе. Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл ЛФ, прибавляют 1 мл этанола и 2 капли тимолфталеина и титруют 0,1М раствором натрия гидроксида до голубого окрашивания.
Т = 0,1*232,0/1000 = 0,0232г/мл
Vтеор. = 0,005/0,0232 = 0,21
На титрование ушло 0,22мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:

Расчет отклонения:Отн.отклонение: 0%
(по П №305 допустимо 4%).
Натрия бромид(аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,01029 натрия бромида.
NaBr+AgNO3→AgBr↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f![]() = 1
= 1
Т = 0,1*102,9/1000 = 0,01029
Vтеор. = 0,0075/0,01029 = 0,73
Расчет отклонения:Отн.отклонение: 0%
(по П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Acidi aminocapronici 5% - 100 ml
Раствор кислоты аминокапроновой 5%-100 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ: см.пропись №1 за 11.04.13г.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: (кислотно-основное титрование в лед.CH3COOH). См.пропись №1 за 17.04.08г.
f=1T= 0,1*103/1000 = 0,0103 г/млVтеор. = 0,05/0,0103 = 4,85 мл
А![]() бс.ошибка:5,0–
4,95= 0,05;
бс.ошибка:5,0–
4,95= 0,05;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 (3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 06.05.13
Пропись № 1 Rp:Magnesiisulfatis8,0 Магния сульфат 8,0
Tinct.Valerianae8mlН-ка валерианы 8 мл
Sol.Citrali1% - 8mlР-р цитраля 1%-8 мл
Aq.purificatae200mlВода очищенная 200мл
Описание: Мутная жидкость с запахом цитраля и валерианы. Общий объем 216 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Магния сульфат. см.пропись №1 за 28.03.13г.
Раствор цитраля. Определяется по характерному запаху.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Магния сульфат (трилонометрически). Обоснование метода и методику см.пропись №1 за 28.03.13г.
f![]() = 1
= 1
T= 0,1*123/1000 = 0,01234 г/мл
Vтеор. = 0,0185/0,01234 = 1,50 мл
Расчет отклонения:
Абс.ошибка:8,05– 8,0= 0,05;
Относит.ошибка:![]() (
по П №305 допустимо 3%).
(
по П №305 допустимо 3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp:Sol.Euphyllini2% – 100mlРаствор эуфилллина 2%-100мл
Описание:представляет собой бесцветную, прозрачную жидкость без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Эуфиллин. К 0,5 мл препарата прибавляют по каплям раствор меди сульфата. Раствор окрашивается в яркий фиолетовый цвет, обусловленный образование комплекса сульфата меди с этилендиамином. Химизм см.пропись №2 за 02.04.13г.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Эуфиллин (метод нейтрализации). Метод основан на способности этилендиамина, как основания, нейтрализовать соляную кислоту.
К 1 мл препарата прибавляют 1 каплю метилоранжа и титруют 0,1 моль/л раствором соляной кислоты.
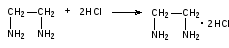
f= ½
Mmэкв. = 60,1*½ = 30,05
Т HCl/этилендиамину= 0,1*30,05/1000 = 0,003005 г /мл
Т![]() условный= 0,003005 *6,3 (Кпер)=0,0189315
г/мл
условный= 0,003005 *6,3 (Кпер)=0,0189315
г/мл
Vтеор. = 0,02/0,0189315 = 1,06 мл
Расчет отклонения:
Абс.ошибка: 2,0 – 1,99 = 0,01;
Относит.ошибка:
![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 07.05.13
Пропись № 1Rp:Sol.Acidihydrochloridi8,3% - 4,4ml
Natrii Chloridi 5,2
Aquae purificatae ad 1000 ml
Стабилизатор Вейбеля для растворов глюкозы:
Р-р кислоты хлороводородной 8,3%-4,4 мл
Натрия хлорид 5,2
Вода очищенная до 1000 мл
Описание:на анализ поступила бесцветная прозрачная жидкость без запаха и механических включений в прозрачном бесцветном флаконе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия хлорид и хлороводородная кислота.
На Na+: см пропись №1 за 01.04.13г.
На Cl-:К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
N![]() aCl
+AgNO3AgCl+NaNO3
aCl
+AgNO3AgCl+NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота хлористоводородная, анализ производится методом нейтрализации (алкалиметрия). Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл исследуемого раствора прибавляют 1 каплю метилового оранжевого и титруют 0,1 М раствором натрия гидроксида до желтой окраски.
H![]() Cl
+ NaOH NaCl + H2O,
Fэкв=1
Cl
+ NaOH NaCl + H2O,
Fэкв=1
М.м. экв.HCl = М.м.HCl . Fэкв.= 1. 36,46=36,46г/моль
Т.к. для изготовления стабилизатора Вейбеля используется разбавленная кислота хлористоводородная, то используют условный титр.
![]()
Расчет теоретического объема титранта на 1 мл аликвоты раствора:
В 1000 мл раствора - 4,4 мл кислоты хлороводородной
![]() 1 мл - 0,0044 мл
1 мл - 0,0044 мл
На титрование ушел 0,1мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:

Ошибка не превышает допустимое приказом № 305 отклонение для массы навески от 2,0 до 5,0 (4%).
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
К 1 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета.
NaCl+AgNO3→AgCl↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f= 1
T= 0,1*58,44/1000 = 0,005844
5,2 – 1000
х - 1мл; аф=0,0052
Vтеор.= аф/T= 0,0052/0,005844 = 0,89
Vпр=0,78
На титрование ушло 0,99 мл 0,1М раствора кислоты хлористоводородной, т.е. оттитровалась сумма хлоридов. Т.к. фактор эквивалентности в обоих случаях равен 1, то соответственно содержание натрия хлорида в граммах:
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Пропись № 2 Rp: Sol. Cupri Sulfatis 3% - 150ml
D.S. наружное для ФТО.
Описание:Голубая прозрачная жидкость, без запаха, без механических примесей. Общий объем – 500 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Меди сульфат.
SO42-К 0,5 г порошка прибавляют 1 мл воды, затем 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
CuSO4+BaCl2→BaSO4↓ +CuCl2
C u2+
К 0,5 г порошка прибавляют 1 мл воды,
затем по каплям раствор аммиак. Образуется
голубой осадок. После добавления избытка
раствора аммиака осадок растворяется
и появляется темно-синее окрашивание.
u2+
К 0,5 г порошка прибавляют 1 мл воды,
затем по каплям раствор аммиак. Образуется
голубой осадок. После добавления избытка
раствора аммиака осадок растворяется
и появляется темно-синее окрашивание.
2CuSO4 + 2NH4OH → Cu2(OH)2SO4↓ + (NH4)2SO4
Cu2(OH)2SO4 + (NH4)2SO4 + 6NH4OH → 2[Cu(NH3)4]SO4 + 8 H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Меди сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионамиCu2+.
К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,05 моль/л раствором Трилона Б до синего окрашивания.
Химизм смотри в прописи №1 за 16.04.08г
f=1
T= 0,05*249,68/1000 = 0,012484 г/мл
Vтеор. = 0,015/0,012484 = 1,20 мл
![]()
Абс.ошибка:15,0– 14,86= 0,14;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 10 до 20г (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 08.05.13
Пропись № 1Rp.: Sol. Аtropinisulfatis0, 1 %-10ml
D. S. По 5 - 8 капель внутрь 2 - 3 раза в день перед едой.
Состав: Атропина сульфата 0,1
Натрия хлорида 0,08
Воды очищенной 10 мл
Описание:на анализ поступила бесцветная прозрачная жидкость без запаха и механических включений в прозрачном бесцветном флаконе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия хлорид: см пропись №1 за 24.04.13г.
А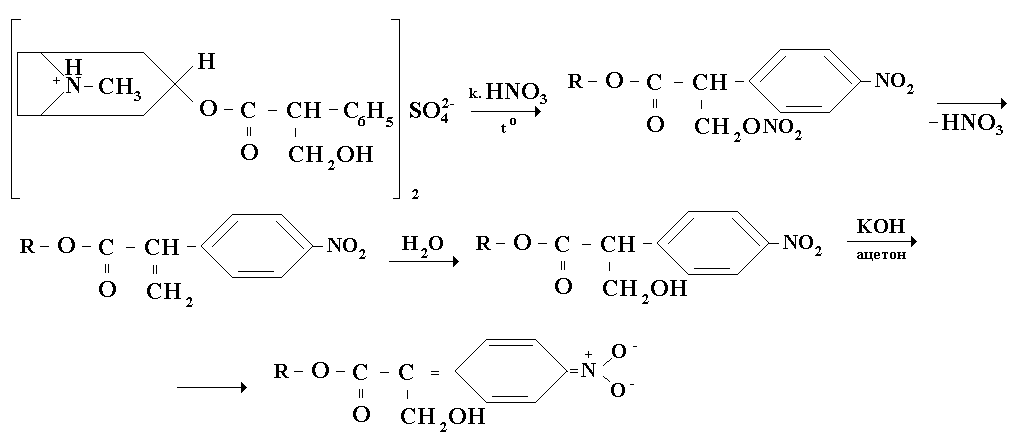 тропина
сульфат:
тропина
сульфат:
[атропин]2 SO42- + BaCl2 =Ba2SO4 +[атропин] +2HCl
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Атропина сульфат алкалиметрия.
[атропин]2 SO42- + NaOH =Na2SO4 +[атропин] +H2O f=1
T![]() = 0,1*694,8/1000 = 0,06948 г/мл
= 0,1*694,8/1000 = 0,06948 г/мл
0,1 – 10 мл
х - 5мл; аф=0,05
Vтеор.= аф/T= 0,05/0,06948 = 0,72мл
Vпр=0,72
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 15%).
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
1 мл ЛФ прибавляют титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета.
NaCl + AgNO3 → AgCl↓бел. + NaNO3 f=1
T![]() = 0,1*58,44/1000 = 0,005844
= 0,1*58,44/1000 = 0,005844
0,08 – 10мл
х - 0,5мл; аф=0,004
Vтеор.= аф/T= 0,004/0,005844 = 0,68
Vпр=0,68
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 15%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно
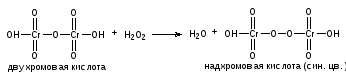
Пропись № 2 Sol.Hydrogeniiperoxydi3% - 50ml
Раствор перекиси водорода 3%-50мл
Описание:Представляет собой бесцветную, прозрачную жидкость со слабым своеобразным запахом. Общий объем 50мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
К 1 мл исследуемого раствора прибавляют 2 капли разведенной серной кислоты и по каплям раствор калия перманганата. Раствор калия перманганата обесцвечивается.
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 +K2SO4 + 2MnSO4 + 8 H2O
1 мл препарата подкисляют 4 каплями разведенной серной кислоты, прибавляют 2 мл эфира и 4 капли раствора бихромата калия и взбалтывают, эфирный слой окрашивается в синий цвет.
K2Cr2O7 + H2SO4 → H2Cr2O7 + K2SO4
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Перманганатометрический метод – основан на восстановительных свойствах перекиси водорода.
К 0,1 мл ЛФ прибавляют 5 мл разведенной серной кислоты и титруют 0,1 моль/л раствором калия перманганата до слабо розового окрашивания.
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 +K2SO4 + 2MnSO4 + 8 H2O
f= ½
Mmэкв.= 34,02*1/2 = 17,01
T= 0,1*17,01/1000 = 0,001701г/мл
Vтеор.= 0,003/0,001701= 1,76мл
![]() (по ГФXдопустимо отклонение
5,7-6,3%).
(по ГФXдопустимо отклонение
5,7-6,3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
