
Учебное пособие по ароматике
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ СЕВЕРСКИЙ ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ - филиал Федерального государственного бюджетного образовательного учреждения высшего профессионального образования
«Национальный исследовательский ядерный университет МИФИ»
С.А. Безрукова
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. СПОСОБЫ ПОЛУЧЕНИЯ. ХИМИЧЕСКИЕ СВОЙСТВА. ПРАВИЛА ОРИЕНТАЦИИ В АРОМАТИЧЕСКОМ ЯДРЕ
Учебное пособие
Северск 2011
1
УДК 547
Безрукова С.А. Ароматические углеводороды. Способы получения. Химические свойства. Правила ориентации в ароматическом ядре: учебное пособие.– Северск: Изд-во СТИ НИЯУ МИФИ, 2011. – 50 с.
Пособие содержит материал, необходимый для изучения студентами раздела курса органической химии – ароматические углеводороды, способы получения, химические свойства и правила ориентации в ароматическом ядре. Изложение теоретического материала сопровождается примерами.
Предназначено для студентов дневного обучения технологического факультета специальностей 240601 при изучении курса “Органическая химия”.
Руководство одобрено на заседании методического семинара кафедры ХиТМСЭ (протокол № 1 от «17» января 2011 г.)
Печатается в соответствии с планом выпуска учебно-методической литературы на 2011 г., утвержденным Советом СТИ НИЯУ МИФИ.
Рег. № _______от «__»___________
Рецензент В.А. Карелин, профессор кафедры ХиТМСЭ, д-р. хим. наук Редактор Р.В. Фирсова
Подписано к печати ______Формат 60×84/32 Гарнитура Times New Roman, Бумага писчая №2 Плоская печать. Усл. печ. л.1,45 Уч. изд. л.2,63 Тираж 30 экз. Заказ ______
Отпечатано в ИПО СТИ НИЯУ МИФИ 636036 Томская обл., г. Северск Томской обл., пр. Коммунистический , 65
2
|
Содержание |
|
Введение……………………………………………………...................... |
5 |
|
1 Ароматические соединения с одним бензольным ядром……………… |
6 |
|
1.1 |
Электронное и пространственное строение бензола ……………. |
6 |
1.2 |
«Ароматичность» - совокупность особых свойств бензола………. |
8 |
1.3.Гомологический ряд, номенклатура и изомерия аренов…………. 9
1.3.1Номенклатура………………………………………………. 9
1.3.2Изомерия……………………………………………………. 10
1.4Получение бензола и его гомологов………………………………. 11
1.4.1 Ароматизация алканов и циклоалканов………………… 12
1.4.2Реакция Вюрца–Фиттига…………………………………. 12
1.4.3Тримеризация ацетилена…………………………………. 13
1.4.4Реакция Фриделя–Крафтса ………………………………. 13
1.4.5 |
Синтез из солей ароматических кислот…………………. |
14 |
1.4.6 |
Восстановление ароматических кетонов………………… |
14 |
1.5Физические свойства………………………………………………. 16
1.6Химические свойства………………………………………………. 16
1.6.1 Реакции присоединения…………………………………… |
16 |
1.6.2 Реакции окисления………………………………………… |
17 |
1.6.3 Реакции замещения………………………………………… |
18 |
1.7 Реакции электрофильного замещения в ароматическом ряду…. |
20 |
1.7.1Галогенирование…………………………………………… 20
1.7.2Нитрование………………………………………………… 21
1.7.3Сульфирование……………………………………………. 23
1.7.4 Алкилирование и ацилирование…………………………. |
24 |
1.8 Эффекты заместителей при электрофильном замещении……… |
26 |
1.8.1 Ориентирующее влияние заместителей………………….. |
26 |
1.8.2 Влияние заместителей на реакционную способность…… |
29 |
3
2 Ароматические галогенопроизводные…………………………………… 30
2.1Номенклатура и изомерия………………………………………….. 30
2.2Физические свойства………………………………………………. 31
2.3Химические свойства………………………………………………. 31
2.3.1Реакции нуклеофильного замещения…………………….. 31
2.3.2 Реакции электрофильного замещения…………………… |
32 |
3 Ароматические нитросоединения……………………………………….. |
32 |
3.1 Номенклатура и изомерия………………………………………… |
32 |
3.2Физические свойства………………………………………………. 33
3.3Химические свойства………………………………………………. 33
3.3.1Восстановление нитросоединений………………………….. 33
3.3.2Подвижность атома галогена в ароматических
нитросоединениях ……………………………………………... |
33 |
3.3.3 Реакции замещения…………………………………………. |
33 |
3.3.4 Образование аци-нитроформы…………………………….. |
35 |
4 Ароматические сульфокислоты…………………………………………. |
35 |
4.1 Номенклатура и изомерия………………………………………… |
35 |
4.2Физические свойства………………………………………………. 36
4.3Химические свойства………………………………………………. 36
4.3.1Реакции сульфогруппы…………………………………….. 36
4.3.2Реакции замещения…………………………………………. 37
4.3.3Реакции бензольного ядра………………….…………..….. 37
5 Задания для самостоятельной работы…………………………….…..… |
38 |
Литература……………………………………………………………….. |
50 |
4
Введение
Ароматические соединения, или арены, – большая группа соединений карбоциклического ряда, молекулы которых содержат устойчивую циклическую группировку из шести атомов углерода (бензольное кольцо), обладающую особыми физическими и химическими свойствами.
К ароматическим соединениям относится, прежде всего, бензол С6Н6 и его многочисленные гомологи и производные.
Ароматические соединения могут содержать в молекуле одно или несколько бензольных ядер (многоядерные ароматические соединения).
В данном пособии рассмотрены особенности строения молекулы бензола, физико-химические свойства и способы получения. Представлены механизмы реакций нуклеофильного и электрофильного замещения в бензольном кольце и боковой цепи, способы получения основных производных бензола: ароматических нитросоединений и сульфокислот, галогенопроизводных. Рассмотрено влияние заместителей на реакционную способность бензола и его гомологов, а также ориентирующее влияние заместителей в реакциях нуклеоифльного и электрофильного замещения.
Для лучшего усвоения и понимания теоретического материала, привития навыков практического применения знаний по данному разделу приведены задания для самостоятельной работы студентов.
5

1 Ароматические соединения с одним бензольным ядром
1.1 Электронное и пространственное строение бензола
Бензол (бензен) С6Н6 – родоначальник обширного ряда углеводородов, которые называют ароматическими.
Строение молекулы бензола обычно представляют циклической структурой, предложенной немецким химиком А. Кекуле (1865), как показано на рисунке 1 [6.1].
H
H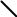 C
C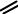 C C
C C H
H
|
|
|
|
|
|
|
H |
C C C |
H |
||||
|
|
|
|
|
||
|
|
H |
или упрощенно: |
|||
|
|
|
|
|
|
|
Рисунок 1 - Бензол. Структурная формула Кекуле
Формула бензола Кекуле правильно отражает равноценность всех атомов углерода и водорода в молекуле бензола. Но не объясняет ряда его специфических свойств. Эти особенности удалось обосновать только после разработки современной теории химических связей.
Эта формула не отражает действительного строения и свойств бензола, но до настоящего времени широко используется химиками-органиками. Вопервых, она удобна для написания химических реакций, а во-вторых, при работе с этой формулой химики вкладывают в нее современный смысл, понимая при этом, что она – лишь символ, а не выражение реальной структуры.
Действительно, согласно формуле Кекуле, бензол – замкнутая система с тремя сопряженными двойными связями (циклогексатриен–1,3,5). Эта формула правильно отражает элементный состав и равноценность всех водородных атомов в молекуле.
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм. Это расстояние является средним между длинами одинарной (0,154 нм) и двойной (0,134 нм) связей. В одной плоскости с кольцом лежат и шесть связей С–Н, каждая из которых образует с ребром шестиугольника угол, равный 120°. Каждый углеродный атом в молекуле бензола находится в состоянии sр2-гибридизации. Он связан тремя своими гибридными орбиталями с двумя соседними атомами углерода и одним атомом водо-
6
рода, образуя три σ-связи. Четвертая – негибридизованная 2р-орбиталь атома углерода, ось которой перпендикулярна плоскости бензольного кольца, перекрывается с 2р-орбиталями двух соседних углеродных атомов (справа и слева), как показано на рисунке 2.
Рисунок 2 - Взаимное перекрывание 2р-орбиталей в молекуле бензола: а - вид сбоку; б - вид сверху
Такое пepeкрывание происходит над и под плоскостью кольца. В ре-
зультате образуется единая замкнутая π-электронная система. При этом возникшее сопряжение осуществляется полнее, чем в бутадиене –1,3. Две области наибольшей π-электронной плотности расположены по обе стороны кольца (область всех σ-связей), как показано на рисунке 3.
Рисунок 3 - Равномерное распределение π-электронной плотности в молекуле бензола в виде двух соприкасающихся «бубликов» (торов)
В результате равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей. Другими словами, в молекуле бензола С–С-связи не похожи на обычные простые или двойные связи, характерные для алканов и алкенов. Этим можно объяснить тот факт, что при обычных условиях бензол не вступает в реакции, характерные для непредельных углеводородов.
Энергия связи С–С в молекуле бензола составляет 490 кДж/моль. Эта величина является также средней между энергиями одинарной и двойной связей.
7
Равномерное распределение π-электронной плотности между всеми углеродными атомами, обусловленное сопряжением, является причиной высокой устойчивости молекулы бензола. Реальная молекула бензола отличается от структуры, выраженной формулой Кекуле, на 150,7 кДж/моль. Эта величина является мерой устойчивости бензола. Поэтому С–С - связи в его молекуле обладают повышенной прочностью. Это сказывается на химическом поведении бензола. Так, при химических реакциях бензол проявляет высокую устойчивость к окислителям, нагреванию, к реакциям присоединения и т.д.
Чтобы показать выравненность π-электронной плотности в молекуле бензола, в формуле Кекуле с этой целью используют стрелки (I), пунктирные линии (II) или вписанную окружность (III), символизирующие делокализацию электронной плотности, показанные на рисунке 4.
(I) |
(II) |
(III) |
Рисунок 4 – Схематичное изображение молекулы бензола
Атомы водорода можно не изображать, подразумевая их наличие и четырехвалентное состояние углерода.
Однако ни одна из этих формул не может отразить реальных свойств бензола. Поэтому чаще используют обычную формулу Кекуле, помня об ее недостатках.
1.2 «Ароматичность» – совокупность особых свойств бензола
Бензол и его многочисленные производные обладают рядом особенностей. Совокупность этих свойств известна под названием "ароматический характер" или "ароматичность".
Главной особенностью ароматических углеводородов является равно- мерное распределение π-электронной плотности в молекуле. Единая устой- чивая замкнутая система π-электронов в циклической молекуле – основной признак ароматичности. Необходимым условием для такой делокализации π-электронов является строгая параллельность осей 2р-орбиталей, участвующих в образовании замкнутой π-электронной системы. Поэтому молекулы ароматических соединений обязательно имеют плоское строение. Если же это условие не выполняется, то круговое сопряжение π-электронов наруша-
8
ется, как например, в молекуле циклооктатетраена. В результате это соединение не является ароматическим.
Для ароматических соединений характерно также определенное число π-электронов в молекуле. Немецкий химик-теоретик Э.Хюккель вывел п р а в и л о (1931): плоские циклические соединения, имеющие сопряженную систему π-электронов, могут быть ароматическими, если число этих элек-
тронов равно 4n + 2 (где п = 0, 1, 2, 3 и т.д.). Другими словами, в ароматических соединениях может содержаться 2, 6, 10, 14 π-электронов и т.д. Это правило строго выполняется только для моноциклических соединений.
Эти особенности строения объясняют многие свойства ароматических веществ. Например, они вступают преимущественно в реакции замещения, а не присоединения, несмотря на формальную ненасыщенность. Кроме того, ароматические соединения обладают высокой термодинамической устойчивостью.
1.3 Гомологический ряд, номенклатура и изомерия аренов
1.3.1 Номенклатура
Общее систематическое название ароматических углеводородов – арены. По составу каждый последующий гомолог отличается от предыдущего на гомологическую разность – СН2. Чтобы вывести формулу второго пред-
ставителя гомологического ряда аренов, необходимо один из атомов водорода бензола заместить на метильную группу (– СН3). Увеличивать размер цикла (до семичленного) нельзя!
По номенклатуре IUPAC второго представителя ряда аренов называют метилбензолом. Поскольку все атомы водорода в бензоле абсолютно одинаковы, изомеров у него нет.
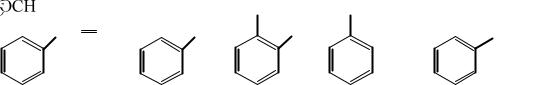
При названии дизамещенных производных бензола атомы углерода цикла нумеруют от более простого заместителя к более сложному кратчайшим путем, указывают положение заместителя, его наименование. Основа названия – слово «бензол». Общее тривиальное название всех изомерных диметилбензолов ксилолы.
Для названия некоторых гомологов бензола широко используются старые тривиальные названия, показанные на рисунке 5: винилбензол (I) называют стиролом, метилбензол (II) – толуолом, диметилбензол (III) – ксилолом, изопропилбензол (IV) – кумолом, метоксибензол (V) – анизолом и т.д.
(I) |
(II) |
(III) |
(IV) |
(V) |
Рисунок 5 - Гомологи бензола
9
Названия радикалов гомологов бензола производят от названий соответствующих углеводородов, добавляя к корню суффикс – ил (толил, ксилил и т.п.) и обозначая буквами (о-, м-, п-) или цифрами положение боковых цепей.
Называя более сложные производные бензола из возможных порядков нумерации выбирают тот, при котором сумма цифр номеров заместителей будет наименьшей.
Например, диметилэтилбензол
по систематической номенклатуре следует называть 1,4 – диметил– 2 – этилбензол (сумма цифр равна 7 = 1+4+2), а не 1,4 – диметил – 6 – этилбензол (сумма цифр равна 11 = 1+4+6).
Высшие гомологи бензола рассматривают как производные алканов, поэтому их названия дают не от названия ароматического ядра, а от названия боковой цепи, например 2 – фенилгексан имеет следующее строение
Ароматические радикалы имеют общее название арилы (Аr). Радикал С6Н5 называют фенилом (от старого названия бензола "фен"), C6H4 – фениле-
ном, С6Н5—СН2— – бензилом, С6Н5— СН – бензилиденом.
1.3.2 Изомерия
Общая формула гомологов бензола СnН2n-6. Все шесть атомов водорода в молекуле бензола совершенно одинаковы и при замещении любого из них на один и тот же радикал образуется одно и то же соединение. Поэтому однозамещенный бензол изомеров не имеет. Например, существует только один метилбензол – толуол:
CH3
10
