
Учебное пособие по ароматике
.pdf
При замещении двух атомов водорода на метильные группы образуются три изомера – ксилолы, которые отличаются друг от друга расположением
заместителей:
о-диметилбензол, |
м-диметилбензол, |
п-диметилбензол, |
или 1,2-диметил- |
или 1,3-диметил- |
или 1,4-диметил- |
бензол (о-ксилол) |
бензол (м-ксилол) |
бензол (п-ксилол) |
Вместо буквенного обозначения можно пользоваться цифровыми: 1,2–
орто (о-); 1,3–мета (м-); 1,4–пара (п-).
Изомеры могут отличаться и природой заместителей – нормального и изостроения:
пропилбензол |
изопропилбензол |
|
(кумол) |
Изомеры могут отличаться природой и положением заместителей одновременно. Так, углеводород состава C8H10 может иметь четыре изомера: один этилбензол и три диметилбензола (о-, м- и п-изомеры):
этилбензол |
о-ксилол |
м-ксилол |
п-ксилол |
11

1.4 Получение бензола и его гомологов
Основные источники получения ароматических углеводородов – сухая перегонка каменного угля (коксование) и нефтепереработка.
При переработке каменноугольной смолы можно получить огромное количество разнообразных органических соединений в основном ароматического ряда. Это бензол и его гомологи, фенол, нафталин, антрацен и др.
Вторым источником ароматических углеводородов является нефть. Некоторые сорта нефти содержат до 60 % ароматических углеводородов, которые выделяют простой перегонкой, пиролизом или каталитическим крекингом.
Бензол и его гомологи можно получать синтетическим путем. Для этого используют следующие способы.
1.4.1 Ароматизация алканов и циклоалканов
Дегидрирование углеводородов нефти (ароматизация) – основной промышленный способ получения бензола и его гомологов.
Условия реакции – при пропускании над нагретым до t = 300 оС катализатором (kat = Pt, Cr2O3, оксиды Mo и V) или до t = 450 оС катализатором
(kat = Cr2O3∙Al2O3).
гексан |
|
бензол |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 – этилгексан |
этилбензол |
циклоалкан бензол
Исходные вещества – предельные углеводороды, начиная с гексана, а также циклогексан и его алкилзамещенные производные.
1.4.2 Реакция Вюрца–Фиттига
Реакция подобна синтезу Вюрца в алифатическом ряду, но разделение продуктов реакции в этом случае происходит легче.
12
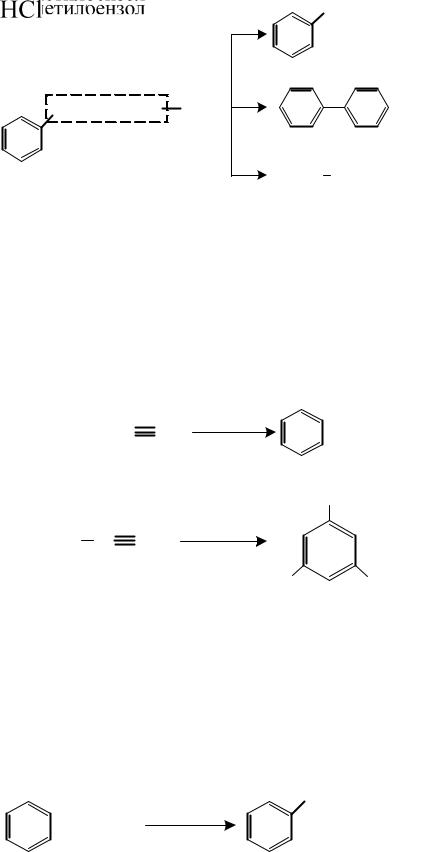
Механизм этого синтеза не отличается от синтеза Вюрца: реакция протекает через стадию образования металлорганических соединений.
В результате реакции возможно образование нескольких продуктов.
1.4.3 Тримеризация ацетилена
Ацетилен и его гомологи образуют арены при температуре красного каления (Бертло).
При нагревании в присутствии активированного угля (Н.Д. Зеленский) или в присутствии катализатора – Ni(CO)2[(C6H5)3P]2 (В. Реппе) ацетилен образует бензол
В присутствии катализатора данная реакция проходит при значительно более низких температурах и с хорошим выходом бензола.
1.4.4 Реакция Фриделя–Крафтса
Важный метод получения гомологов бензола – это реакция Фриделя– Крафтса – Густавсона (реакция алкилирования):
13
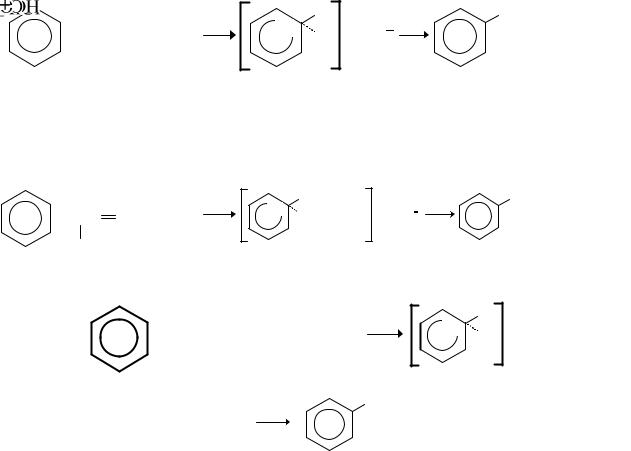
этилбензол
При алкилировании бензола галогеналкилами образуются σ-комплексы в соответствии с реакцией:
σ-комплекс
Галогенопроизводные могут быть заменены в этой реакции олефинами или спиртами. Например, реакции алкилирования бензола пропеном и спиртом имеют вид:
Здесь в качестве катализатора применяют фосфорную, серную и фтористоводородную кислоты.
1.4.5 Синтез из солей ароматических кислот
Бензол может быть получен перегонкой солей бензойной кислоты со щелочами:
t |
+ Na2CO3. |
C6H5—COONa + NaOH ¾¾® C6H6 |
|
бензоат натрия |
|
Этот метод применим и для получения других углеводородов.
1.4.6 Восстановление ароматических кетонов
Чистые ароматические углеводороды получаются восстановлением соответствующих ароматических кетонов:
- амальгамированным цинком в соляной кислоте (по Клемменсену):
C6H5 –CO – CH3+ Zn + 2HCl |
Hg |
–CH2 – CH3 + H2O + ZnCl2; |
¾¾¾® C6H5 |
14
метилфенилкетон |
этилбензол |
(ацетофенон) |
|
- гидразином в щелочной среде (восстановление по Кижнеру-Вольфу):
OH-,200 oC |
+ H2O. |
CH3–C6H5–CO–CH3+ NH2– NH2 ¾¾¾¾¾¾® CH3–C6H5–CH2–CH3 |
При этом исходные кетоны получают реакцией Фриделя – Крафтса:
AlCl3 |
—CO — CH3+ HCl. |
C6H6 + CH3 —COCl ¾¾¾¾® C6H5 |
|
хлористый ацетил |
|
Для нормального течения реакции следует использовать более одного моль хлорида алюминия. Предполагается, что хлорид алюминия образует с хлорангидридом комплекс, который становится активным началом в реакции под влиянием избытка хлорида алюминия:
CH3 —COCl + AlCl3 → [CH3 —CO]+AlCl4- ,
[CH3 —CO]+AlCl4- + C6H6 → |
|
|
|
|
|
|
|
|
|
|
|
→ |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
||||||||
|
|
|||||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
→ C6H5 —CO — CH3 ∙ AlCl3 + HCl
C6H5 —CO — CH3 + Al(OH)3+ 3HCl.
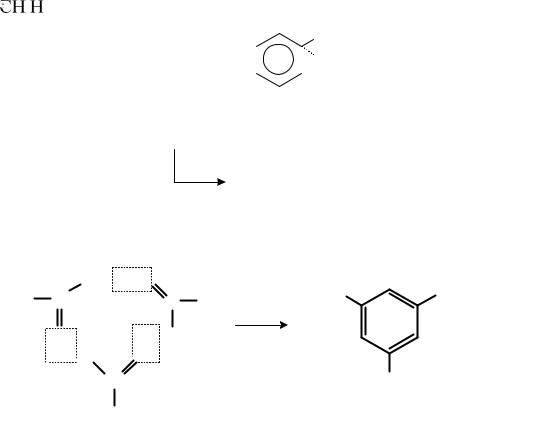
Ароматические углеводороды получаются при нагревании кетонов жирного ряда с серной кислотой. Так, например, из ацетона получается мезитилен
ацетон |
мезитилен |
Гомологи бензола можно получить также восстановлением соответствующих производных ароматических углеводородов водородом в присутствии катализаторов:
kat |
—CH2 —CH2 |
— R. |
C6H5 —CH = CH — R + H2 ¾¾® C6H5 |
15

В качестве катализаторов данной реакции применяют никель, платину или палладий.
1.5. Физические свойства
Низшие члены гомологического ряда бензола – чаще жидкости со своеобразным запахом, нерастворимые в воде, но хорошо растворимые во многих органических растворителях. Горят ярким коптящим пламенем. С повышением молекулярной массы увеличивается температура кипения (и плавления), которая находится в зависимости от строения ароматических углеводородов.
1.6 Химические свойства
Из химических свойств ароматических соединений следует особенно отметить реакции замещения, а также некоторые реакции присоединения, протекающие в особых условиях, и реакции окисления.
1.6.1 Реакции присоединения
Эти реакции не характерны для бензола, поэтому они протекают с большим трудом. Только в особых условиях (высокая температура, облучение ультрафиолетовым светом, катализатор) бензол проявляет слабо выраженный непредельный характер и может присоединять водород и галогены. Например, в присутствии катализатора (платина, никель или палладий) бензол вступает в реакцию гидрирования с образованием циклогексана:
При облучении УФ-светом к бензолу могут присоединиться шесть атомов хлора. В результате образуется гексахлорциклогексан (гексахлоран):
Галогеноводороды и вода к бензолу не присоединяются.
Подобно другим непредельным соединениям бензол присоединяет озон, образуя триозонид – чрезвычайно взрывчатое вещество.
16
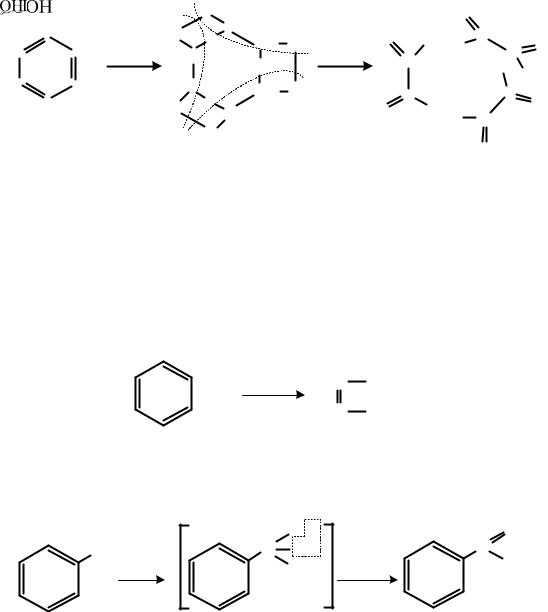
При действии воды этот озонид дает три молекулы глиоксаля:
Все эти превращения характеризуют бензол как непредельное соединение.
1.6.2 Реакции окисления
Бензол очень устойчив к действию окислителей. Обычные окислители на холоду не действуют на бензольное кольцо. Например, бензол, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. Только при воздействии сильных окислителей (например, кислород воздуха при высокой температуре в присутствии V2O5) происходит разрыв бензольного кольца с образованием малеиновой кислоты:
В то же время гомологи бензола окисляются легко. При этом окислению подвергается не кольцо, а боковая цепь (вместо нее образуется карбоксильная группа), независимо от ее длины:
.
толуол |
бензойная кислота |
При окислении гомологов бензола, содержащих два заместителя, образуются двухосновные кислоты:
17

п-метил- терефталевая изопропилбензол кислота
При нескольких заместителях подбором окислителей можно последовательно окислить более длинную, затем более короткую цепь и наоборот. Эта реакция служит для распознания строения ароматических углеводородов.
На воздухе бензол горит коптящим пламенем:
2C6H6 + 3O2 → 12 C + 6H2O.
При окислении кислородом воздуха алкилбензолов образуются гидроперекиси. В реакции принимает участие углеродный атом в α-положении к бензольному кольцу:
1.6.3 Реакции замещения
Выравненность π-электронной плотности в ароматическом кольце способствует реакциям замещения, а не присоединения. Подвижные π- электроны, экранирующие бензольное кольцо, способны активно взаимодействовать с атакующими электрофильными реагентами. Другими словами, для ароматических углеводородов предпочтительными будут реакции электрофильного замещения (SЕ). В них участвует как само бензольное ядро, так и связанная с ним боковая цепь.
Механизм реакции электрофильного замещения в ароматическом ряду носит в большинстве случаев ионный характер и является трехстадийным.
П е р в о й с т а д и е й электрофильного замещения является образование π-комплекса в результате взаимодействия π-электронной системы бензольного кольца с положительно заряженной частицей Х+:
X + Y X+ + Y-,
π-комплекс
18

При этом атакующая частица связывается со всеми шестью π-электронами кольца.
В т о р а я с т а д и я состоит в переходе π-комплекса в σ-комплекс. Это происходит в результате выделения из системы шести π-электронов двух электронов для образования новой ковалентной связи С—X. Оставшиеся четыре π-электрона распределяются между пятью углеродными атомами бен-
зольного кольца:
[ |
[ |
π-комплекс |
σ-комплекс |
В общем виде σ-комплекс обычно изображают так:
Разорванная окружность в цикле означает прерванное π-сопряжение электронов.
σ-комплекс – промежуточное образование, представляющее собой неустойчивый карбкатион (но более устойчивый, чем π-комплекс), лишенный ароматичности. Шесть его углеродных атомов находятся в различных валентных состояниях: один, с которым связан заместитель X, – насыщенный (в состоянии sр3-гибридизации), а пять других – в обычном для бензола втором валентном состоянии (sp2). Заместитель X и атом водорода при насыщенном углеродном атоме расположены в плоскости, перпендикулярной плоскости бензольного кольца.
Т р е т ь я с т а д и я – быстрое отщепление протона от σ-комплекса:
X |
|
X |
+ H |
быстро |
+ H+ |
|
|
|
σ-комплекс |
замещенный бензол |
|
Освобождающаяся при этом пара электронов (от связи С-Н) восполняет электронный пробел в кольце, и углерод из состояния sp3 переходит в состояние sр2-гибридизации. Отщепившийся протон связывается с анионом Y-:
H+ + Y- → H — Y.
19

По этому механизму протекают все реакции электрофильного замещения в бензольном ядре – галогенирование, нитрование, сульфирование, реакции алкилирования и ацилирования.
В зависимости от условий одни и те же реагенты могут взаимодействовать и с ароматическим ядром, и с боковой цепью. Направление атакующего реагента зависит от условий реакции.
1.7 Реакции электрофильного замещения в ароматическом ряду
В своих типичных реакциях бензольное кольцо служит источником электронов, т.е. основанием. Вещества, с которыми оно реагирует, имеют дефицит электронов и, следовательно, являются электрофильными реагентами или кислотами. Точно так же как типичными реакциями алкенов являются реакции электрофильного присоединения, типичными реакциями бензоль-
ного кольца будут реакции электрофильного замещения [6.2, С.330].
Как известно, для ароматических углеводородов наиболее характерными являются реакции замещения, которые протекают легче, чем у предельных углеводородов. Особенностью этих реакций является то, что после их завершения полностью сохраняется ароматичность исходных веществ (субстрата).
К реакциям электрофильного замещения в ароматическом ряду относятся реакции галогенирования, нитрования, сульфирования и другие, которые рассмотрим подробнее.
1.7.1 Галогенирование
В зависимости от условий проведения реакции галогенирования могут получаться галогенопроизводные с атомом галогена в ядре или боковой цепи:
хлорбензол |
хлористый бензил |
Различают моно-, ди-, три- и полигалогенопроизводные.
Если реакцию проводить на холоду в присутствии катализаторов (FeCl3, FeBr3, AlCl3, SbCl3, SbCl5, I2), то образуются производные с галогеном в ароматическом ядре. Роль катализатора заключается в поляризации молекулы галогена с образованием положительно заряженного иона (галогенирующего агента), который затем атакует бензольное ядро по схеме:
Cl2 + FeCl3 Cl+ + FeCl4-,
в присутствии йода – по схеме
Cl2 + I2 2Cl I; Cl I Cl- + I+; I+ + Cl2 ClI + Cl+.
20
