
Учебное пособие по ароматике
.pdf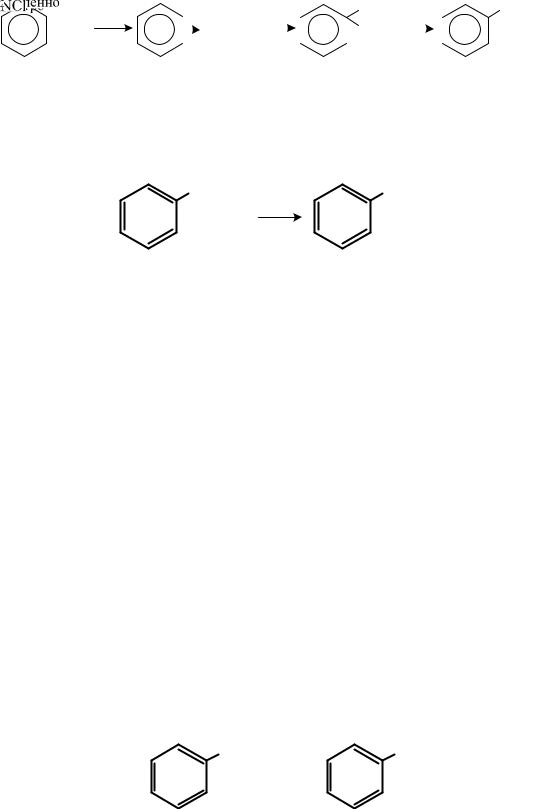
Реакция галогенирования идет по механизму, рассмотренному выше:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π-комплекс |
|
σ-комплекс |
хлорбензол |
|||||||||
H+ + FeCl4- → HCl + FeCl3.
Чтобы ввести атом галогена в боковую цепь, реакцию проводят при нагревании или на свету без катализаторов. Реакция носит радикальный характер:
толуол |
хлористый бензил |
При дальнейшем хлорировании образуется хлористый бензилиден С6Н5СНС12 и бензотрихлорид С6Н5—СС13.
При введении в ядро бензола йода необходимо присутствие окислителей, которые окисляют образующуюся йодистоводородную кислоту и тем препятствуют ее восстанавливающему действию, а возможно окисляют и йод до йодноватистой кислоты, которая, видимо, более энергично действует на бензол.
Реакция йодирования аренов (метод Тронова-Новикова) возможно в присутствии таких окислителей, как H2O2, HNO3, ICl, HIO3 и др. Окислители превращают йод в катион I+, который и является действующим электрофильным реагентом:
I2 + HNO3 + H2SO4 2I+ + HSO4- + NO2+;
C6H6 + I+ C6H6 — I + H+ I —C6H6 — I.
бензол |
йодбензол |
п-дийодбензол |
Особенности физических и химических свойств ароматических галогенопроизводных будут рассмотрены ниже в разделе 2.
1.7.2. Нитрование
Нитрогруппа в ароматических нитросоединениях может быть связана с бензольным ядром или находиться в боковой цепи:
нитробензол фенилнитрометан
21

Различают моно-, ди- и тринитропроизводные ароматических углеводородов.
Ароматические нитросоединения с нитрогруппой в ядре получают нитрованием ароматических углеводородов нитрующей смесью – смесью концентрированных азотной и серной кислот (при температурах, не превышающих 40–50 °С). При взаимодействии этих кислот образуется смесь ионов, из которых нитрующим агентом является ион нитрония NO2+
+ |
+ |
HNO3 + 2H2SO4 NO2 |
+ H3 O + 2HSO4-. |
Ион нитрония атакует бензольное кольцо:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π-комплекс |
|
σ-комплекс |
нитробензол |
||||||||||
|
|
H+ |
+ HSO4- → H2SO4. |
|
|
|
|||||||
Находящаяся в бензольном кольце нитрогруппа уменьшает скорость дальнейшего нитрования. Однако в жестких условиях можно ввести вторую (при 90 °С) и даже третью (при 100–110 °С) нитрогруппы, которые располагаются в м-положениях относительно друг друга:
нитробензол |
1,3 – динитробензол 1,3,5 – тринитробензол |
В то же время толуол нитруется во много раз легче, чем свободный бензол. Это объясняется +I-эффектом метильной группы (создается избыток электронной плотности в кольце):
толуол |
о-толуол |
2,4 – динитротолуол 2,4,6 –тринитротолуол |
|
|
(тротил) |
22
При нитровании гомологов бензола, содержащих два заместителя, сказывается стерический эффект. Если, например, эти заместители находятся в п- положении, нитрогруппа становится рядом с меньшим заместителем:
Нитросоединения с нитрогруппой в боковой цепи получают теми же ме-
тодами, что и нитросоединения алифатического ряда (реакция Коновалова):
Реакция носит радикальный характер.
Одним из способов получения нитросоединений с нитрогруппой в боковой цепи является реакция галогенопроизводных (с галогеном в боковой цепи) с нитритом серебра:
С6H5–CH2Cl + AgNO2 → С6H5 – CH2 – NO2 + AgCl.
хлорфенилметан |
нитрофенилметан |
Обычным способом получения нитрофенилметана является декарбоксилирование α-нитрокислот с карбоксильной и нитрогруппой в боковой цепи:
α-нитрофенилуксусная кислота |
нитрофенилметан |
Особенности физических и химических свойств ароматических нитросоединений будут рассмотрены ниже в п.3.
1.7.3 Сульфирование
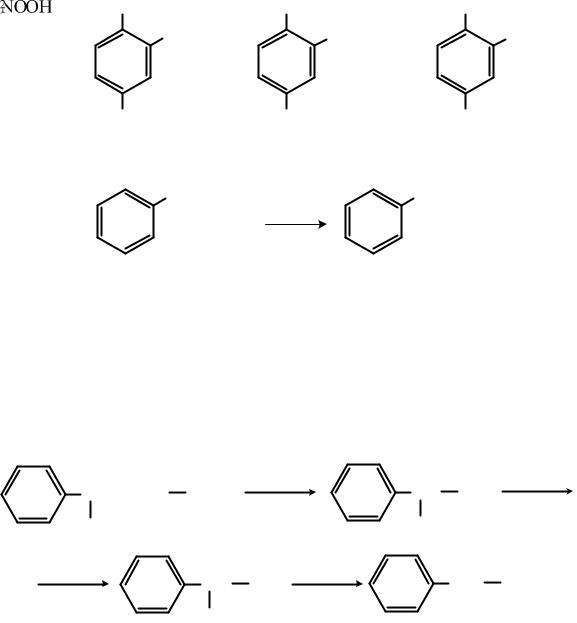
Сульфогруппа в ароматических сульфопроизводных может находиться в бензольном кольце или боковой цепи:
23
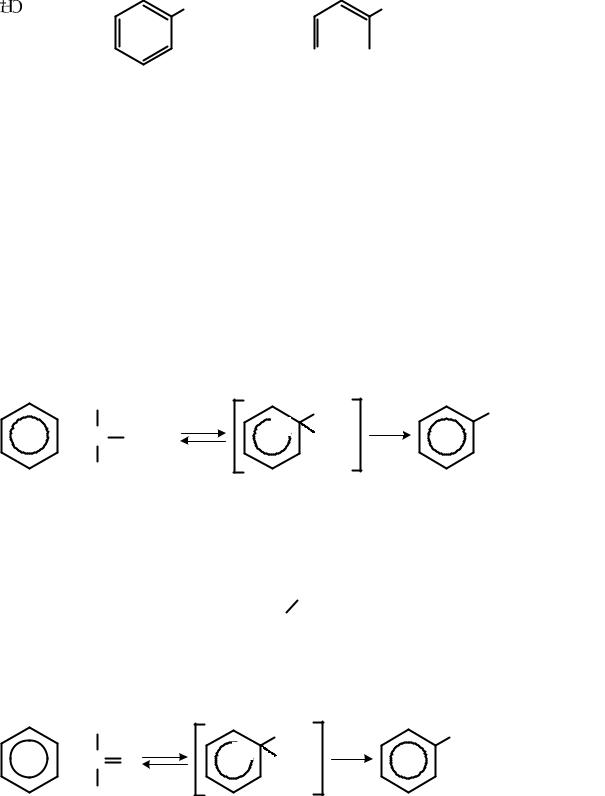
…………….. 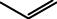
бензолсульфокислота бензилсульфокислота
Вмолекуле ароматического сульфопроизводного может быть одна, две
итри еульфогруппы.
Cульфокислоты получают прямым сульфированием углеводородов или их производных.
Монобензолсульфокислота получается при действии на бензол концентрированной серной кислоты на холоду:
С6H6 + HO– SO2OH С6H5 – SO2OH + H2O.
Сульфирование проходит по обычному механизму электрофильного замещения. Активным электрофильным агентом является, прежде всего, бисульфониевый ион, образующийся в результате протекания реакции
3H2SO4 SO3H+ + H3O+ + 2HSO4-,
Еще более активным электрофильным агентом является оксид серы (VI), в молекуле которого электронная плотность распределена таким образом, что атом серы несет положительный заряд:
2+ O-
O  S
S  O- .
O- .
Являясь сильным электрофилом, атом серы атакует π-электронную систему ароматического кольца:
O- |
|
SO3 |
- |
SO3H |
+ S2+ O |
|
|
||
+ |
H |
|
. |
|
|
|
|
|
|
O- |
σ- комплекс |
|
|
|
|
|
|
||
Триоксид серы более реакционноспособен, чем серная кислота, и может быть использован в стехиометрических количествах. Продукты реакции не содержат избытка серной кислоты.
Гомологи бензола сульфируются в орто- и пара-положение.
24
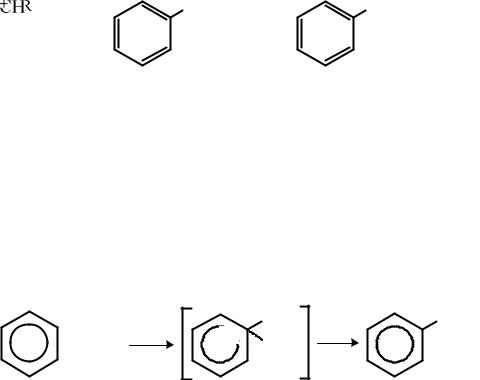
При сульфировании ароматических углеводородов дымящей серной кислотой при нагревании и в присутствии катализаторов (Ag2SO4 и др.) получают ди-и трисульфокислоты. Сульфогруппа при электрофильном замещении ориентирует новый заместитель в мета-положение.
Особенности физических и химических свойств ароматических сульфокислот будут рассмотрены ниже в п.4.
1.7.4 Алкилирование и ацилирование Алкилирование – введение алкильной группы в молекулу органи-
ческого соединения (например, в бензольное кольцо).
Ацилирование – введение в молекулу органического соединения
ацильной группы.
При алкилировании и ацилировании ароматических углеводородов получают соответственно их алкильные и ацильные производные:
алкилбензол ацилбензол
Реакции алкилирования и ацилирования относятся к реакциям электрофильного замещения и называются реакциями Фриделя–Крафтса.
Реакцию алкилирования проводят при действии на вещество галогеналкилов в присутствии катализатора – безводного AlCl3. Роль катализатора заключается в образовании положительно заряженного карбкатиона, который электрофильно атакует бензольное кольцо:
+
CH3Cl + AlCl3 CH3[AlCl4]- ,
σ- комплекс толуол
H+ + AlCl4- → AlCl3+ HCl.
Вместо галогеналкилов в качестве алкилирующих средств применяют также непредельные углеводороды и спирты. В этом случае в качестве катализатора используют минеральные кислоты. Роль последних состоит в превращении алкенов и спиртов в соответствующие карбкатионы:
+
CH2 = CH2 + H+ CH3 — CH2,
+ +
CH3OH + H+ CH3OH2 CH3 + H2O.
25
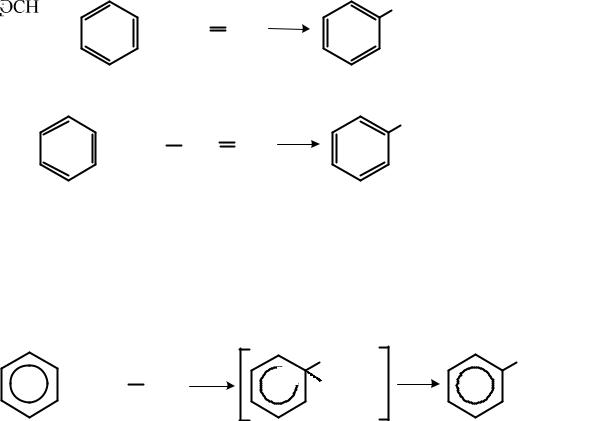
Таким способом получают, например, этилбензол и изопропилбензол (кумол)
этилбензол
кумол
Для ацилирования бензола или его гомологов используют в качестве ацилирующих агентов ангидриды или галогенангидриды кислот и катализатор – безводный А1С13. Образующийся ион ацилия электрофильно взаимодействует с ароматическим углеводородом в соответствии с реакциями:
H3C—COCl + AlCl3 → [H3C —CO]+AlCl4- ,
σ- комплекс ацетилбензол
H+ + AlCl4- → AlCl3+ HCl.
1.8 Эффекты заместителей при электрофильном замещении
В незамещенной молекуле бензола π-электронная плотность равномерно распределена между всеми углеродными атомами. В этом случае уместна такая аналогия: незамещенный бензол можно сравнить с аэродромным полем, все взлетные дорожки которого с одинаковой готовностью могут принять приземляющийся самолет (в данном случае – заместитель). Но если в бензольное кольцо ввести хотя бы один заместитель, то равномерность распределения π-электронной плотности нарушается. В результате этого бензольное кольцо становится частично поляризованным и место вхождения второго заместителя будет зависеть от характера первого заместителя.
На основании большого экспериментального материала выведены особые правила ориентации, в основу которых положены теоретические представления о перераспределении π-электронной плотности в бензольном кольце под влиянием заместителей.
1.8.1. Ориентирующее влияние заместителей
26
Реакционная способность того или иного атома углерода в бензольном кольце определяется следующими факторами: 1) положением и природой уже имеющихся заместителей; 2) природой действующего агента; 3) условиями проведения реакции. Решающее влияние имеют два первых фактора.
Заместители, уже имеющиеся в бензольном кольце, по своему ориентирующему действию на вновь входящие заместители делятся на две группы: заместители первого рода и заместители второго рода.
Заместители (ориентанты) первого рода – это группировки атомов, способные отдавать электроны. К ним относятся – R, – ОН, – OR, – OCOR,
–SH, – SR, – NH2, – NHR, – NHCOR, –N=N–, – CH3, – CH2R, – CR3, – Hal (F, Cl, Br, I). Эти заместители смещают электронную плотность в сторону бензоль-
ного кольца, т.е. обладают электродонорными свойствами. Они активируют бензольное кольцо (за исключением галогенов). Облегчая вхождение электрофильных реагентов в бензольное кольцо, они ориентируют новый заместитель в орто- и пара-положения. Такие заместители называют орто- и па-
ра-ориентантами.
При действии нуклеофильных реагентов реакция замещения протекает
сбольшим трудом (при этом реагент должен быть ориентирован в мета- положение).
Заместители (ориентанты) второго рода – это атомные группировки, способные оттягивать (принимать) электроны от бензольного ядра.
К ним относятся – SO3H, – NO2, – СНО, – COR, – СООН, – COOR, – CN, – CCl3, – NH3+, – NR+3 и т.д. Эти заместители смещают электронную плотность от бензольного кольца, т.е. они обладают электроноакцепторными свойствами. Эти заместители дезактивируют бензольное кольцо, затрудняя вхождение электрофильных реагентов. При этом вновь входящий заместитель ориентируют в мета–положение. Такие заместители называют мета– ориентантами. В то же время заместители второго рода облегчают реакции
снуклеофильными реагентами, способствуя в этом случае орто- и пара – ориентации.
Таким образом, замещение атомов водорода в молекуле бензола происходит с учетом природы заместителя, уже находящегося в ядре (если заместителей несколько, то играет роль и их взаимное расположение), и атакующего реагента.
Различное ориентирующее действие заместителей первого и второго рода связано с проявлением двух эффектов – индуктивного (I) и эффекта со- пряжения (С). Например, в молекуле метоксибензола (анизола) метоксигруппа, обладая электронодонорными свойствами (заместитель I рода), смещает электронную плотность в сторону кольца:
27

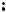 OCH3
OCH3
δ− |
δ− |
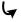 δ−
δ−
Это происходит в результате сопряжения неподеленной пары электронов атома кислорода с делокализованными π-электронами бензольного кольца. При этом два эффекта (+I и +С) действуют в одном направлении – в сторону ядра. Это приводит к тому, что преимущественно в орто- и пара- положениях бензольного кольца повышается электронная плотность. Эти положения и будут в первую очередь атакованы электрофильными реагентами.
Здесь происходит увеличение реакционной способности бензольного кольца по отношению к электрофильным реагентам.
При введении в бензольное кольцо заместителей II рода (например, нитрогруппы – NO2) электронная плотность смещается в обратном направлении – в сторону заместителя. В этом случае два эффекта (–I и –С) также направлены в одну, но обратную сторону:
O O

 N
N
δ+  δ+
δ+
 δ+
δ+
Врезультате электронная плотность в бензольном кольце уменьшается
иособенно в орто- и пара-положениях. На этот раз электрофильные реагенты будут стремиться предпочтительно в мета–положение.
Вэтом случае увеличивается реакционная способность по отношению к нуклеофильным реагентам.
Часто направление заместителей в бензольное кольцо связывают с
устойчивостью образующегося при этом σ–комплекса.
Если в бензольном кольце имеются два (и более) заместителя, то их ориентация может быть согласованной и несогласованной.
Согласованной считается ориентация, когда имеющиеся в бензольном кольце заместители направляют третий заместитель в одно и то же положение.
Согласованная ориентация наблюдается в том случае, если два заместителя одного рода находятся в мета–положении друг к другу (или разного рода – в орто- или пара–положениях). Например:
28
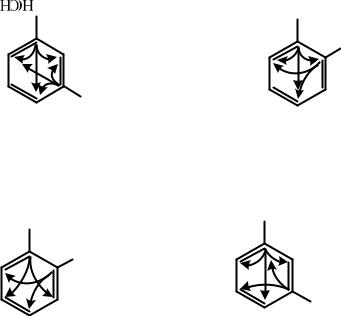
CH3
NO2
Если же два заместителя одного рода находятся в орто- или пара- положении друг к другу (или разного рода – в мета-положении), то происходит несогласованная ориентация:
CH3
NO2
В таких случаях несогласованной ориентации ориентирующие влияния конкурируют между собой, и в результате может образоваться много различных изомеров.
Таким образом, несогласованная ориентация проявляется, когда один из заместителей направляет новые группы в иные положения, чем второй заместитель.
При несогласованной ориентации необходимо учитывать силу ориентирующего действия заместителей, приведенных в таблице 1.
Таблица 1 - Влияние заместителей, находящихся в ядре, на электрофильное замещение
Активирующие заместители |
Дезактивирующие заместители |
(о- и п-ориентанты) |
(м-ориентанты) |
– NH2, – NHR, – NHR2, |
– NH3+, |
– OH, |
– NO2, |
– OR (– OCH3, – OC2H5 и т.д.), |
– N(CH3)3+, |
– SH, |
– CN, |
– SR, |
– COOH (– COOR), |
– NHCOR (–NHCOCH3), |
– SO3H, |
– Арил (– C6H5), |
– CHal3, |
– Алкил (– CH3, – C2H5 и т.д.), |
– CHO (– COR), |
– Галогены* |
– SO2OR |
* Дезактивирующие |
|
Чем выше находится заместитель в колонке таблицы, тем более сильными активирующими (дезактивирующими) свойствами он обладает.
Бейльштейн установил, что при наличии нескольких заместителей преобладающее направляющее действие оказывает тот из них, который обладает
29
наибольшим активирующим эффектом. Например, если в молекуле бензола имеются заместители I и II рода, то ориентацию определяет в основном заместитель I рода.
1.8.2. Влияние заместителей на реакционную способность
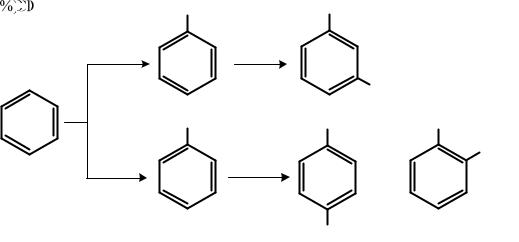
Следует отметить, что разделение заместителей на два рода является несколько условным, потому что мы знаем очень мало реакций, при которых образовывались бы только орто-, пара- или мета- замещенные продукты. В большинстве случаев приходится наблюдать образование всех трех изомеров, а "ориентирующее влияние" заместителя, уже находящегося в бензольном ядре, сказывается, главным образом, в том, какой из этих изомеров будет преобладать. Например, при нитровании толуола получают 58 % орто-нитротолуола, 38 % пара-нитро-толуола и 4 % лета-нитротолуола. Нитрование бензойной кислоты дает 80 % мета-нитробензойной кислоты, 27 % орто-нитробензойной кислоты и 1 % пара-нитробензойной кислоты. В то же время, согласно «ориентирующему влиянию», ожидалось в первом случае получение только орто- и пара-замещенных продуктов, а во втором – только мета-продуктов. Однако при синтезе различных замещенных бензола все же необходимо принимать во внимание ориентирующее влияние заместителей, уже находящихся в кольце. Например, хлорирование нитробензола дает мета-хлорнитробензол, тогда как нитрование хлорбензола – смесь орто- и пара-хлорнитробензолов. Следовательно, если исходить из бензола, то для получения мета-изомера нитрование должно предшествовать хлорированию, а для получения орто- и пара- изомеров, наоборот, оно должно следовать за хлорированием:
Если в бензольном кольце содержатся два заместителя, то по отношению к третьему (вступающему в кольцо) заместителю они проявляют себя следующим образом:
1) если в бензольном кольце содержатся два заместителя 1-го рода, то вступление третьего заместителя контролирует тот, который обладает более сильными активирующими свойствами (см. таблицу 1);
30
