
- •1.Структурные уровни организации материи
- •1.1.Квантовомеханическое описание микромира
- •1.1.1. Квантово-механическая концепция
- •1.1.2. Атомно - молекулярное учение.
- •1.1.3.Химическая связь
- •1.2.Cостав и строение твердых тел
- •1.2.1.Кристаллические и аморфные тела
- •1.2.2.Кристаллическая решетка
- •1.2.3.Анизотропия кристаллов
- •1.2.4.Классификация кристаллов по типам сил связи
- •Атомные кристаллы
- •Металлические кристаллы
- •Молекулярные кристаллы
- •1.2.5.. Дефекты кристаллов
- •1.3.Космологические модели Вселенной
- •1.3.1.Теория стационарного состояния Вселенной
- •1.3..3. Происхождение и эволюция Вселенной
- •1.3.4.Начало и конец времени существования Вселенной?
- •1.3.6.Структура Вселенной
- •1.4. Вопросы для самоконтроля
- •1.5. Литература
Металлические кристаллы
В узлах пространственной решетки металлических кристаллов размещаются одинаковые частицы . Можно предположить, что между этими одинаковыми частицами — ионами металла — не могут возникнуть силы взаимодействия, обеспечивающие ионную связь. Нельзя также объяснить образование металлического состояния с точки зрения ковалентной связи, при которой атом связан с каждым из своих соседей общей парой валентных электронов с антипараллельными спинами. Для установления таких связей у металлов недостает валентных электронов. Наиболее типичными металлами являются элементы первых трех групп периодической системы элементов, за счет своих валентных электронов они могли бы установитьковалентнуюсвязь с одним —тремя соседними атомами, тогда как в подавляющем большинстве металлических кристаллов координационное число равно 8—12.
Какие же силы действуют в металлическом кристалле ?
В металле валентные электроны получают возможность переходить от одного атома к другому и могут довольно свободно перемещаться по всему объему металла. Таким образом, валентные электроны в металле нельзя считать связанными с одним или несколькими ионами металла, они являются общими для всего объема металла. Поэтому валентные электроны в металлах принято называть «обобществленными» или «коллективизированными». Мгновенный снимок кристалла металла покажет структуру в которой в узлах решетки присутствуют атомы, ионы, а в междуузлиях – электроны. Совокупность свободных валентных электронов внутри металлического кристалла называется: электронное облако, илиэлектронный газ.Электронное облако является общим для всего кристалла, оно обладает «цементирующим» действием, связывая в прочную систему положительно заряженные ионы металла (без наличия
«цементирующего» действия электронного газа одноименно заряженные ионы металла должны были бы удалиться друг от друга под действием кулоновскихсил отталкивания)..
Под влиянием двух противоположных сил — «стягивающего» действия «коллективизированных» электронов и сил отталкивания между ионами — последние располагаются на некотором равновесном расстоянии друг от друга, -соответствующем минимуму потенциальной энергии системы.
Если исходить из модели плотной упаковки шаров, то можно определить атомный радиус элемента (как половину расстояния между соседними атомами). Атомный радиус металла значительно больше его ионного радиуса в каком-либо соединении. Например, радиус иона натрия в кристаллах поваренной соли равен 0,98 А, а его атомный радиус в кристалле металлического натрия — 1.,89 А. Это говорит о том,,что одноименно заряженные ионы металла в металлическом кристалле не могут сближаться так же тесно, как разноименные ионы в ионных соединениях.
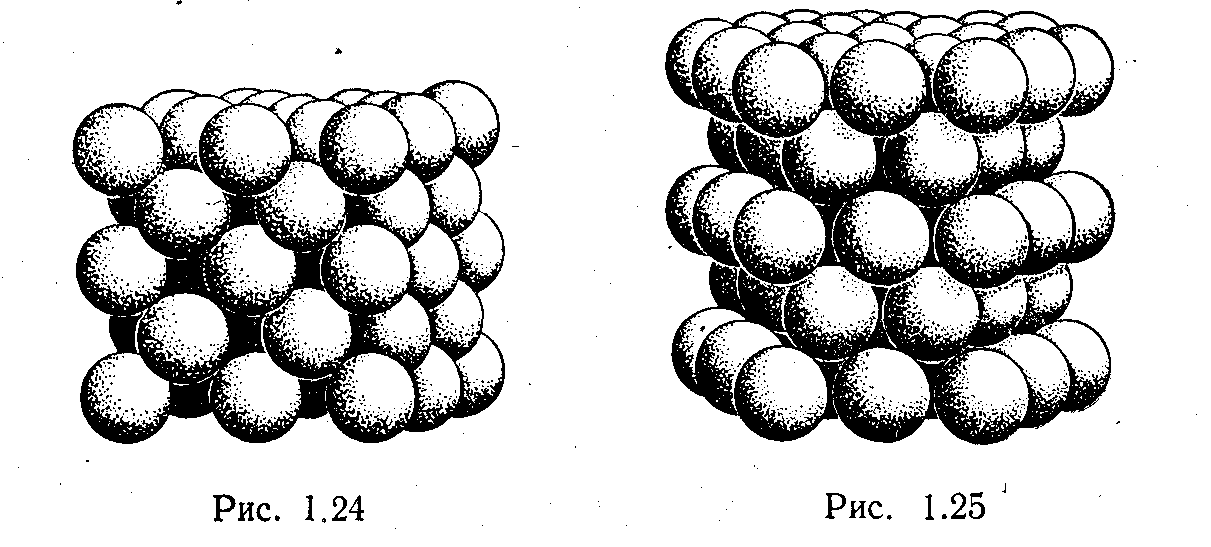
Если предположить, что ионы металла имеют сферическую форму, то можно полагать, что структура таких кристаллов должна соответствовать плотной упаковке шаров одинакового размера. Возможны два.способа плотной упаковки шаров, показанные на рис. 1.24 и 1.25: на первом изображена кубическая упаковка — гранецентрированныи куб, на втором — плотная гексагональная упаковка. Последняя структура представляет собою две гексагональные решетки Браве, вдвинутые одна в другую. Элементарная ячейка такой решетки показана на рис. 1.26. Для шаров, упакованных в плотную гексагональную структуру, соотношение параметровс/а(рис. 1.26) равно 1,6333. Все металлы с плотной гексагональной структурой имеют отношениес/алибо меньше, либо больше этой величины. Это говорит о том, что ионы металлов не имеют сферической формы
Ближе всего к идеальной плотноупакованнойгексагональной решетке подходит решетка магния, для которойс/а =1,6235.
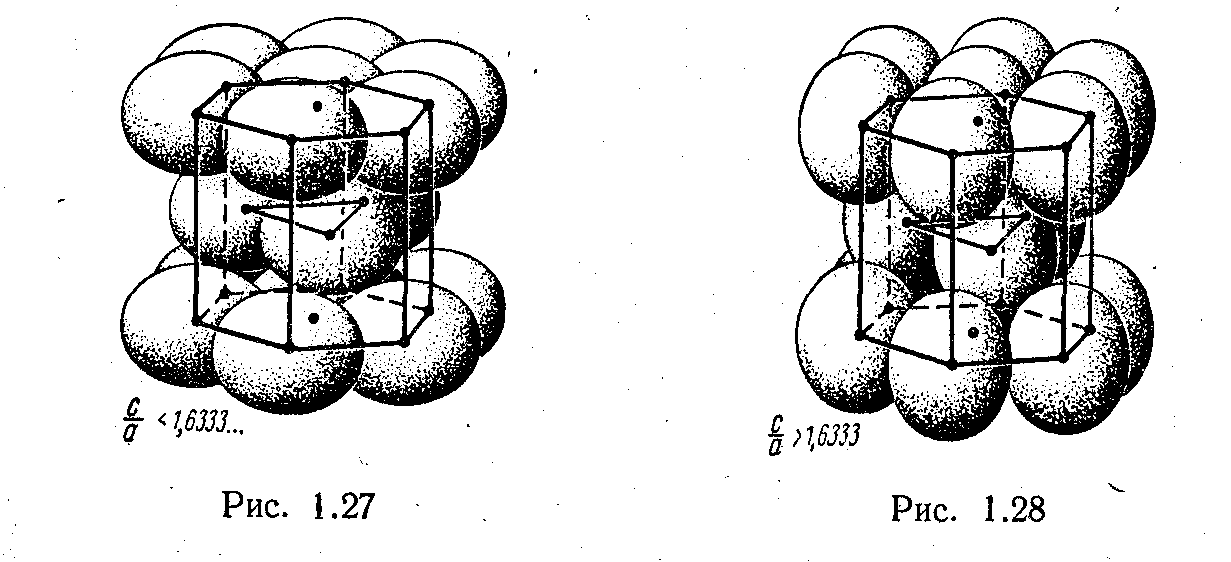
Большинство чистых металлов имеет структуру описанных наиболее плотных упаковок (К,=12), либо ближайшую к ней по плотности —объемноцентрированныйкуб(К,==8). .На рис. 1.27 и рис. 1.28 изображены оба эти варианта прис/а •<1,6333 и прис/а>1,6333.
. Наличие высокой концентрации свободных (коллективизированных) электронов обусловливает хорошую электропроводность и теплопроводность металлов.
