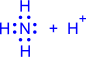- •1.Структурные уровни организации материи
- •1.1.Квантовомеханическое описание микромира
- •1.1.1. Квантово-механическая концепция
- •1.1.2. Атомно - молекулярное учение.
- •1.1.3.Химическая связь
- •1.2.Cостав и строение твердых тел
- •1.2.1.Кристаллические и аморфные тела
- •1.2.2.Кристаллическая решетка
- •1.2.3.Анизотропия кристаллов
- •1.2.4.Классификация кристаллов по типам сил связи
- •Атомные кристаллы
- •Металлические кристаллы
- •Молекулярные кристаллы
- •1.2.5.. Дефекты кристаллов
- •1.3.Космологические модели Вселенной
- •1.3.1.Теория стационарного состояния Вселенной
- •1.3..3. Происхождение и эволюция Вселенной
- •1.3.4.Начало и конец времени существования Вселенной?
- •1.3.6.Структура Вселенной
- •1.4. Вопросы для самоконтроля
- •1.5. Литература
1.1.3.Химическая связь
Как правило, химическая связь образуется между двумя атомами за счет двух электронов. Если на образование связи каждый атом дает о одному электрону, то связь называется ковалентной.
Ковалентная связь
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
|
H•+•HH:H |
|
|
® |
|
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
|
|
® |
|
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратныхсвязях:
|
|
® |
|
(или NºN) – тройная связь |
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность- это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.
1.2.Cостав и строение твердых тел
1.2.1.Кристаллические и аморфные тела
Всякое жидкое вещество при охлаждении теряет свойство текучести и переходит в твердое состояние. Процесс перехода из жидкого состояния в твердое для разных веществ не различен. Известны два различных вида затвердевания.
1. Кристаллизация вещества. В этом случае в жидкости, охлажденной до определенной температуры, появляются мельчайшие кристаллики (области упорядочениерасположенных и прочно связанных между собою частиц ( молекул, атомов или ионов — центры кристаллизации, которые при дальнейшем отводе тепла от вещества разрастаются за счет присоединения к ним частиц из жидкой фазы и охватывают весь объем вещества.
2. Затвердевание вследствие сравнительно быстрого повышения вязкостижидкости с понижением температуры. Известны две разновидности этого процесса затвердевания. У некоторых веществ (сургуч, воск, смола) кристаллизация совсем не наблюдается: они называютсяаморфнымителами. Другие вещества, например стекло, способны кристаллизоваться, но вязкость у них быстро возрастает с понижением температуры. Последнее затрудняет перемещение молекул, необходимое для формирования и роста кристаллов и, таким образом, вещество успевает затвердевать до наступления' кристаллизации. Такие вещества.называютсястеклообразными. Процесс кристаллизации этих веществ очень медленно протекает в твердом состоянии, причем легче при более высокой температуре; Известно, например, явление«зарухания»или«расстекловывания»,стекла. Оно обусловлено образованием внутри стекла мелких кристалликов, на границах которых происходит отражение и рассеяние света, вследствие чего стекло теряет прозрачность. Аналогичная картина наблюдается при «засахаривании» прозрачного сахарного «леденца».
Иногда одно и то же вещество может затвердеть как в кристаллической,так и ваморфно-стеклообразнойформе (стеклообразные тела тоже относятся к разряду аморфных тел, так как внутри них нет кристалликов). Например, если расплавленную серу медленно охлаждать, То она затвердевает в кристаллической форме, если же ее после нагревания до 350° С охлаждать, вылив в холодную воду, то сера затвердевает в аморфной пластической форме. Аморфная сера резко отличается по физическим свойствам от кристаллической. Она не обладает хрупкостью последней, а, наоборот, легко деформируется при небольшом давлении, аналогично мягкой глине или пластилину. Подобно стеклу, аморфная (стеклообразная) сера самопроизвольно медленно превращается в кристаллическую. Это говорит о,том, что кристаллическая форма твердого тела более устойчива, чем аморфная.
Аморфные тела можно рассматривать как жидкости с очень высоким коэффициентом вязкости. Оказывается, что у аморфных тел можно наблюдать слабо выраженное свойство текучести. Если, например, наполнить воронку кусками воска или сургуча, то через некоторое время (разное для разных температур) куски аморфного тела будут постепенно расплываться, принимать форму воронки и «вытекать» из нее в виде стержня. Даже у стекла обнаружено свойство текучести. Измерения толщины оконных стекол в старых зданиях показали, что за несколько веков стекло успело стечь сверху вниз, так что нижняя часть стекла оказалась немного толще, чем верхняя.
Поэтому, строго говоря, твердыми телами следует называть только кристаллические тела. Аморфные же тела по некоторым свойствам и главным образом построениюближе подходят к жидкости: их можно рассматривать как сильно переохлажденные жидкости, обладающие оченьвысокой вязкостью.
В чем же основное различие между кристаллическими и аморфными телами?
1. С энергетической стороны: кристаллические тела имеют точку плавления, при которой вещество находится в устойчивом состоянии в обеих фазах — в твердой и в жидкой, аморфные же тела постепенно размягчаясь при нагревании, не имеют определенной температуры, соответствующей переходу твердой фазы в жидкую.
Графически это изображено на рис. 1.1. Участок ВСграфика соответствует процессу плавления кристаллического тела. Количество тепла, получаемого нагреваемыми телами от нагревателя за единицу времени, можно приблизительно считать постоянным. Однако на участкеВСтемпература тела не изменяется, хотя тепло от нагревателя к нему по-прежнему подводится. Теплота расходуется на процесс плавления.
.

Обратный процесс — кристаллизация — может происходить только в случае, если отсистемы жидкая фаза — кристалл отводится энергия, так как при кристаллизации выделяется такое же количество тепла, какое было поглощено при плавлении данного кристаллического тела.
-На графике для аморфных тел нет горизонтального участка, а наблюдается лишь точка перегибаЕ.Температуру, соответствующую этой точке, условно называют
температурой размягчения аморфного тела. Вообще же у аморфных тел при повышении температуры размягчение происходит постепенно до состояния очень вязкой жидкости. При дальнейшем повышении температуры вязкость жидкости уменьшается. Удельная теплота плавления у аморфных тел отсутствует; подвод тепла
Ошибочным является представление, что переход вещества из жидкого состояния в твердое означает сближение молекул, которое сопровождается увеличением сил сцепления между ними, а это и создает «твердость»вещества. Дело в том, что некоторые вещества (вода, висмут, сурьма) при кристаллизации увеличиваются в объеме, следовательно, средние расстояния между соседними молекулами у этих веществ будут в твердой фазе больше, чем в жидкой, хотя, безусловно, в твердой фазе молекулы будут прочнее связаны между собой.
2. Существует явление переохлаждениянекоторых жидкостей. Проведем эксперимент. Если взять небольшое количество кристаллического гипосульфита натрия Na2S2O7.5H2O,применяемого в фотографии в качестве закрепителя (далее будем называть эту соль просто гипосульфит), насыпать его в имеющийся под рукой сосуд и расплавить в водяной бане (температура плавления 48° С), то после этого можно медленно охладить расплавленный гипосульфит до комнатной температуры. Проще всего для этого оставить его при комнатной температуре,-не встряхивая и не перемешивая. Через некоторое время гипосульфит, оставаясь жидким, охладится до комнатной температуры, которая примерно на 30° ниже точки плавления. Кристаллизация не произошла, так как внутри жидкойфазы не былоцентров кристаллизации,не было той основы порядка, которая свойственна кристаллам гипосульфита. Если же в переохлажденный гипосульфит опустить затравку в виде маленького кристаллика гипосульфита (он будет являться центром кристаллизации), то кристаллик очень быстро начинает разрастаться, и скоро закристаллизуется весь объем переохлажденной жидкости. Правда, полная кристаллизация всего гипосульфита возможна только при сильном переохлаждении (осторожно можно охладить жидкий гипосульфит ниже нуля). Дело в том, что, как пояснялось ранее, кристаллизация сопровождается выделением тепла, которое вызывает нагревание всего объема гипосульфита до точки плавления (это легко обнаружить на ощупь), поэтому закристаллизоваться сразу может только такое количествовещества, при кристаллизации которого выделяется тепло, достаточное для нагревания всей-массы гипосульфита от первоначальной (комнатной) температуры до температуры плавления (48° С). Дальнейшая кристаллизация оставшейся жидкой фазы будет происходить по мере отвода тепла кристаллизации в окружающую среду.
Центрами кристаллизации иногда являются пылинки и -другие посторонние включения или стенки сосуда. сним. Нобывает и так, что кристаллизация начинается уже при легком встряхивании переохлажденной жидкости без внесения затравки.
У аморфных тел состояние переохлаждения не наблюдается. Это значит, что нельзя, охладив аморфное тело значительно ниже температуры размягчения, сохранить у него достаточно низкую вязкость, соответствующую жидкому состоянию.
Таким образом, с энергетической стороны имеет место принципиальное различие между кристаллическими и аморфными телами, заключающееся в том, что процесс плавления и затвердевания кристаллических тел сопровождается определенным тепловым эффектом. У аморфных же тел этого теплового эффекта нет.
3.. Одной из основных особенностей кристаллических тел является иханизотропия.Поскольку анизотропия физических свойств кристаллов" обусловлена особенностями их строения, рассмотрим сначала вопросы структуры кристаллов.