
- •1.Структурные уровни организации материи
- •1.1.Квантовомеханическое описание микромира
- •1.1.1. Квантово-механическая концепция
- •1.1.2. Атомно - молекулярное учение.
- •1.1.3.Химическая связь
- •1.2.Cостав и строение твердых тел
- •1.2.1.Кристаллические и аморфные тела
- •1.2.2.Кристаллическая решетка
- •1.2.3.Анизотропия кристаллов
- •1.2.4.Классификация кристаллов по типам сил связи
- •Атомные кристаллы
- •Металлические кристаллы
- •Молекулярные кристаллы
- •1.2.5.. Дефекты кристаллов
- •1.3.Космологические модели Вселенной
- •1.3.1.Теория стационарного состояния Вселенной
- •1.3..3. Происхождение и эволюция Вселенной
- •1.3.4.Начало и конец времени существования Вселенной?
- •1.3.6.Структура Вселенной
- •1.4. Вопросы для самоконтроля
- •1.5. Литература
Атомные кристаллы
В узлах кристаллической решетки атомных кристаллов находятся атомы того или другого вещества. Атомные или гомеополярныерешетки образуются при наличии так называемойковалентнойсвязи. В атомных кристаллах атомы, находящиеся в узлах кристаллической решетки, связаны со своими ближайшими соседямиковалентнойсвязью. Этот тип связи характеризуется ярко выраженной направленностью
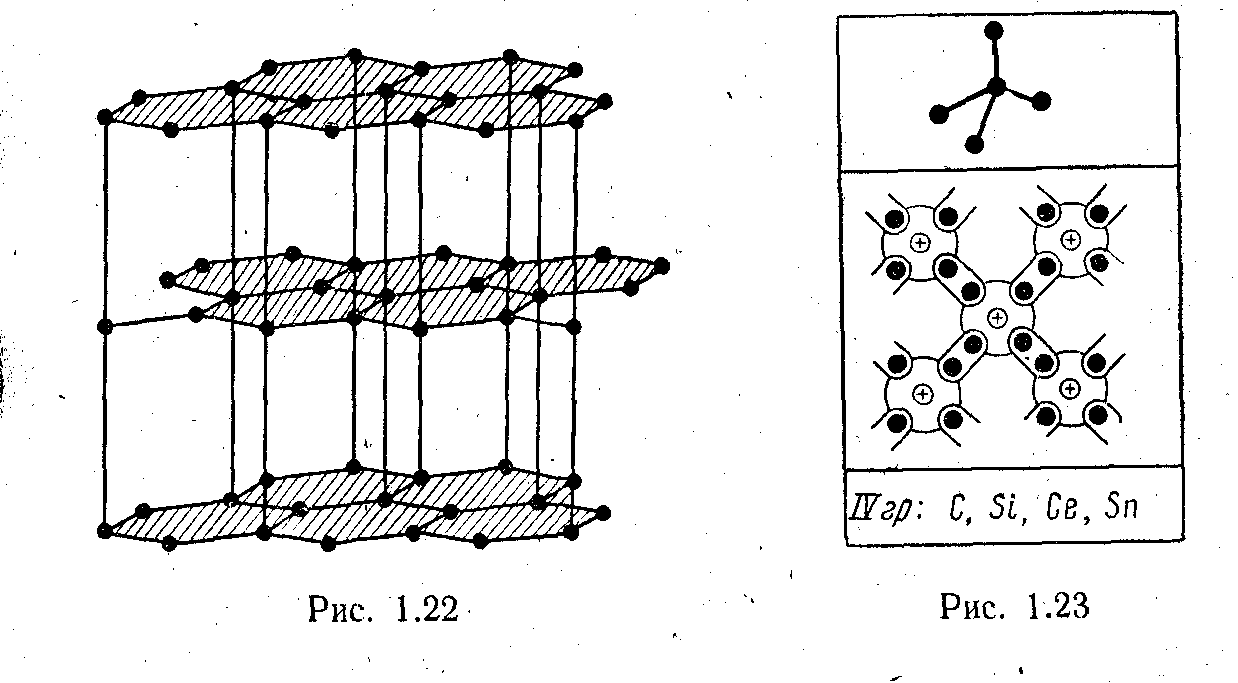
На рис. 1.21, аи 1.22 показаны две атомные решетки углерода:напервом — решетка алмаза на втором — решетка графита
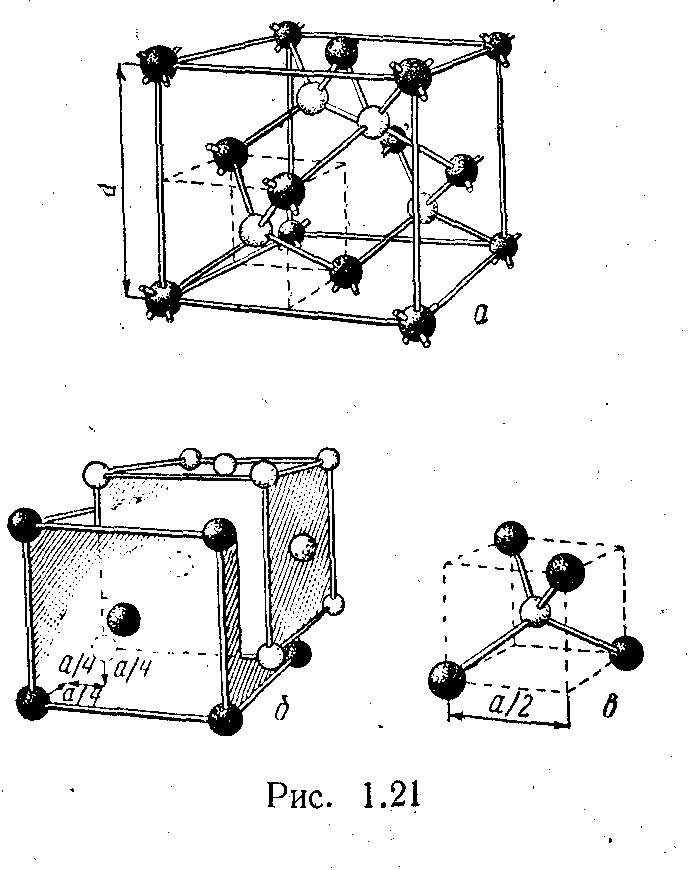
Решетку алмаза можно рассматривать как наложение двух кубических гранецентрированных решеток Браве, сдвинутых друг относительно друга в направлении объемной диагонали на четверть ее длины (рис. 1.21, б). Постоянная решетка алмаза аравна 3,56 А, а расстояние между соседними атомами, связанными ковалентной связью, составляет 1,54 А. Элементарная ячейка решетки показана на рис. 1.21,в.
Структура графита (рис. 1.22) является типичным примером слоистой решетки. Слои образованы рядом параллельных плоских сеток, состоящих из атомов углерода, расположенных в вершинах правильных шестиугольников с длиной стороны, равной 1,42 А. Внутри слоя атомы углерода связаны ковалентной связью. Расстояние между слоями в 2,36 раза больше, чем расстояние между соседними атомами внутри слоя, и равно 3,35 А. По-видимому, соседние слои связаны слабыми вандерваальсовыми силами (см. «Молекулярные кристаллы»). Этим объясняется чрезвычайно легкое скольжение графита в плоскостях, параллельных слоям.
Наличие различных видов связей в решетке графита ведет к поразительному сочетанию его свойств — он обладает очень низкой твердостью (за счет скольжения вплоскостях, параллельных слоям с ковалентной связью) и весьма высокой температурой плавления — около 4000° С.
Алмаз и графит являются двумя различными кристаллическими формами одного и того же химического элемента •— углерода. Оба эти кристалла «смонтированы» из одних и тех же «кирпичей» — атомов углерода. Но структура этих кристаллов различна, поэтому и физические свойства алмаза и графита резко различны: алмаз является самым твердым материалом (твердость по шкалеМооса—10), графит же настолько мягок, что им можно писать на бумаге; алмаз прозрачен, а графит черный; плотность графита —2,1е/см3, а алмаза —3,5г/см1', алмаз —хороший диэлектрик, а графит проводит электрический ток.
Сопоставление физических свойств алмаза и графита показывает, насколько велика роль структуры кристалла в определении его свойств.
Способность одного и<того же вещества кристаллизоваться в различных кристаллических структурах, как это показано на примере алмаза и графита, называетсяполиморфизмом
. Атомные кристаллы характеризуются высокой температурой плавления, большой твердостью и малой летучестью.
