
Лабораторная Диагностика / учебное пособие по лаб д / Руководство по лаб. методам диагностики A.A.Кишкун
.pdf
582 ■ Глава 9
лечения трофобластических и герминогенных опухолей (см. «Исследование онкомаркёров» в главе 7).
Концентрация β-ХГ в крови и его выделение с мочой повышаются уже на 8-й день после оплодотворения. В повседневной практике рекомендуется оценивать динамику изменения концентрации β-ХГ. На начальных этапах физиологической беременности концентрация β-ХГ в плазме крови возрастает в 2 раза каждые 1,98 дня; повышение уровня ХГ менее чем на 66% за 48 ч в 85% наблюдений свидетельствует в пользу эктопической беременности или самопроизвольного выкидыша. Повышенная концентрация β-ХГ в крови при отсутствии ультразвуковых признаков беременности (как в матке, так и вне её) служат показанием к диагностической лапароскопии. Вместе с тем следует иметь в виду, что при прервавшейся трубной беременности концентрация β-ХГ в крови быстро приходит к норме. Более чем у 95% женщин с эктопической беременностью результат определения β-ХГ положительный. Только у очень небольшой части женщин с внематочной беременностью при скрининговом обследовании результат теста отрицателен, хотя при количественном анализе у них всё-таки выявляют повышение концентрации β-ХГ.
Трудности в постановке диагноза возникают в тех случаях, когда данные объективного обследования не позволяют установить наличие беременности, а при ультразвуковом исследовании невозможно точно определить локализацию беременности. В таких случаях необходимо определить количественную концентрацию β-ХГ в сыворотке крови. Если уровень β-ХГ достигает 5000−6000 МЕд/мл, то при ультразвуковом исследовании малого таза необходимо искать внутриматочную беременность. В большинстве случаев у женщин с внематочной беременностью концентрация β-ХГ
всыворотке крови не превышает 3000 МЕд/мл. Высокое содержание β-ХГ
вкрови или моче с большой вероятностью указывает на маточную беременность.
Основные заболевания и состояния, при которых может изменяться концентрация β-ХГ в сыворотке крови, представлены в табл. 9-32.
Таблица 9-32. Заболевания и состояния, при которых изменяется концентрация β-ХГ в сыворотке крови
Увеличение концентрации |
Снижение концентрации |
|
|
Беременность |
Снижение концентрации отно- |
Мониторинг герминогенных опухолей (хо- |
сительно фазы беременности |
рионэпителиома) |
свидетельствует о: |
Пузырный занос |
внематочной беременности; |
Пороки развития нервного канала плода, |
повреждении плаценты во время |
синдром Дауна у плода |
беременности; |
Трофобластическая опухоль |
угрожающем выкидыше |
Тератома яичка |
|
Многоплодная беременность |
|
Менопауза |
|
Эндокринные нарушения |
|
Семинома |
|

Гормональные исследования ■ 583
НЕСВЯЗАННЫЙ (СВОБОДНЫЙ) ЭСТРИОЛ В СЫВОРОТКЕ КРОВИ
Эстриол — основной эстроген, синтезируемый плацентой в период беременности. Несвязанный эстриол проходит через плаценту и попадает в кровяное русло беременной, где он быстро превращается в глюкуронидные и сульфатные производные, что облегчает процесс его экскреции. Время полужизни эстриола в крови беременной составляет всего 20−30 мин. В связи с этим его определение — удобный и быстрый способ оценки текущего состояния плода. Концентрация эстриола в крови постоянно растёт на протяжении беременности и особенно быстро в её последнюю треть (28−40 нед). Содержание свободного эстриола в сыворотке крови на различных сроках беременности в норме представлено в табл. 9-33.
Таблица 9-33. Концентрация свободного эстриола в сыворотке крови беременных
Срок беременности, нед |
Эстриол, нг/мл |
|
|
28−30 |
3,2−12 |
30−32 |
3,6−14 |
32−34 |
4,6−17 |
34−36 |
5,1−22 |
36−38 |
7,2−29 |
38−40 |
7,8−37 |
Внезапное снижение продукции эстриола приводит к быстрому падению концентрации его несвязанной фракции в сыворотке крови. Определение несвязанного эстриола имеет ряд преимуществ перед определением его общей фракции в сыворотке или моче, поскольку она не зависит от наличия заболеваний почек или печени и от применения различных антибиотиков. Концентрация несвязанного эстриола более точно отражает вероятный исход беременности у больных сахарным диабетом.
Концентрацию эстриола в жидкостях организма обычно измеряют с целью определения состояния плода, в частности у беременных с высокой степенью риска преждевременных родов или гибели плода. В связи с тем, что диапазоны нормальной концентрации несвязанного эстриола в сыворотке крови очень широки, однократного исследования недостаточно. Необходимо постоянно следить за данным показателем, чтобы установить тенденцию его изменений в каждом конкретном случае. Постоянно пониженная концентрация или её внезапное и продолжительное снижение в течение последней трети беременности обычно свидетельствует о патологии плода (в том числе о его внутриутробной гибели).
Основные состояния, при которых изменяется концентрация свободного эстриола в сыворотке крови, приведены в табл. 9-34.
Таблица 9-34. Заболевания и состояния, при которых изменяется концентрация свободного эстриола в сыворотке крови
Увеличение концентрации |
Снижение концентрации |
|
|
Резкое увеличение при вероятно- |
При патологии беременности (выражен- |
сти преждевременных родов |
ные пороки развития ЦНС у плода, |

584 ■ Глава 9
Окончание табл. 9-34
врождённые пороки сердца, синдром Дауна, задержка роста плода, резус-конф- ликт, анемия плода, пиелонефрит, недостаточность питания, гемоглобинопатии, гипоплазия надпочечников плода, внутриутробная смерть плода). Применение пенициллина
АССОЦИИРОВАННЫЙ С БЕРЕМЕННОСТЬЮ ПРОТЕИН А В СЫВОРОТКЕ КРОВИ
Ассоциированный с беременностью протеин А (pregnancy-associated plasma protein A, PAPP-A) был обнаружен в сыворотке крови беременных в 1974 г. [Lin T.M. et al.,1974]. Белок имеет молекулярную массу 820 000, тетрамерное строение, развитый углеводный компонент и выраженное сродство к гепарину. Молекула PAPP-A имеет строение, идентичное α2-макроглобулину, который является ингибитором практически всех известных протеиназ.
При беременности, а также при некоторых злокачественных и воспалительных заболеваниях, наблюдается увеличение биосинтеза PAPP-A, что проявляется повышением его концентрации в сыворотке крови. В течение беременности содержание PAPP-A в крови возрастает в тысячи раз и перед родами может превышать 200 мкг/мл. Концентрация PAPP-A в сыворотке крови у первородящих и у женщин, имеющих в анамнезе три беременности и более, снижена. Довольно часто при высокой концентрации PAPP-A масса плаценты также увеличена. Многоплодная беременность, как правило, сопровождается высоким содержанием PAPP-A в сыворотке крови. После родов наблюдается быстрое снижение уровня PAPP-A в течение первых 2−3 дней, а затем его концентрация уменьшается в среднем
в2 раза каждые 3−4 дня.
При угрожающем выкидыше, сопровождающемся кровотечением (8−14-я
недели беременности), и развитии внутриматочных гематом, объём которых не превышает 15 мл, концентрация PAPP-A в крови существенно не изменяется. У женщин с кровотечениями на 7−20-й неделе беременности низкую концентрацию PAPP-A в крови выявляют чаще, чем при нормально протекающей беременности. Кроме того, приблизительно у 10% женщин, у которых беременность заканчивалась выкидышем, концентрации PAPP-A в сыворотке крови были повышенными.
Практически у всех женщин с низкой плацентацией отмечается менее выраженное увеличение концентраций PAPP-A в крови в течение всей беременности.
У женщин с нормально расположенной плацентой преждевременные роды и гипотрофия плода наиболее часто наблюдаются в тех случаях, когда на 7−13-й неделе беременности имеет место низкий уровень PAPP-A
всыворотке крови.
Вконце беременности концентрация PAPP-A в сыворотке крови, а также его суммарное содержание в плаценте у женщин, страдающих сахарным диабетом, значительно ниже, чем при нормально протекающей беремен-

Гормональные исследования ■ 585
ности. Снижение данных показателей перед родами зафиксировано также у беременных с артериальной гипертензией в анамнезе.
Повышение концентрации PAPP-A в сыворотке крови на срок беременности 34 нед выявляют у женщин с тяжёлыми формами позднего гестоза, что часто предшествует клиническим проявлениям преэклампсии, а также возможно при повышенном диастолическом давлении. Нередко высокое содержание PAPP-A в крови на сроке 34 нед выявляют у тех беременных, у которых в дальнейшем роды бывают преждевременными либо послеродовой период осложняется кровотечениями.
Изменение концентрации PAPP-A в сыворотке крови при патологических вариантах течения беременности представлено в табл. 9-35.
Таблица 9-35. Изменение концентрации PAPP-A в сыворотке крови при патологических вариантах течения беременности
Вид патологии |
PAPP-A |
Выкидыш |
↓ (I-II) |
Гипотрофия плода |
↓ (I) |
Трисомия плода |
↓ (I) |
Сахарный диабет |
↓ (III) |
Хроническая гипертензия |
↓ (III) |
Преэклампсия |
↑ (III) |
Преждевременные роды |
↓ (I); (III) |
Послеродовые кровотечения |
↑ (III) |
Первично низкая плацентация: |
|
отсутствие осложнений |
↑ (I-III) |
аномалии плода |
↓ (I); ↑ (II,III) |
гипотрофия плода |
↓ (I); ↑ (II-III); |
поздний выкидыш |
↑ (I); ↓ (II); |
преждевременные роды |
↑ (III) |
Примечание: ↑ — повышение, ↓ — снижение. В скобках указан триместр беременности.
ПЛАЦЕНТАРНЫЙ ЛАКТОГЕН В СЫВОРОТКЕ КРОВИ
Референтные величины концентрации плацентарного лактогена: у мужчин и небеременных женщин в сыворотке крови отсутствует; при беременности 5−38 нед — 0,5−11 мкг/мл (23−509 нмоль/л).
Плацентарный лактоген или плацентарный соматомаммотропин — гликопротеин с молекулярной массой приблизительно 19 000. Синтезируется синцитиотрофобластом с ранних сроков беременности, при этом содержание его в крови при физиологически протекающей беременности увеличивается. Максимум концентрации плацентарного лактогена регистрируют на 36−37-й недели беременности, затем она стабилизируется, а перед родами снижается. Концентрация плацентарного лактогена весьма вариабельна, индивидуальна и находится в прямой зависимости от массы плода и количества плацент (при многоплодии). Плацентарный лактоген поступает в в организм беременной, где быстро метаболизируется (период полураспада — от 11 до 30 мин). Короткий период полураспада, отсутствие

586 ■ Глава 9
суточного ритма секреции и наличие единственного источника его синтеза позволяют использовать его как прямой показатель функционирования плаценты. Плацентарный лактоген практически не проникает к плоду, в околоплодных водах его уровень в 8−10 раз ниже, чем в крови беременной. По своим свойствам он аналогичен гормону роста, но при беременности его продукция превышает в 100 раз секрецию СТГ. Плацентарный лактоген стимулирует мобилизацию жирных кислот, обладает лактотропным и лютеотропным действием, ингибирует клеточный иммунитет, активно влияет на обмен веществ (способствует потреблению глюкозы в организме плода, снижает синтез белка у беременной, что существенным образом увеличивает запас аминокислот, которые использует плод для своего формирования). Плацентарный лактоген является также антагонистом инсулина, играет важную роль в созревании и развитии молочных желёз во время беременности и в их подготовке к лактации. Кроме того, подобно пролактину, он поддерживает работу жёлтого тела яичников во время беременности, способствует повышению секреции жёлтым телом прогестерона.
В I триместре беременности при развитии плацентарной недостаточности уровень плацентарного лактогена значительно снижается. Крайне низкие значения его концентрации в крови выявляют накануне гибели плода и за 1−3 дня до самопроизвольного выкидыша. В более поздние сроки беременности снижение концентрации плацентарного лактогена выявляют при плацентарной недостаточности и хронической гипоксии плода. При этом его содержание в крови колеблется в широких пределах, однако у большинства беременных существенно ниже нормы. При плацентарной недостаточности содержание плацентарного лактогена в сыворотке крови снижается на 50%, а при гипоксии плода — почти в 3 раза. Концентрация плацентарного лактогена снижается при гипертонической болезни, поздних гестозах. Показания для исследования плацентарного лактогена: диагностика плацентарной недостаточности, гипоксии и гипотрофии плода.
Повышенные концентрации плацентарного лактогена в крови наблюдают при множественной беременности, сахарном диабете; резус-несов- местимости. Плацентарный лактоген также вырабатывается трофобластной опухолью. Чем больше степень злокачественности, тем ниже отношение уровней плацентарного лактогена и ХГ.
Гормональная регуляция менструального цикла
Менструальный цикл отражает деятельность системы гипоталамус−гипофиз−яичники, которая проявляется структурными и функциональными изменениями репродуктивного тракта: матки, маточных труб, эндометрия, влагалища. Каждый цикл заканчивается менструальным кровотечением, первый день которого считается началом цикла.
Во время первой части менструального цикла (фолликулиновая фаза) ФСГ, секретируемый передней долей гипофиза, стимулирует продукцию эстрадиола гранулёзными клетками яичника. ФСГ и эстрадиол вызывают пролиферацию этих клеток, и секреция эстрадиола увеличивается. Эти гормоны стимулируют ЛГ-рецепторы. Эстрадиол действует на эндометрий матки, вызывая его утолщение и васкуляризацию, тем самым готовит его к имплантации яйцеклетки. По мере созревания фолликулов в них и в кро-
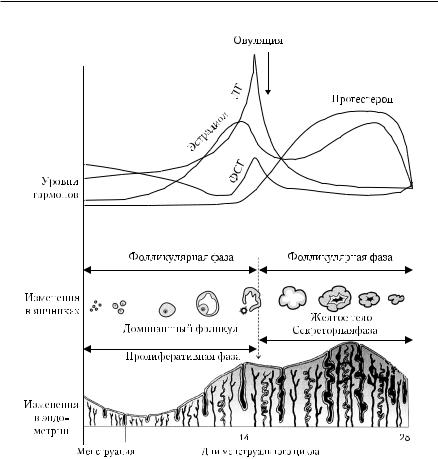
Гормональные исследования ■ 587
Рис. 9-9. Гормональная регуляция менструального цикла
ви увеличивается уровень ингибина, который оказывает селективно ингибирующее действие на секрецию ФСГ.
Пик концентрации эстрадиола в крови, приходящийся на середину менструального цикла (14−й день), запускает волну выброса ЛГ из гипофиза. ЛГ стимулирует овуляцию (выход зрелой яйцеклетки из фолликула). Оставшиеся клетки в постовуляторном фолликуле формируют жёлтое тело, которое начинает секретировать прогестерон и эстрадиол. Прогестерон оказывает тормозящее действие на секрецию ингибина.
Во время второй, лютеиновой, фазы прогестерон совместно с эстрадиолом вызывают ещё большее утолщение эндометрия. Происходит усиленная васкуляризация клеток эндометрия и их дифференцировка, клетки становятся секреторными.

588 ■ Глава 9
Приблизительно через 1 нед с момента образования жёлтого тела оно начинает обратное развитие и секретирует меньше эстрадиола и прогестерона. К 28-му дню менструального цикла уровень яичниковых стероидов становится неадекватным для поддержания жизни утолщённого эндометрия и он подвергается разрушению, что и приводит к менструации. Кровотечение продолжается 3−5 дней. Низкие уровни эстрадиола и прогестерона в конце цикла снимают (по принципу обратной отрицательной связи) ингибирование секреции гипоталамусом ГРГ. Уровень ГРГ в гипоталамусе повышается, что стимулирует секрецию ФСГ и ЛГ гипофизом, и менструальный цикл начинается вновь. Гормональная регуляция менструального цикла приведена на рис. 9-9.
Гормональная регуляция сперматогенеза
Основные функции мужских половых желёз (яичек, или семенников) — синтез и секреция мужских половых гормонов (андрогенов) и сперматогенез, то есть образование и развитие сперматозоидов. Андрогены необходимы не только для сперматогенеза и созревания спермы, они также контролируют рост и функции семенных везикул и простаты. При этом достаточный уровень тестостерона представляет собой необходимое условие нормальных либидо и половой потенции мужчины.
ГРГ секретируется эпизодически в течении дня клетками гипоталамуса. Он стимулирует переднюю долю гипофиза, которая в ответ секретирует ЛГ и ФСГ. ЛГ действует на клетки Ляйдига в яичках, стимулируя в них продукцию и секрецию тестостерона. Тестостерон попадает в сертолиевы клетки яичек, где способствует сперматогенезу в сперматогониях. Сертолиевы клетки продуцируют также ингибин, белок, который подавляет секрецию ФСГ гипофизом. Тестостерон обладает подобным эффектом в отношении ЛГ.
У половозрелых мужчин ФСГ способствует началу сперматогенеза. Гормон присоединяется к рецепторам плазматической мембраны сертолиевых клеток, которые находятся на базальной мембране семявыносящих канальцев яичек. Сертолиевы клетки отвечают на стимуляцию ФСГ продукцией белков, которые ускоряют созревание сперматогоний в канальцах. Если процесс сперматогенеза запущен, то для его поддержания достаточно одного тестостерона.
Функциональное состояние гормональных систем регуляции обмена натрия и воды
Для нормального функционирования клетки необходимо, чтобы её объём и осмолярность внутриклеточной жидкости поддерживались в очень узких пределах. Эти параметры частично регулируются через факторы, которые определяют градиент концентрации, раствора электролитов (прежде всего натрия) на уровне плазматической мембраны клетки. Механизмы, определяющие градиент концентраций, включают в себя пассивную диффузию воды и некоторых электролитов через клеточную мембрану и активный транспорт ионов с помощью энергопотребляющих насосов, расположенных в мембране. Постоянство объёма клетки и осмолярности определяется

Гормональные исследования ■ 589
также в некоторой степени осмолярностью экстрацеллюлярной жидкости, которая, в свою очередь, регулируется действием АДГ, влияющего на дистальные канальцы почек и определяющего экскрецию воды в мочу.
В норме преобладающий внеклеточный катион — натрий, который
взначительной мере определяет осмотическое давление внеклеточной жидкости. Оно зависит от концентрации и изменяется при колебаниях скорее относительных (а не абсолютных) величин содержания воды и натрия.
Если бы поддержание осмолярности экстрацеллюлярной жидкости зависело только от АДГ, то объём крови (объём плазмы) изменялся бы в широких пределах в течение дня, так как человек потребляет спорадически различное количество воды и солей. Из-за этих флюктуаций в приёме пищи и воды относительное постоянство объёма крови должно контролироваться целым комплексом регуляторных механизмов. В настоящее время установлено, что непосредственное участие в регуляции баланса воды и натрия
ворганизме принимают следующие системы.
■АДГ (аргинин−вазопрессин).
■Ренин−ангиотензин−альдостероновая система.
■Система натрийуретических пептидов.
Главная функция этих регуляторных гормональных систем заключается в поддержании постоянства объёма циркулирующей крови через их влияние на движение натрия и воды в почках. Эти же гормональные системы определяют количество натрия и воды в экстрацеллюлярной жидкости.
Заболевания, сопровождающиеся нарушением секреции гормонов, обеспечи-
вающих гомеостаз натрия и воды
■Несахарный диабет (недостаточность АДГ).
■Первичный ночной энурез (недостаточность АДГ).
■Нефрогенный несахарный диабет (несахарный диабет, не чувствительный к АДГ).
■Синдром неадекватной продукции АДГ (гиперсекреция вазопрессина).
■Первичный гиперальдостеронизм.
■Вторичный гиперальдостеронизм.
■Гипоальдостеронизм.
Лабораторная диагностика нарушений функционирования гормональных систем регуляции обмена натрия и воды в организме сложна — в большинстве случаев необходимо проведение целого комплекса исследований, основные из них следующие.
■Суточный объём мочи и её удельный вес.
■Анализ мочи по Зимницкому.
■Осмолярность плазмы крови и мочи.
■Концентрация натрия в плазме крови и моче.
■Концентрация калия в плазме крови и моче.
■Концентрация АДГ в плазме крови.
■Концентрация ренина в плазме крови.
■Концентрация ангиотензина I и II в плазме крови.
■Концентрация альдостерона в плазме крови.
■Концентрация натрийуретических пептидов в плазме крови.
■Содержание эндотелина в плазме.

590 ■ Глава 9
Антидиуретический гормон в плазме крови
АДГ — пептид, состоящий из 9 аминокислотных остатков. Он синтезируется как прогормон в гипоталамических нейронах, тела которых располагаются в супраоптических и паравентрикулярных ядрах. Ген для АДГ кодирует также нейрофизин II, белок-переносчик, транспортирующий АДГ по аксонам нейронов, которые оканчиваются в задней доле гипофиза, где происходит накопление АДГ. АДГ имеет суточный ритм секреции (её повышение наблюдают ночью). Секреция гормона уменьшается в положении лёжа, при переходе в вертикальное положение его концентрация повышается. Зависимость уровня АДГ в крови от осмолярности показана в табл. 9-36. Все перечисленные факторы необходимо учитывать при оценке результатов исследований.
Таблица 9-36. Референтные величины концентрации АДГ в плазме крови [Тиц У., 1997]
Осмолярность плазмы, мосм/л |
АДГ, пг/мл |
|
|
270−280 |
<1,5 |
280−285 |
<2,5 |
285−290 |
1−5 |
290−295 |
2−7 |
295−300 |
4−12 |
Выход АДГ из накопительных везикул регулируется в первую очередь осмолярностью плазмы. Средний уровень осмолярности плазмы в норме составляет 282 мосм/л с отклонениями в ту или иную сторону до 1,8%. Если осмолярность плазмы поднимается выше критического уровня (порога) 287 мосм/л, то выход АДГ резко ускоряется, что связано с активацией осморецепторов, расположенных на клеточной мембране супраоптического и паравентрикулярных нейронов гипоталамуса и клетках каротидного синуса на сонных артериях. Данные рецепторы способны уловить изменения осмолярности в плазме крови порядка 3−5% выше средней величины, особенно при резких изменениях (более 2% в час). Быстрое увеличение осмолярности плазмы лишь на 2% приводит к усилению секреции АДГ в 4 раза, тогда как уменьшение осмолярности на 2% сопровождается полным прекращением секреции АДГ.
Гемодинамические факторы также оказывают выраженное регуляторное влияние на секрецию АДГ. Снижение среднего артериального давления и/или «эффективного» объёма плазмы менее чем на 10% могут быть обнаружены барорецепторами, расположенными в клетках левого предсердия и, в меньшей степени, в каротидном синусе. По мультисинаптическому афферентному пути импульсы от «растянутых» барорецепторов передают информацию нейронам супраоптического и паравентрикулярного ядер гипоталамуса, которые стимулируют выход АДГ.
Главный биологический эффект АДГ заключается в увеличении резорбции свободной воды из мочи, находящейся в просвете дистальной части почечных канальцев, в клетки канальцев. АДГ связывается со специфическими V2-рецепторами на наружной мембране этих клеток, вызывая активацию аденилатциклазы, которая образует цАМФ. цАМФ активирует

Гормональные исследования ■ 591
протеинкиназу А. Протеинкиназа А фосфорилирует белки, которые стимулируют экспрессию гена аквапорина-2, одного из белков, создающих каналы для воды. Аквапорин-2 мигрирует к внутренней поверхности мембраны тубулярных клеток, где встраивается в мембрану, формируя поры или каналы, через которые вода из просвета дистальных канальцев свободно диффундирует внутрь тубулярной клетки. Затем вода проходит из клетки через каналы в плазматической мембране в интерстициальное пространство, откуда поступает в сосудистое русло (рис. 9-10).
Несахарный диабет (недостаточность АДГ). Истинный несахарный диабет характеризуется полиурией и полидипсией в результате недостаточности АДГ. К стойкому несахарному диабету приводят деструкция надзрительного и околожелудочковых ядер или перерезка надзрительного пути выше срединного возвышения.
Причиной заболевания может служить поражение нейрогипофиза любого генеза. Чаще всего это опухоли — краниофарингомы и глиомы зрительного нерва. У больных гистиоцитозом несахарный диабет развивается в 25−50% случаев. Изредка причиной несахарного диабета служат энцефалит, саркоидоз, туберкулёз, актиномикоз, бруцеллёз, малярия, сифилис, грипп, ангина, все виды тифов, септические состояния, ревматизм, лейкоз. Несахарный диабет может развиться после черепно-мозговой травмы, особенно если она сопровождается переломом основания черепа.
Несахарный диабет, развивающийся после хирургических вмешательств на гипофизе или гипоталамусе, может быть как транзиторным, так и постоянным. Течение заболевания, возникающего после случайной травмы, непредсказуемо; спонтанные выздоровления могут отмечаться через несколько лет после травмы.
В последние годы показано, что несахарный диабет может иметь аутоиммунное происхождение (наличие АТ к АДГ-секретирующим клеткам). В редких случаях он может быть наследственным. Несахарный диабет может быть компонентом редко встречающегося синдрома Вольфрама, при котором он сочетается с сахарным диабетом, атрофией зрительных нервов
инейросенсорной тугоухостью.
Клинические признаки полиурии появляются, когда секреторная способ-
ность гипоталамических нейронов снижается на 85% [Дедов И.И., 1995]. Недостаточность АДГ бывает полной или частичной, что определяет степень полидипсии и полиурии.
Исследование концентрации АДГ в плазме крови не всегда необходимо для диагностики несахарного диабета. Целый ряд лабораторных показателей довольно точно указывают на наличие у пациента недостаточности секреции АДГ. Суточный объём мочи достигает 4−10 л и более, её плотность колеблется в пределах 1,001−1,005, осмолярность — в пределах 50−200 мосм/л. В периоды выраженной дегидратации плотность мочи повышается до 1,010, а осмолярность до 300 мосм/л. У детей начальным признаком заболевания может быть никтурия. В остальных отношениях функция почек не нарушена. Часто выявляют гиперосмолярность плазмы (выше 300 мосм/л), гипернатриемию (более 155 ммоль/л) и гипокалиемию. При проведении теста с ограничением воды у больных с выраженной недостаточностью АДГ отмечается повышение осмолярности плазмы крови, но осмолярность мочи обычно остаётся ниже осмолярности плазмы крови.
