- •Физико-химические свойства белков
- •Первичная структура
- •Вторичная структура белков
- •Третичная структура белков
- •22) Сахароза. Строение. Способы получения. Свойства.
- •27) Углеводы как природно-сырьевой источник.
- •28) Невосстанавливающие углеводы. Особенности строения.
- •29) Изомерия моносахаридов.
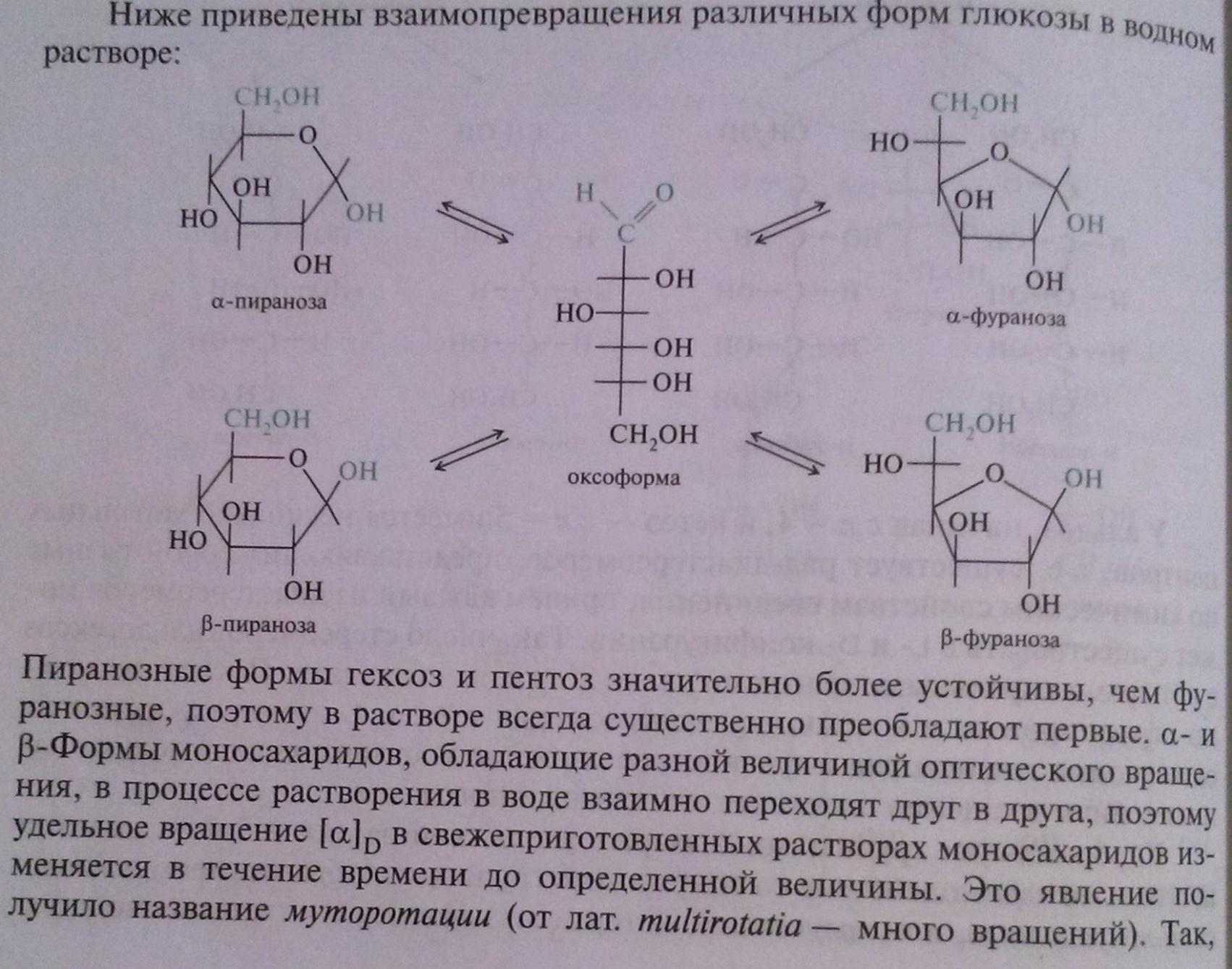
- •30) Явление таутомерии и мутаротации у моносахаридов.
- •31) Олигосахариды.
- •32) Гликозидная связь в структуре углеводов и их производных.
- •10.4. Сложные липиды
- •10.4.1. Фосфолипиды
- •10.4.2. Сфинголипиды
- •10.4.3. Гликолипиды
- •10.4. Сложные липиды
- •10.4.1. Фосфолипиды
- •10.4.2. Сфинголипиды
- •10.4.3. Гликолипиды
Первичная структура
Первичной структурой называют порядок чередования (последовательность) аминокислотных остатков в белке. В организме человека имеется тысячи разных белков, имеющих различную первичную структуру.
Вторичная структура белков
Пептидная цепь обладает значительной гибкостью. В результате внутрицепочечных взаимодействий она приобретает определённую пространственную структуру (конформацию), которая и называется вторичной. Вторичная структура белков стабилизируется за счёт образования водородных связей между карбонильной группой одного аминокислотного остатка и NH-группой другого:
![]()
Чем больше образуется водородных связей, тем устойчивее вторичная структура. Но возможности пространственной укладки пептидной цепи ограничены тем, что пептидная связь имеет частично двойной характер и вращение вокруг неё невозможно. Атомы водорода и кислорода пептидной группы занимают транс-положение. Напротив, в области связей между пептидными группами и α-углеродными атомами возможно свободное вращение:
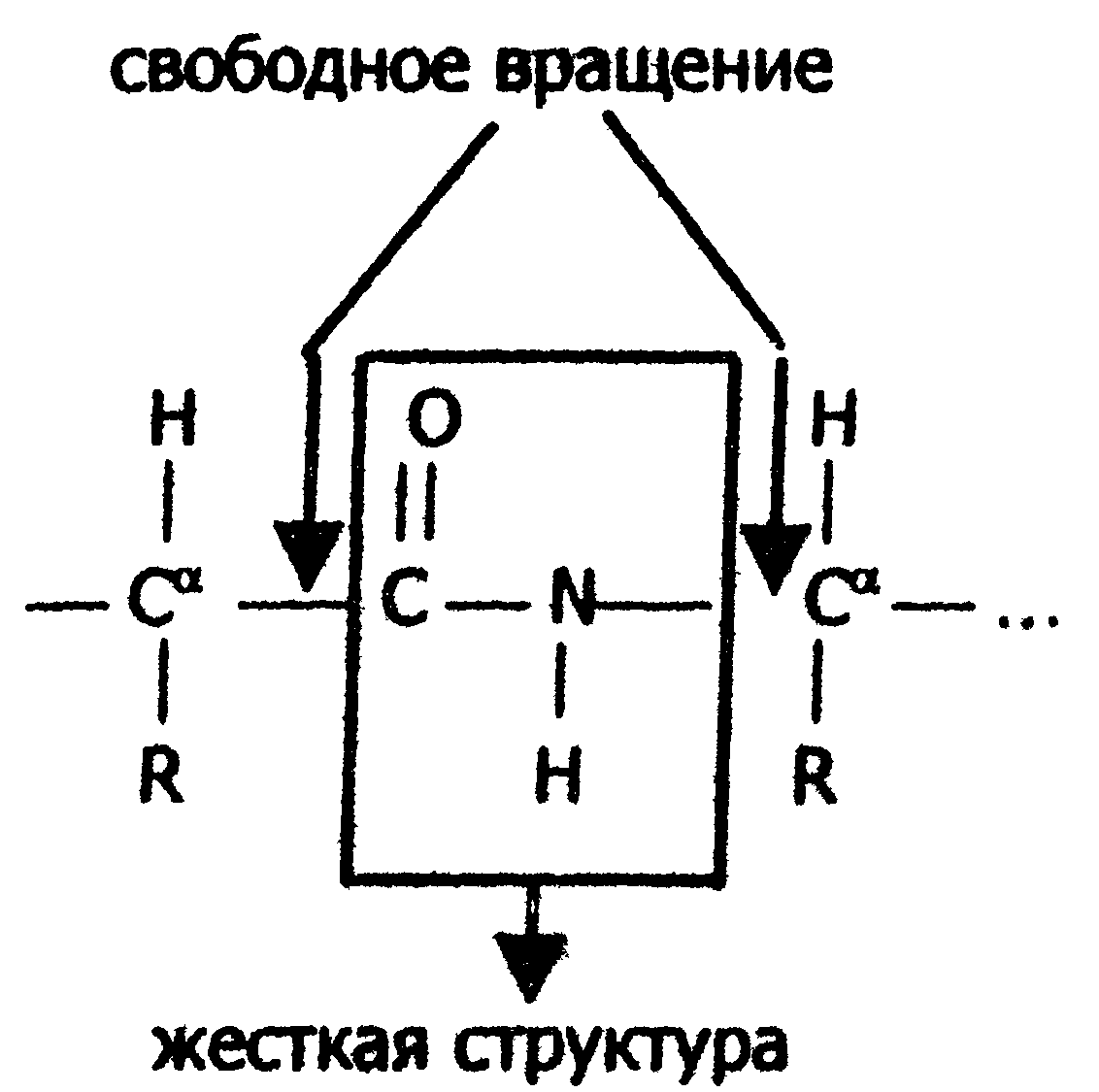
Вследствие этих ограничений при образовании водородных связей полипептидная цепь принимает не произвольную, а определенную конформацию. Известны три основных типа вторичной структуры белков: α-спираль, β-структура (складчатый слой) и беспорядочный клубок. В α-спирали NH-группа данного остатка аминокислоты взаимодействует с С=О-группой четвертого от него аминокислотного остатка. В результате образуется спираль, закрученная по часовой стрелке вследствие L-аминокислотного состава белков и содержащая на каждый виток 3,6 аминокислотных остатка. На один аминокислотный остаток приходится 0,15 нм, угол подъема спирали равен 26 градусов (рис. ниже). Витки спирали связаны водородными связями, ориентированными вдоль оси спирали, α-радикалы направлены наружу. Различные белки имеют различную степень спирализации: отношение числа аминокислот в спирали к общему числу минокислот в белке.
В складчатом слое (β-структуре) пептидные цепи (или отдельные участки одной цепи) располагаются параллельно друг другу в один слой, образуя фигуру, подобную листу, сложенному гармошкой. Причём возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы целей направлены в одну и ту же сторону, (рис.ниже,а) и антипараллельными (N-концы направлены в разные стороны) (рис ниже,б).
Как правило, вторичная структура белковой молекулы содержит и α-, и β-участки, а также участки, не имеющие какой-либо правильной организации, называемые "беспорядочным" клубком. В этих участках полипептидная цепь сравнительно легко изгибается, меняя конформацию, в отличие от более жёстких структур α- и β-участков.

Рис. Схема α-спирали

-
а)
б)
Рис. Схемы β-структур: а-параллельные цепи; б- антипараллельные цепи
Третичная структура белков
Третичной структурой белка называется способ укладки в пространстве полипептидной цепи, имеющей определённую вторичную структуру. По форме молекулы и особенностям пространственной структуры белки делятся на две группы: глобулярные и фибриллярные. Форма первых близка к сферической или эллипсоидной, с отношением короткой и длинной осей до 1:50. Молекулы фибриллярных белков имеют удлинённую форму (форма нити, палочки) и соотношение осей 1: (75-200).
Третичная структура глобулярных белков стабилизируется в основном за счёт образования ковалентных дисульфидных связей между радикалами цистеина:

Дополнительный вклад также вносят слабые нековалентные связи: гидрофобные - между неполярными радикалами; водородные - между полярными радикалами; ионные - между заряженными радикалами (рис. 7).
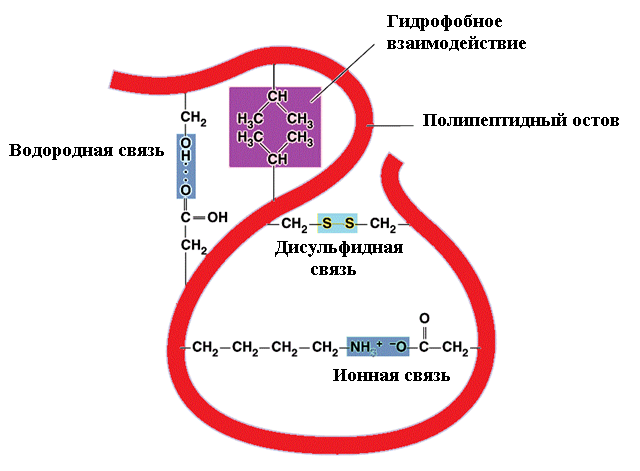
Рис.7. Связи, стабилизирующие третичную структуру белков
Третичная структура белка после его синтеза в рибосомах возникает автоматически и предопределяется первичной структурой белка. Третичная структура глобулярного белка (рис.8а) не является абсолютно жёсткой, в известных пределах возможен разрыв некоторых слабых нековалентных связей и образование новых: глобула как бы пульсирует в растворе.
Структурная организация фибриллярных белков имеет ряд особенностей по сравнению с глобулярными. Фибриллярные белки составляют основную массу соединительной ткани в организме человека и животных. Коллаген - самый распространённый фибриллярный белок, он составляет 1/3 часть от всех белков в организме человека. Эластин, который по сравнению с коллагеном более эластичен, содержится в тканях, испытывающих периодическое растяжение и сокращение: кровеносные сосуды, лёгкие, некоторые связки суставов. α-Кератины входят в состав эпидермиса кожи, волос, ногтей. Фибриллярные белки построены из трёх пептидных цепей (в каждой около 1000 аминокислотных остатков), каждая из которых имеет конформацию спирали, отличную от α-спирали (за исключением α-кератинов). Эти три спирали в молекуле коллагена перевиты друг с другом, образуют плотный жгут за счет водородных связей между цепями и внутри цепей. Молекулы коллагена, соединяясь «бок о бок», образуют микрофибриллы, из последних формируются более толстые - макрофибриллы, а из них - волокна и пучки волокон. Аналогичную структуру имеют α-кератины. В одном волосе, например, содержатся сотни макрофибрилл α-кератина, ориентированных по длине волоса. Фибриллярные белки имеют специфический аминокислотный состав. Например, в коллагене каждая третья аминокислота - глицин, 20%- остатки пролина и гидроксипролина, 10%- аланина и 40%- остальные аминокислоты.
Если первичная структура белков даёт возможность предсказать конформацию молекулы, то есть её вторичную и третичную структуры, то третичная структура содержит информацию иного рода, а именно функциональную. Все биологические свойства белков связаны с сохранностью его третичной структуры, которую называют нативным белком. Любые воздействия, приводящие к нарушению этой конформации, сопровождаются полной или частичной потерей белком его биологических свойств.
Четвертичная структура белков (в вопросах этого нет, но мало ли пригодится)
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. К ним относятся, например, миоглобин - белок мышечной ткани, ряд ферментов (лизоцим, пепсин, трипсин и так далее). Однако некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет первичную, вторичную и третичную структуры. Для таких белков введено понятие четвертичной структуры, которая представляет собой организацию нескольких полипептидных цепей в функциональную единую молекулу белка (рис.8б). Такой белок с четвертичной структурой называется олигомером или мультимером, а его полипептидные цепи - протомерами или субъединицами. Стабилизируют четвертичную структуру такие же связи, как и - третичную. Протомеры соединяются в мультимеры по принципу комплементарности - универсальному принципу живой природы. Расположение групп, образующих связи, на одном протомере соответствует их расположению на другом протомере. Принцип комплементарности лежит в основе процесса самосборки олгимерных белков.
|
|
|
|
а |
Б
|
Рис. 8. Схема третичной (а) и четвертичной (6) структуры белка
При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Например, белки волос и шерсти имеют фибриллярную конформацию четвертичной структуры. Примером глобулярного мультимера может служить гемоглобин, состоящий из четырёх субъединиц глобулярного характера: двух α- и двух β-цепей. Его строение кратко можно представить формулой 2α2β. Под действием мочевины происходит обратимая диссоциация гемоглобина:
2α2β = 2α + 2β = α + α + β + β,
либо
2α2β = αβ + αβ = α + α + β + β
димеры протомеры
Отдельные протомеры биологически неактивны, именно четвертичная структура обеспечивает ряду белков их специфические функции. Число протомеров в мультимерах всегда чётное, а молекулярные массы более 1млн. Да. Классическим примером мультимерной молекулы является вирус табачной мозаики с молекулярной массой около 40 млн. Да, состоящий из одной молекулы РНК и 2130 белковых субъединиц.
13) Идентификация белков и их значение.
Цветные реакции применяются для установления белковой природы веществ, идентификации белков и определение их аминокислотного состава в различных биологических жидкостях. В клинической лабораторной практике эти методы используются для определения количества белка в плазме крови, аминокислот в моче и крови, для выявления наследственных и приобретенных патологий обмена у новорожденных.
Биуретовая реакция на пептидную связь.
В основе ее лежит способность пептидных связей (-CO-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи.
Ход определения. В пробирку вносят 5 капель раствор яичного белка, 3 капли NaOH, 1 каплю Cu(OH)2, перемешивают. Содержимое пробирки приобретает сине-фиолетовое окрашивание.
Нингидриновая реакция.
Сущность реакции состоит в образовании соединения, окрашенного в сине-фиолетовый цвет, состоящего из нингидрина и продуктов гидролиза аминокислот. Эта реакция характерна для аминогрупп в α - положении, присутствующих в природных аминокислотах и белках.
Ход определения. В пробирку вносят 5 капель раствора яичного белка, затем 5 капель нингидрина, нагревают смесь до кипения. Появляется розово-фиолетовое окрашивание, переходящее с течением времени в сине-фиолетовое.
Ксантопротеиновая реакция.
При добавлении к раствору белка концентрированной азотной кислоты и нагревании появляется желтое окрашивание, переходящее в присутствии щелочи в оранжевое. Сущность реакции состоит в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок. Реакция выявляет наличие в белке циклических аминокислот.
Ход определения. К 5 каплям раствора яичного белка добавляют 3 капли азотной кислоты и (осторожно!) нагревают. Появляется осадок желтого цвета. После охлаждения добавляют (желательно на осадок) 10 капель NaOH, появляется оранжевое окрашивание.
Реакция Адамкевича.
Аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
Ход определения. К одной капле белка прибавляют 10 капель уксусной кислоты. Наклонив пробирку, осторожно по стенке добавляют по каплям 0,5 мл серной кислоты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Реакция Фоля.
Аминокислоты, содержащие сульфгидрильные группы - SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и NaOH), образует осадок сульфида свинца PbS черного или бурого цвета.
Ход определения. К 5 каплям раствора белка прибавляют 5 капель реактива Фоля и кипятят 2-3 мин. После отстаивания 1-2 мин. появляется черный или бурый осадок.
Значение белков:
Белки́ — сложные органические соединения, состоящие из аминокислот (более 80), из которых 22 наиболее распространены в пищевых продуктах. Белки выполняют множество жизненно важных функций в человеческом организме:
-служат материалом для построения клеток, тканей и органов, образования ферментов и большинства гормонов, гемоглобина и других соединений;
-формируют соединения, обеспечивающие иммунитет к инфекциям;
-участвуют в процессе усвоения жиров, углеводов, минеральных веществ и витаминов.
14) Роль химического взаимодействия в структуре белка (Вандер-Ваальс).
15) Коллоидные свойства белковых растворов (физ. свойства)
Белки, имея большую молекулярную массу, при растворении в воде образуют коллоидные растворы. В растворах они обнаруживают коллоидные свойства: медленно диффундируют, не проходят через полупроницаемую мембрану, рассеивают свет, имеют высокую вязкость. Однако белковые растворы относят к типичным коллоидных растворов, поскольку белки, диспергуюясь до единичных молекул, образуют гомогенный раствор. Наконец, их можно считать истинными растворами.
Сходство белковых и истинных коллоидных растворов основывается на том, что молекулы белка имеют размеры, близкие к размерам мицелл коллоидного раствора.
Коллоидный раствор, находящийся в жидком состоянии, принято называть золем, а в плотном — гелем. При соответствующих условиях, например изменениях температуры, золь легко может переходить в гель и, наоборот, гель — в золь. Таким образом, указанные изменения состояния коллоидных растворов белков являются обратимыми.
В процессе жизнедеятельности клеток подобного рода обратимые изменения состояния белков наблюдаются непрерывно и лежат в основе большинства физиологических процессов. С отмиранием же клеток белки претерпевают необратимые изменения. В этом случае возникает так называемая денатурация белков (потеря природных свойств). Денатурацию можно вызвать и искусственным путем, например путем кипячения белков.
Содержащиеся в клетках белки обладают способностью связывать большое количество воды. Это свойство белков называется их гидрофильностью. Гидрофильность белков имеет большое значение для жизнедеятельности клеток. Связывая воду, белки набухают. Это придает клеткам соответствующую упругость и эластичность; повышается и механическая устойчивость клеток.


16) Факторы определения растворимости белков.
Полярные группы белков способны взаимодействовать с водой (гидратироваться), а также с низкомолекулярными органическими соединениями и ионами (с этим свойством связана транспортная функция белков). Количество воды, связанной с белком, достигает 30-50 г на 100 г белка. Гидрофильных полярных групп значительно больше на поверхности белковой глобулы, чем внутри ее, эти группы образуют так называемую гидратную оболочку белковой молекулы. Но есть и гидрофобные белки, они нерастворимы в воде, но растворяются в жирах (липидах) и встречаются в основном в клеточных мембранах. Растворимость белков зависит от количества гидрофильных (полярных) групп, от размеров и формы молекул, от величины суммарного заряда, а также от наличия в растворе других растворенных веществ. Например, некоторые белки не растворяются в дистиллированной воде, но растворяются в присутствии небольшой концентрации нейтральных солей. При высоких концентрациях солей белки выпадают в осадок (высаливание), причем для осаждения различных белков требуется разное количество соли, что используется для фракционирования белков. Чаще всего для разделения белков методом высаливания используют сульфат аммония. После удаления соли (например, диализом) осажденный белок вновь растворяют, при этом сохраняются его нативные свойства.
Растворимость белков зависит также от особенностей их структурной организации: глобулярные белки, как правило, лучше растворимы, чем фибриллярные.
рН среды влияет на заряд белка, а, следовательно, на его растворимость. Растворимость и устойчивость белка минимальны при рН, соответствующем изоэлектрической точке белка. Объясняется это тем, что в изоэлектрической точке молекула не несет суммарного заряда и, следовательно, между соседними молекулами белка отсутствует электростатическое отталкивание. При значениях рН выше или ниже изоэлектрической точки все молекулы белка имеют суммарный заряд одного знака, вследствие чего они отталкиваются друг от друга и образование ими нерастворимых агрегатов (слипание) оказывается невозможным.
В сравнительно узком интервале температур, приблизительно от 0 до 40 Сº, растворимость большинства белков возрастает при повышении температуры (однако есть исключения). При температурах превышающих 40-50 Сº, большинство белков утрачивает стабильность; начинается их денатурация, сопровождающаяся обычно резким снижением растворимости в области нейтральных значений рН. (Денатурация – сложное явление, в основе которого лежит изменение пространственной нативной (природной) конфигурации белка за счет внутримолекулярной перегруппировки его молекулы, не сопровождающаяся расщеплением пептидной связи)
Растворимость белка зависит также от ионной силы раствора. Нейтральные соли оказывают заметное влияние на растворимость глобулярных белков. При низких концентрациях растворы нейтральных солей повышают растворимость многих белков. Этот эффект не зависит от природы нейтральной соли и числа зарядов каждого из ионов, присутствующих в растворе. Соли, содержащие двухвалентные ионы, например MgCl2 или MgSO4, значительно эффективнее повышают растворимость белков, чем такие соли, как NaCl, NH4Cl и KCl. Повышение растворимости вызывается изменениями в степени диссоциации ионизируемых групп белка. При значительном повышении кнцентрации нейтральных солей растворимость белков начинает опять понижаться, и при очень высоких концентрациях соли белок может полностью выпасть в осадок. Это явление называется высаливанием.

17) Классификация углеводов и их номенклатура.
Углево́ды (сахара́, сахариды) — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Классификация углеводов основана на их способности гидролизоваться. Углеводы разделяются на простые и сложные. Простые углеводы иначе называются моносахаридами, они не подвергаются гидролизу. Сложные подразделяют на олигосахариды и полисахариды.
|
Углеводы | |||
|
Моносахариды |
Олигосахариды |
Полисахариды | |
|
Альдозы |
Кетозы |
восстанавливающие |
гомополисахариды |
|
Альдотриозы |
кетотриозы |
невосстанавливающие |
гетерополисахариды |
|
Альдотетрозы |
кетотетрозы |
|
|
|
Альдопентозы |
кетопентозы |
|
|
|
Альдогексозы |
кетогексозы |
|
|
Моносахариды (простые углеводы) - самые простые представители углеводов и при гидролизе не расщепляются до более простых соединений. Моносахариды - самый быстрый и качественный источник энергии для процессов, происходящих в клетке. Моносахариды сразу окисляются до двуокиси углерода и воды, тогда как белки и жиры окисляются до тех же продуктов через ряд сложных промежуточных процессов. Моносахариды имеют сладкий вкус и потому их называют «сахарами».
Олигосахариды - более сложные соединения, построенные из нескольких (от 2 до 10) остатков моносахаридов. Дисахариды (олигосахариды), как и моносахариды, имеют сладкий вкус и потому их называют «сахарами».
Полисахариды - высокомолекулярные соединения - полимеры, образованные из большого числа моносахаридов. Они делятся на перевариваемые (крахмал, гликоген) и не перевариваемые (пищевые волокна - клетчатка, гемицеллюлоза, пектиновые вещества) в желудочно-кишечном тракте. Полисахариды сладким вкусом не обладают.
Номенклатура
В основу номенклатуры сахаров положены тривиальные названия моносахаридов состава СnH2nOn с прямой цепью углеродных атомов: ксилоза, рибоза, глюкоза, фруктоза. Наименованиям кетоз придается окончание –улоза, например кетоза С₅-пентулоза. Всем моносахарам присуща конфигурационная (оптическая) изомерия, т.е. они существуют в двух
э тантиомерных
формах:D
и L.
Принадлежность моносахаридов к D-
или L-ряду
определяется по расположению ОН-группы
у последнего (считая от альдегидной или
кетогруппы) хирального атома углерода.
В качестве
стандарта сравнения конфигурации
асимметричного атома углерода предложено
использовать изомер глицеринового
альдегида.
Названный D-глицериновым
альдегидом изомер вращает плоскость
поляризованного света вправо, а его
зеркальное отражение антипод –
L-глицериновый
альдегид – влево:
тантиомерных
формах:D
и L.
Принадлежность моносахаридов к D-
или L-ряду
определяется по расположению ОН-группы
у последнего (считая от альдегидной или
кетогруппы) хирального атома углерода.
В качестве
стандарта сравнения конфигурации
асимметричного атома углерода предложено
использовать изомер глицеринового
альдегида.
Названный D-глицериновым
альдегидом изомер вращает плоскость
поляризованного света вправо, а его
зеркальное отражение антипод –
L-глицериновый
альдегид – влево:
Все моносахариды, которые теоретически могут быть получены из D-глицеринового альдегида путем последовательного удлинения его цепи со стороны альдегидной группы, называют D-сахарами, независимо от конфигураций остальных атомов углерода, а полученные таким же способом из L-глицеринового альдегида –L-сахарами:
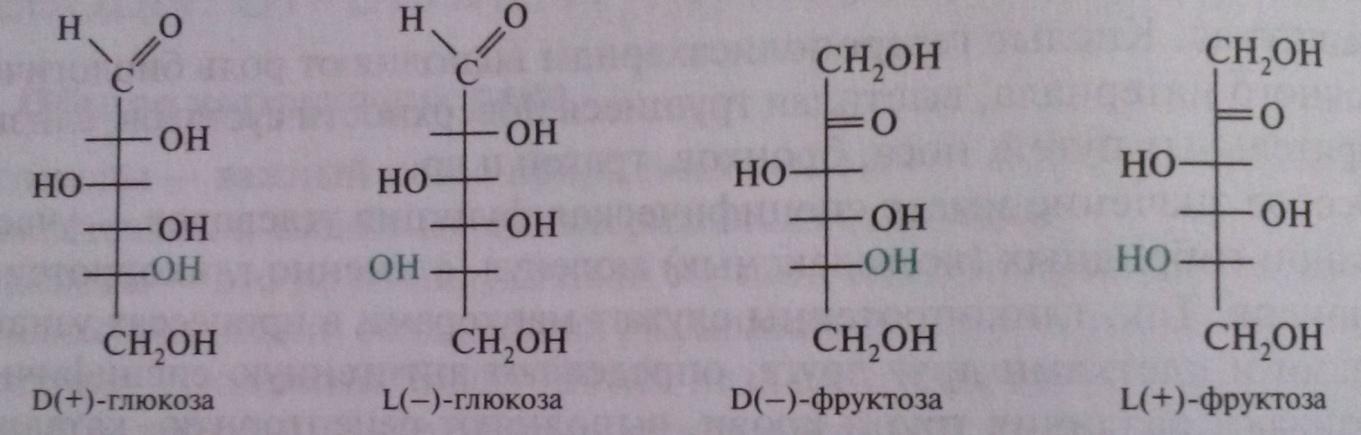
Некоторые моносахариды, например фруктоза, отнесенные к D-ряду, являются левовращающими, а представители L-ряда – правовращающими. Чтобы указать и принадлежность сахара к D- или L-ряду, и направление вращения плоскости поляризации, после символов D или L перед названием в скобках ставят знак (+) или (-), обозначающий соответственно правое или левое вращение.
В живых организмах моносахариды присутствуют преимущественно в D-конфигурации, которую называют природной. Исключение составляет L-арабиноза бактерий, L-рамноза и L-сорбоза растений.
Ниже приведены стереохимические соотношения D-альдоз и D-кетоз, содержащих от С-3 до С-6 углеродных атомов:

18) Классификация простых углеводов и особенности их химического строения.


Особенности химического строения:



19) Функции углеводов различного строения в природе. Особенности строения.


20) Глюкоза. Свойства. Нахождение в природе.

β-фруктофураноза 2-фосфат-β-фруктофуранозы
Реакции с фосфорной кислотой
Реакция с фосфорной кислотой может протекать по гликозидному гидроксилу и по первичноспиртовым группам (-СН2ОН):




Реакция алкилирования (реакция гидроксильных групп)
|
α – глюкоза |
+ СH3ОН |
HCl(газ)→ |
α –метил-D- глюкопиранозид |
+ H2О |
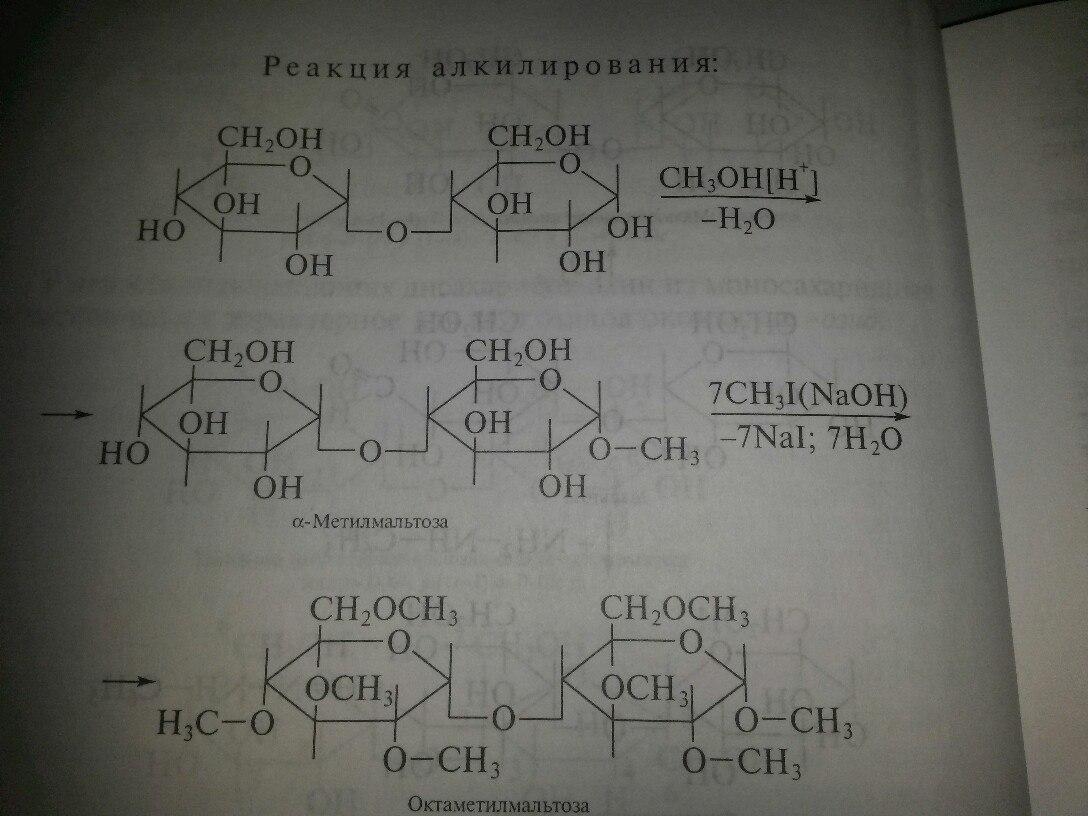
21) Мальтоза. Строение. Способы получения. Свойства.
Восстанавливающие дисахариды:
Мальтоза ̶ α-глюкопиранозил (1-4) -α-глюкопираноза (солодовый сахар) - состоит из двух остатков α-D-глюкозы, являетсяпромежуточным продуктом при гидролизе полисахаридов (крахмала и гликогена). Содержится в небольших количествах в некоторых растениях, образуется при ферментативномгидролизе крахмала. Легко растворяется в воде. Водные растворы имеют сладкий вкус.В организме человека мальтоза расщепляется ферментом доD-глюкозы. Так как в молекуле мальтозы у второго остатка глюкозы имеется свободный полуацетальный гидроксил, она обладает восстанавливающими свойствами. В растворе существует в нескольких таутомерных формах:


Ее растворы мутаротируют, дают положительную реакцию с реактивом Толленса и Фелинга. При ее окислении образуется лактобионовая кислота. При окислении в мягких условиях – бромной водой , она превращается в мальтобионовую кислоту.

Как и многоатомные спирты ,дисахариды вступают в реакции алкилирования и ацилирования. Характерной реакцией является кислотный гидролиз, в результате которого расщепляются гликозидные связи и образуются моносахариды.