
2015-СК-біохімія-07-Ензими-ІКТ---
.pdf
ЕС або КФ (класифікація ферментів або ензимів)
КФ 1 Оксидоредуктази: каталізують реакції окиснення/відновлення
CH3CH2OH + NAD+ (CH3)CHO + NADH + H+
оксидоредуктаза (алкоголь-дегідрогеназа)
КФ 2 |
Трансферази: переносять |
функціональні |
групи |
(наприклад, фосфатну, |
метильну чи |
аміно-групу) |
|
|
ГЛЮКОЗА + ATP ГЛЮКОЗО-6-ФОСФАТ + ADP
трансфераза (гексокіназа)
21
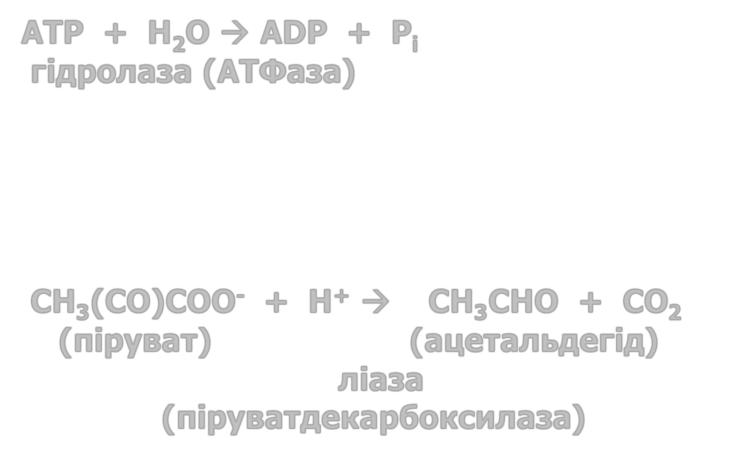
КФ 3 Гідролази: каталізують гідроліз різних зв'язків
ATP + H2O ADP + Pi
гідролаза (АТФаза)
КФ 4 Ліази: розрізають різні зв'язки, відмінні від таких, як при гідролізі та окисненні («розрізають» або «утворюють» подвійні зв'язки)
CH3(CO)COO- |
+ H+ CH3CHO + CO2 |
(піруват) |
(ацетальдегід) |
|
ліаза |
(піруватдекарбоксилаза)
22

КФ 5 Ізомерази: каталізують ізомеризацію в межах однієї молекули
-OOC |
H |
|
H |
H |
| |
| |
|
| |
| |
C = C |
|
C = C |
||
| |
| |
|
| |
| |
H |
COO- |
|
-OOC |
COO- |
|
ізомераза |
|
||
|
(малатізомераза) |
|
||
КФ 6 Лігази: об'єднують дві молекули з ковалентними зв’язками.
CH3(CO)COO- + ATP + CO2 ADP + Pi + -OOC-CH2(C0)COO-
(оксалоацетат)
лігаза (піруваткарбоксилаза)
23
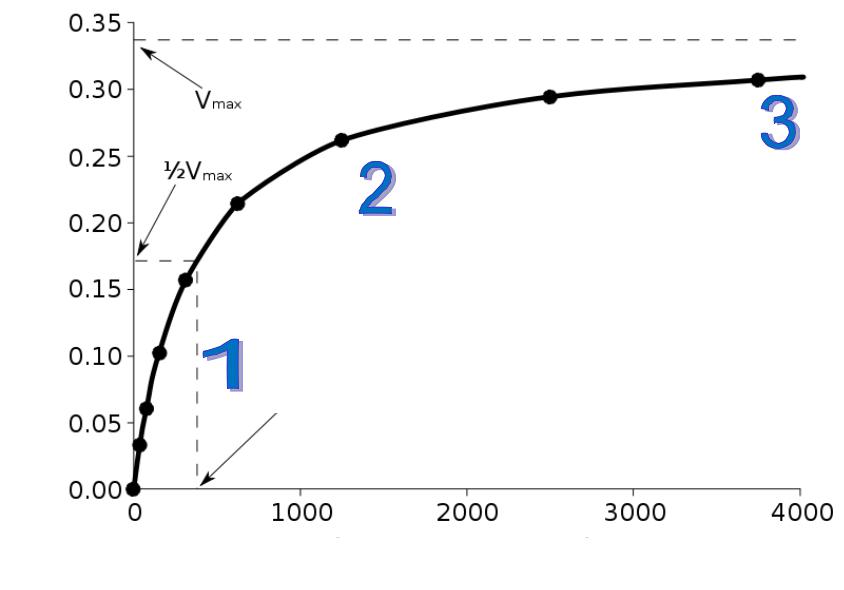
Швидкість реакції
5. Кінетичні властивості ензимів за впливу різних фізико-хімічних факторів
1-початок реакції; 2- вихід кривої насичення на плато; 3- плато насичення ензиму субстратом; див. схему попереднього слайду
КМ
Концентрація субстрату
Крива насичення ензиму субстратом, що залежність між концентрацією субстрата ферментативної реакції
характеризує
ішвидкістю
24
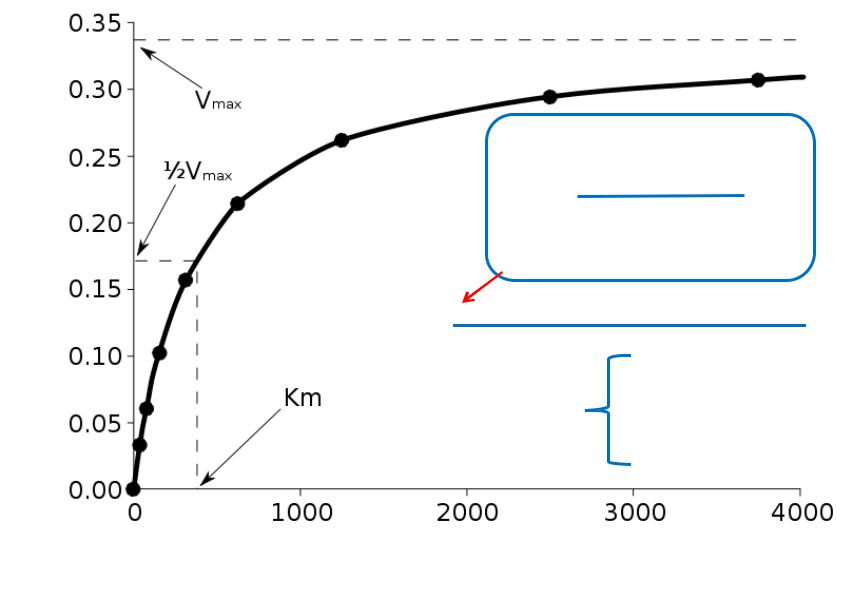
Швидкість реакції (V)
V=Vmax∙[S]
KM + [S]
|
рівняння Міхаеліса-Ментен |
||
|
одиниці |
Км {моль/л} |
|
КМ |
|||
|
|||
|
вимірювання |
Vmax {моль/(л∙сек)} |
|
|
|||
|
|
||
Концентрація субстрату ([S])
Крива насичення ензиму субстратом, що характеризує залежність між концентрацією субстрата і швидкістю
ензимної реакції |
25 |
|

Переведення рівняння Міхаеліса-Ментен
V=Vmax∙[S] |
||
K |
M |
+ [S] |
|
|
|
 у лінійний графік y=a + bx (рівняння прямої лінії)
у лінійний графік y=a + bx (рівняння прямої лінії)
y=1/ v; a=1/Vmax; b=Km/Vmax; x=1/[S]
Графік Лайнувера-Берка
 α
α
=tgα
26
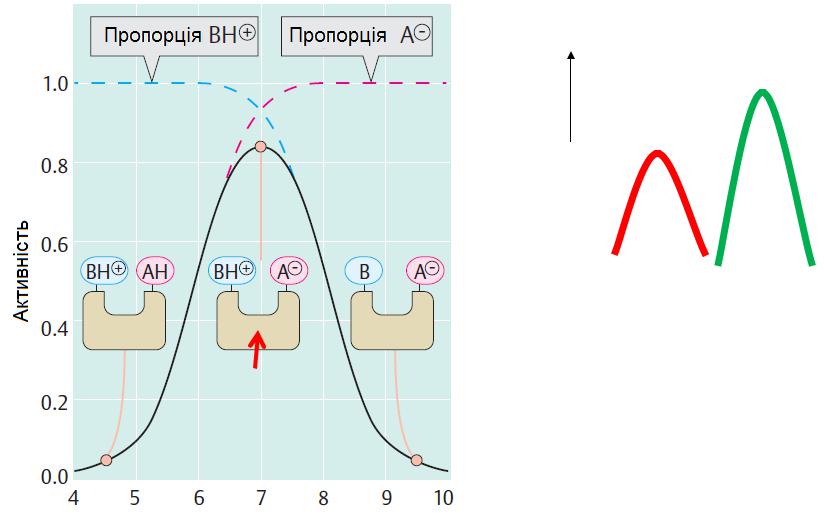
Залежність активності ферменту від рН
Активний
ензим
рН
|
|
т |
|
|
п |
р |
|
|
е |
и |
|
|
п |
п |
|
активність |
с |
с |
|
и |
и |
||
|
|||
|
н |
Е2 н |
|
|
Е1 |
|
|
|
|
|
1 7 рН
Кожний ензим діє за оптимального рН.
Для ензиму Е1 оптимальне рН1, а рН2
– для Е2.
27
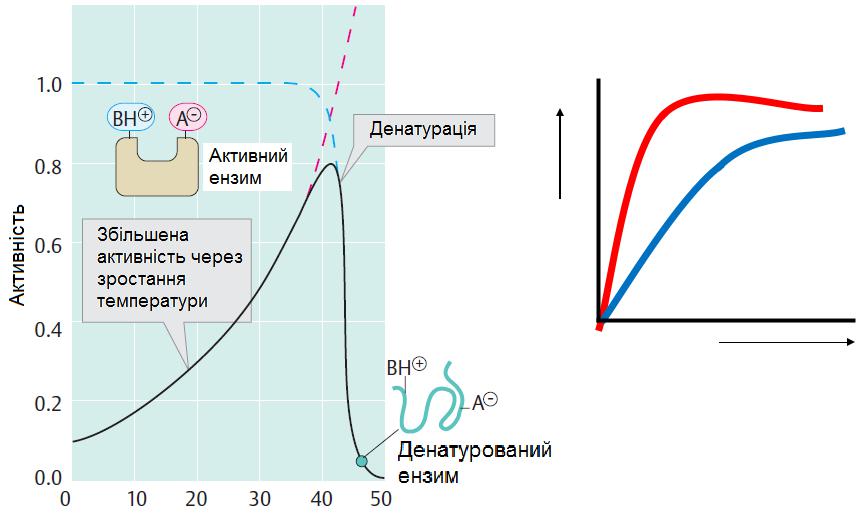
Залежність активності ферменту від температури
37 0 C
25 0 C
P
час
Температура (°) |
28 |
|
Активатори та інгібітори ферментативної реакції – це сполуки, які її прискорюють і уповільнюють відповідно.
Активатори збільшують швидкість ферментативної реакції, сприяючи формуванню активного центра (найчастіше цю роль виконують такі метали, як Mg2+, Zn2+, Мn2+, Со2+).
Активація алостеричних ферментів, які складаються з субодиниць, є найважливішим процессом контролю поліферментных систем.
Зазвичай активація алостеричних ферментів
досягається за рахунок їх взаємодії з різними органічними сполуками.
29

Дігідрофолатредуктаза із E. coli із двома своїми субстратами,
дигідрофолатом
(справа) і NADPH (зліва), зв'язані в активному центрі. Протеїн представлений у вигляді стрічкової діаграми, з альфаспіралями (червоним), бета-складками (жовтим) і петлями (голубим).
30
