
2015-СК-біохімія-14-Обмін білків-ІКТ-ч 1
.pdf
Національний університет біоресурсів і природокористування України
Змістовий модуль 4. Обмін речовин і його регуляція Лекція 7 Перетравлення білків (1)
Лектори :
Мельничук Д.О., д.б.н., професор, академік НАН України і НААН Мельничук С.Д., д.б.н., професор, член кореспондент НААН
Калачнюк Л.Г., д.б.н., професор,
Калачнюк Г.І., д.б.н., професор К. 409, 419, 421, 4-й поверх,
1
Корпус № 12 НУБіП України

Змістовий модуль 4. Обмін речовин і його регуляція
Лекція 7
Перетравлення білків
План
1.Білки повноцінні і неповноцінні. Незамінні амінокислоти
2.Перетравлення білків. Протеоліз
3.Переамінування, дезамінування, декарбоксилування амінокислот
4.Орнітиновий цикл утворення сечовини
2

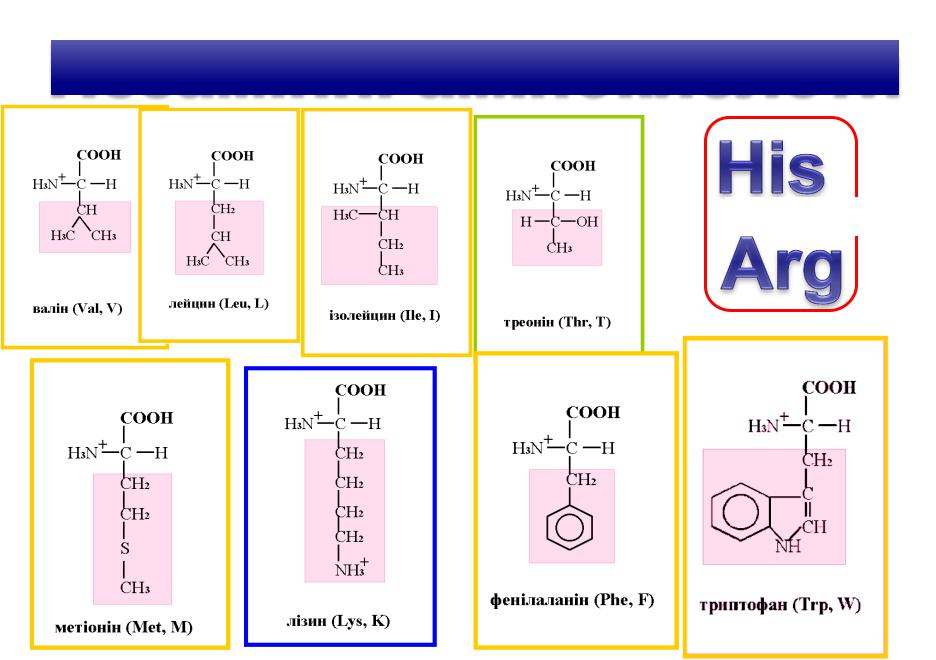
1. Білки повноцінні і неповноцінні. Незамінні амінокислоти
Білки повноцінні і неповноцінні
Повноцінні білки мають всі незамінні амінокислоти у
достатній кількості, а в неповноцінних білків присутні не всі незамінні амінокислоти або їх є в недостатій кількості.
Повноцінними вважаються білки тваринного походження і окремі рослинні білки (бобових культур і картоплі), а інші рослинні білки – неповноцінні.
Біологічна цінність білків визначається їхньою засвоюваністю і відповідністю амінокислотному складові білків людини. Засвоюваність білків материнського молока ~ до 100%, яловичини - 93%, хліба - 30%.
У відмінності від жирів і вуглеводів резервів білка в організмі немає. Відносним резервом вважаються білки крові (альбуміни), шкіри, печінки, м'язів.
Вміст білка в продуктах харчування:
хліб - 8-10%; тверді сири – 20-35%; горох – 26%; м'ясо – 22%; картопля –
1-2%.
У сої є до 36% білка, однак у сирому соєвому білку наявні інгібітори
трипсину (тому сою піддають термічній обробці). |
3 |
|
для дітей
4
2.Перетравлення білків. Протеоліз
Уротовій порожнині білки не перетравлюються.
Ушлунку діють протеази родини пепсину. (його профермент – пепсиноген, активується НCl через відщеплення олігопептиду, яким заблокований активний центр ферменту). Оптимум рН для дії пепсину 1,5-2,0. Пепсин – ендопептидаза, яка у всередині молекули білків гідролізує пептидні зв'язки, утворені ароматичними амінокислотами. Під дією пепсину білки руйнуються з утворенням суміші пептидів (альбумози і пептони).
Ушлунковому соці є й інші протеази – ренін («згортає» молоко), желатиназа (гідролізує желатин) і амінопептидаза (екзопептидаза).
HCl створює оптимальне середовище для дії пепсину (рН = 1,5-2) і активує його; денатурує харчові білки, підсилюючи їх гідроліз; активує синтез секретину, має сильну бактерицидну дію; сприяє всмоктуванню Феруму.
Удванадцятипалій кишці кислий вміст шлунка нейтралізується бікарбонатами підшлункової залози до слабколужного середовища (рН 7- 7,5). Розщеплення білків відбувається за участю пептидаз підшлункового соку (ендопептидази: трипсину, хімотрипсину, колагенази і еластази
та екзопептидази – карбоксипептидази). Вони виділяються в неактивному стані, чим запобігається руйнування панкреатических клітин, у яких відбувається їх синтез. Трипсиноген активується ферментом слизової кишечника – ентерокіназою, а трипсин, що утворився, каталізує активацію
інших проферментів. |
5 |
|

6
Адаптовано за Кольман Я., Рем К.-Г. Наглядная биохимия, 2009.

синтез білків 300-400 г/день
день/г 400-300 білків протеоліз
Метаболізм білків
Спожиті з їжею білки спершу руйнуються у шлунковокишковому тракті до амінокислот, які ресорбуються і розносяться по організму через кровоносні судини.
Тіло людини не здатне синтезувати 8 – 10 амінокислот з 20 протеїногенних амінокислот.
Ці амінокислоти є незамінними і вони мають надходити з
їжею в організм.
7
Адаптовано за Кольман Я., Рем К.-Г. Наглядная биохимия, 2009.
У товстому кишечнику причиною гниття білків є діяльність мікроорганізмів, які розщеплюють амінокислоти на продукти, що не утворюються в тканинах за нормальних умов: аміак (NH3), метан (СН4), H2S, меркаптани, індол, скатол, крезол, фенол, кадаверин, путресцин.
Диаміни (путресцин і кадаверін) знешкоджуються диаміноксидазою кишечника та печінки. Знешкодження інших продуктів гниття відбувається в печінці шляхом кон`югації.
Бензойна кислота зв`язується з гліцином з утворенням гіпурової кислоти. Визначення кількості гіпурової кислоти в сечі (після введення бензойної кислоти) дозволяє оцінити антитоксичну функцію печінки.
Продукт гниття триптофану індол кон`югує з сульфатом і перетворюється на індикан (калієва сіль індоксилсірчаної кислоти). За рівнем індикану в сечі можно визначити інтенсивність процесів гниття в кишечнику.
8
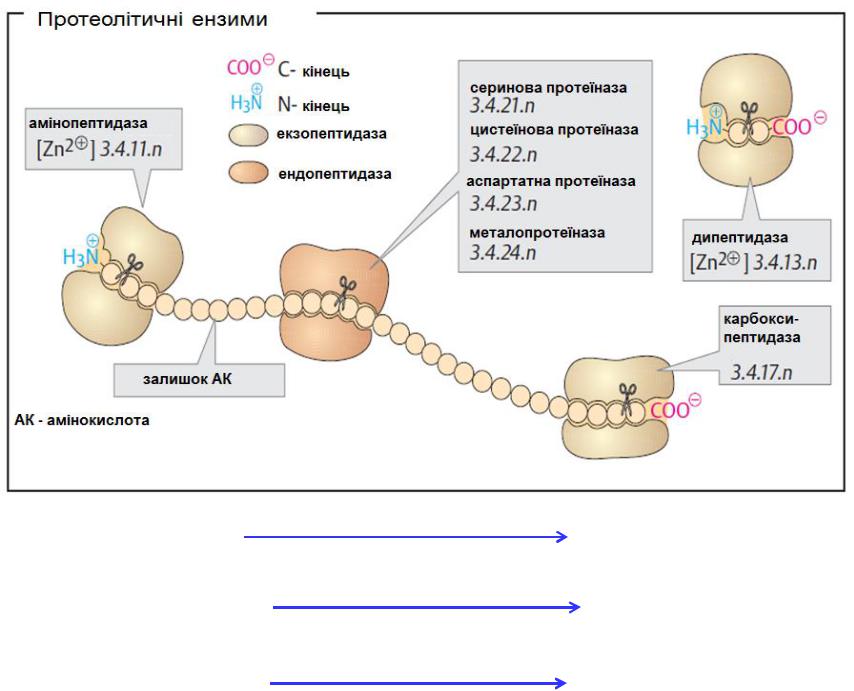
Протеоліз
Протеолітичні ензими
Комбінації з кількох ензимів з різною специфічністю є необхідними для повної деградації (розщеплення) протеїнів на вільні амінокислоти.
Протеолітичні ензими поділяються на ендо- і екзопептидази згідно їхніх сайтів розщеплення в субстратній молекулі. Ендопептидази чи протеїнази розрізають пептидні зв'язки всередині пептидних ланцюгів. Вони «розпізнають» і зв'язуються з короткими секціями амінокислотної послідовності білка-субстрату, щоб потім гідролізувати зв'язки між певними амінокислотними залишками у відносно специфічний спосіб.
Протеїнази класифікуються за їх реакційним механізмом. Наприклад, для серинових протеїназ є важливим залишок серину у ферменті для каталітичної дії, а для цистеїнових протеїназ – цистеїну і т.д.
Екзопептидази атакують пептиди із їх кінців. Пептидази, які діють з N-кінця відомі, як амінопептидази, тоді як ті, що розпізнають C- кінець називаються карбоксипептидазами.
Дипептидази гідролізують тільки дипептиди.
9
|
Адаптовано за Кольман Я., Рем К.-Г. Наглядная биохимия, 2009. |
||
Трипсиноген |
ентерокіназа |
Трипсин (активний) |
|
|
|
||
Хімотрипсиноген |
трипсин |
хімотрипсин (активний) |
|
|
|||
Проеластаза |
трипсин |
еластаза (активний) |
10 |
|
|||
