
2015-СК-біохімія-14-Обмін білків-ІКТ-ч 1
.pdf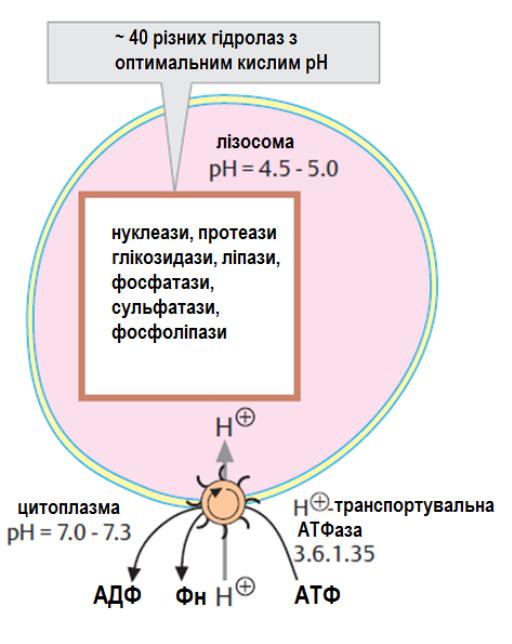
Внутрішньоклітинний протеоліз білків відбувається в лізосомах.
Крім |
того |
білкові |
комплекси |
в цитоплазмі, |
|
відомі як |
протеосоми, де |
|
руйнуються неправильно укладені або «старі» білки.
Ці молекули упізнаються за спеціальним «маркуванням»/ «міченням».
Протеосоми також відіграють важливу роль у представленні антигенів імунними клітинами.
11
Протеосома
Функціональні протеїни у клітині захищаються від деградації до «дозрівання» (до стану повного формування). Деякі з внутрішньоклітинних активних протеолітичних ензимів знаходяться в лізосомах. Протеїнази, які діють тут, також відомі як катепсини.
Інша регульована система для деградації білків є розташованою в цитоплазмі і містить великі білкові комплекси (масою 2 106 Дa), що називаються протеосомами. Протеосоми мають бочковоподібне ядро, яке складається із 28 субодиниць із коефіцієнтом седиментації 20S.
Протеолітична активність (показана у вигляді «ножиць») локалізується у внутрішньому 20S ядрі і тому є захищеною. Відкривання у бочковидному ядрі є прикритим 19S частками зі складною структурою, що контролює вхід до ядра.
12
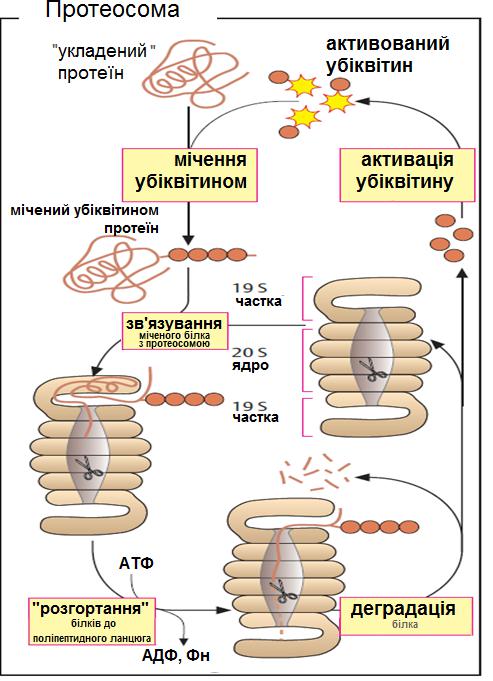
Призначені для деградації протеїни у протеосомі (неправильно укладені протеїни або «старі»
молекули) |
мітяться |
ковалентним зв'язуванням із ланцюгами невеликого білка
убіквітину.
Убіквітин попередньо активується введенням активних тіоефіриних груп.
Мічені убіквітином молекули («убіквітиновані») упізнаються 19S часткою, розгортаючись за використання АТФ, і далі зрушуються всередину ядра, щоб бути деградованими.
Убіквітин не деградується, але використовується знову після активації. 13
Адаптовано за Кольман Я., Рем К.-Г. Наглядная биохимия, 2009.
Білки постійно «використовуютьсявитрачаються» в кишечнику та в меншій мірі – в нирках.
Для підтримки рівноваги протеїнових витрат і життєдіяльності організму необхідно, як мінімум, споживати з їжею 30 г білків на день.
Кількість амінокислот у вільному стані не перевищує 100 г на день у організмі людини. Вони
використовуються в біосинтезі чи їх деградації в печінці.
Нітроген з надлишку аиінокислот перетворюється в сечовину та виділяється сечею.
Карбонові ланцюги амінокислот використовуються в синтезі вуглеводів або ліпідів, або для синтезу АТФ.
14
3. Переамінування, дезамінування, декарбоксилування амінокислот
|
|
Схема загальних шляхів |
||
Корм / їжа |
|
|||
|
перетворення амінокислот |
|||
|
|
|||
|
|
|||
|
|
|
|
|
Пул |
|
Безазотисті метаболіти |
|
|
|
гліколізу і ЦТК |
|
||
амінокислот |
|
|
||
|
|
|
||
|
|
Анаболічні процеси |
|
|
|
Катаболічні процеси |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Синтез |
|
Синтез ФАС |
|
трансамі- |
|
дезамі- |
|
|
декарбокси- |
||||||||
клітинних та |
|
білкової та |
|
нування |
|
нування |
|
|
|
|
лювання |
||||||
позаклітинних |
|
пептидної |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
біогенні |
||||||
білків |
|
будови |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аміни |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Білки і пептиди |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Сечовина, СО2, Н2О |
|
|
|
|
||||||||
|
|
організму |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ФАС – фізіологічно активні сполуки; Суцільні стрілки – реакції використання амінокислот у метаболічних процесах; «пунктирні» 15 стрілки – реакції надходження амінокислот у їх загальний пул
16
Адаптовано за Кольман Я., Рем К.-Г. Наглядная биохимия, 2009.
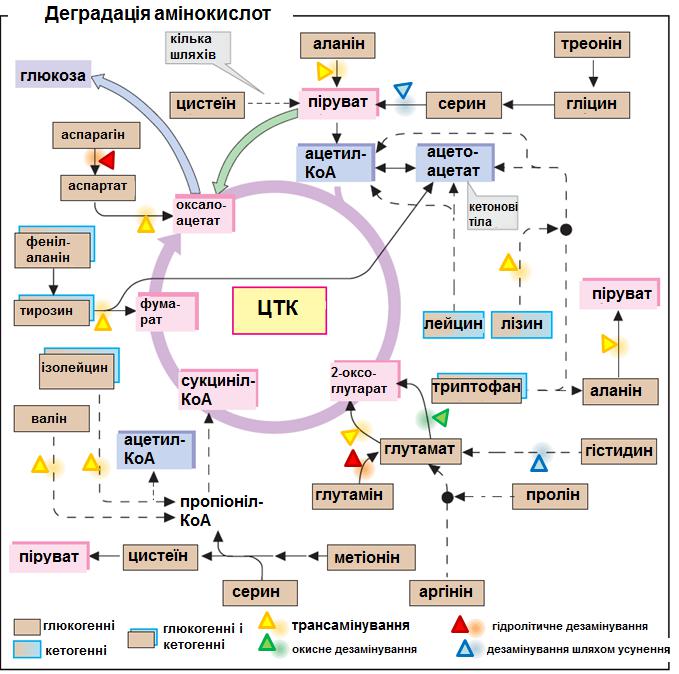
Проміжний обмін амінокислот
Це сукупність всіх реакцій метаболізму амінокислот, що ведуть до утворення кінцевих продуктів обміну або до перетворення амінокислот на інші речовини (гем, основи ДНК та ін.). До головних процесів проміжного обміну амінокислот відносять: 1) переамінування (трансамінування), 2) дезамінування та 3) декарбоксилювання.
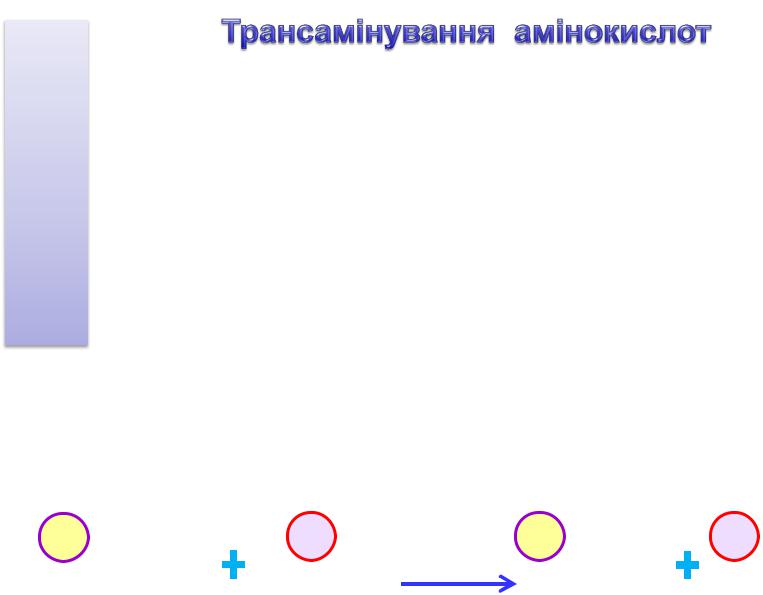
1. Переамінування (трансамінування) – це перенос аміногрупи від α-
амінокислоти на α-кетокислоту з утворенням нових α-аміно-та α-кетокислот. Процес каталізується амінотрансферазами (трансаміназами), які використовують як кофермент – піридоксальфосфат (ПАЛФ) – похідне вітамину В6.
Біологічна роль переамінування (трансамінування):
а) синтез транспортних форм аміаку; б) синтез замінних амінокислот.
Найбільшу активність мають аланінамінотрансфераза (АлАТ) та аспартатамінотрансфераза (АсАТ).
2. Дезамінування амінокислот – це відокремлення аміногрупи від амінокислоти у вигляді аміаку. Є 4 типи дезамінування: окиснювальне (частіше такому дезамінуванню підлягає глутамінова кислота); гідролітичне (наприклад, дезамінування АМФ, глутаміну); внутрішньомолекулярне (дезамінування гістидину до урокаїнової кислоти); відновлювальне
(наприклад, дезамінування ГМФ); |
17 |
|
Окислювальне дезамінування глутамату. Це один з важливих шляхів
утворення аміаку в організмі, оскільки глутамінова кислота є транспортною формою аміаку. Дезамінування відбувається в два етапи (ферментативний і неферментативний): 1) утворюється α-іміноглутарат за участі НАД-залежної глутаматдегідрогенази, 2) неферментативний гідроліз призводить до утворення α-кетоглутарату і аміаку.
3. Декарбоксилювання амінокислот – це відщеплення карбоксильної групи від амінокислоти у вигляді СО2. В результаті декарбоксилювання амінокислот утворюються біогенні аміни.
Наприклад, норадреналін і адреналін – утворюються при гідроксилюванні і подальшому декарбоксилюванні тирозину. Вони звужують кровоносні судини і
підвищують артеріальний тиск; збільшують частоту і силу скорочень м`язів; підвищують
рівень глюкози та жирних кислот в крові (підсилення розпаду глікогену в печінці та м`язах і розпаду жирів в тканинах. Дофамін є нейромедіатором.
Інактивація біогених амінів відбувається їх дезамінуванням за участі ФАД-залежної моноамінооксидази (МАО). При паркінсонізмі знижується кількість дофаміну, а при депресії - рівень норадреналіну, тому для підвищення їх концентрації в мозку використовують ліки інгибітори МАО. Інгибітори синтезу поліамінів використовують для пригнічення росту пухлин.
18
І |
і |
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
||
с |
Вперше у 1937 р. А.О. Браунштейн і М.Г. Крицман описали процес |
||||||||
|
ф |
||||||||
т |
трансамінування і ферменти. Згодом А.О. |
Браунштейн |
і М.М. |
||||||
о |
о |
Шемякін запропонували теорію піридоксалевого каталізу. |
|
||||||
р |
|
||||||||
р |
м |
А.О. Браунштейн народився в |
Харкові, |
закінчив |
Харківський |
||||
медичний інститут, працював в Інституті біологічної і медичної хімії |
|||||||||
и |
а |
||||||||
АМН СРСР, Інституті молекулярної біології АН СРСР. |
|
|
|||||||
ч |
ц |
|
|
||||||
|
|
|
|
|
|
|
|||
н |
і |
У реакції трансамінування в основному |
вступають |
||||||
а |
глутамінова, аспарагінова кислоти і, в |
окремих випадках, |
|||||||
|
я |
аспарагін і аланін. Однак цей процес може відбуватися за |
|||||||
|
|
||||||||
|
|
участю |
інших |
амінокислот. |
Переамінування |
||||
|
|
(трансамінування) – це основна біосинтетична реакція |
|||||||
|
|
замінних |
амінокислот, |
яка |
відбувається |
за |
участі |
||
кофермента, роль якого відіграє піридоксальфосфат.
R1- CH-COOH |
|
|
|
|
|
R2- C-COOH |
R1- C-COOH |
|
|
|
R2- CH-COOH |
||
| |
|
|
|
|
|
|| |
|| |
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
||||
HNH |
|
|
|
|
|
O |
O |
|
|
HNH |
|||
|
|
|
|
|
|
|
|
|
|
|
19 |
||

(1) Аланінамінотрансфераза – АлАТ або АлТ (ALT), або глутаматпіруваттрансаміназа (ГПТ)
L-аланін + α-кетоглутарат ↔ піруват + L-глутамат
(2) Аспартатамінотрансфераза – АсАТ або АсТ (AST), або глутаматоксалоацетаттрансаміназа (ГОТ)
L-аспартат + α-кетоглутарат ↔ оксалоацетат + L-глутамат
(3) Тирозинамінотрансфераза
L-тирозин + α-кетоглутарат ↔ р-гідроксифенілпіруват + L-глутамат
(4) Лейцинамінотрансфераза
L-лейцин + α-кетоглутарат ↔ α-кетоізокапроат + L-глутамат
20
