
2015-СК-біохімія-07-Ензими-ІКТ-додатково
.pdf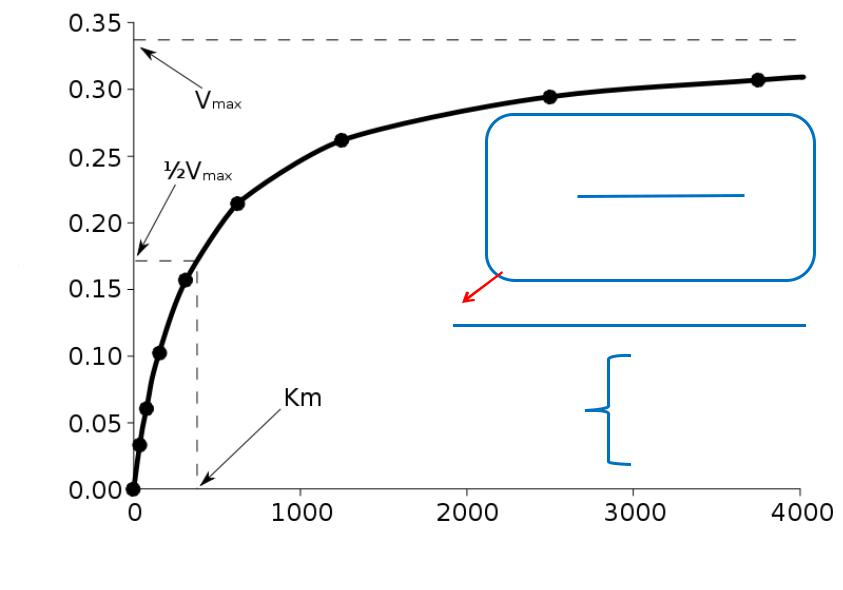
Швидкість реакції (V)
V=Vmax∙[S]
KM + [S]
|
рівняння Міхаеліса-Ментен |
||
|
одиниці |
Км {моль/л} |
|
КМ |
|||
|
|||
|
вимірювання |
Vmax {моль/(л∙сек)} |
|
|
|||
|
|
||
Концентрація субстрату ([S])
Крива насичення ензиму субстратом, що характеризує залежність між концентрацією субстрата і швидкістю
ензимної реакції |
21 |
|
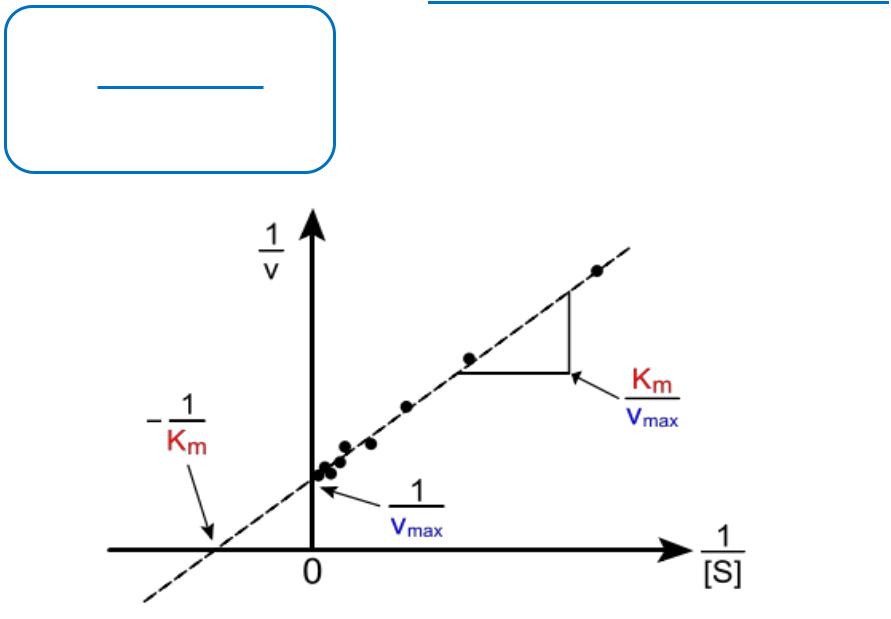
Переведення рівняння Міхаеліса-Ментен
V=Vmax∙[S] |
||
K |
M |
+ [S] |
|
|
|
 у лінійний графік y=a + bx (рівняння прямої лінії)
у лінійний графік y=a + bx (рівняння прямої лінії)
y=1/ v; a=1/Vmax; b=Km/Vmax; x=1/[S]
Графік Лайнувера-Берка
 α
α
=tgα
22
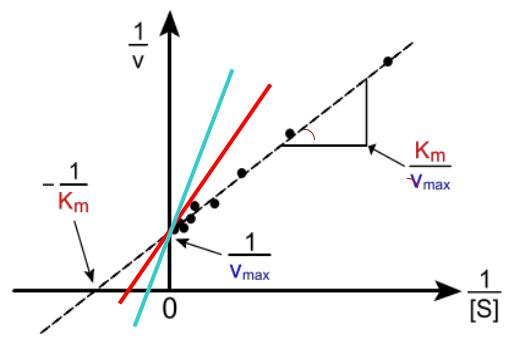
Графік Лайнувера- Ia<Ib Берка
=tgα
Конкурентне інгібування відбувається за впливу інгібітора з нижчою спорідненістю, ніж субстрат.
Додавання більшої кількості субстрату відновлює ензимну активність.
23
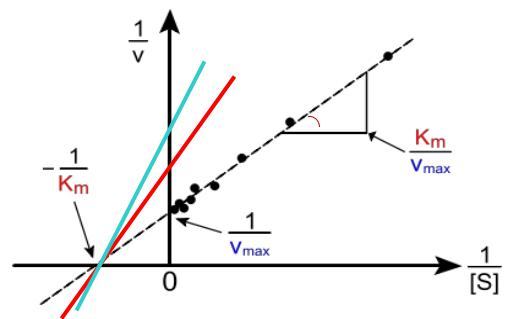
Лайнувера-Берка Ia<Ib графік
=tgα
Неконкурентне інгібування відбувається за дії інгібітору, який зв'язується з ензимом в іншому місці, ніж субстрат.
24
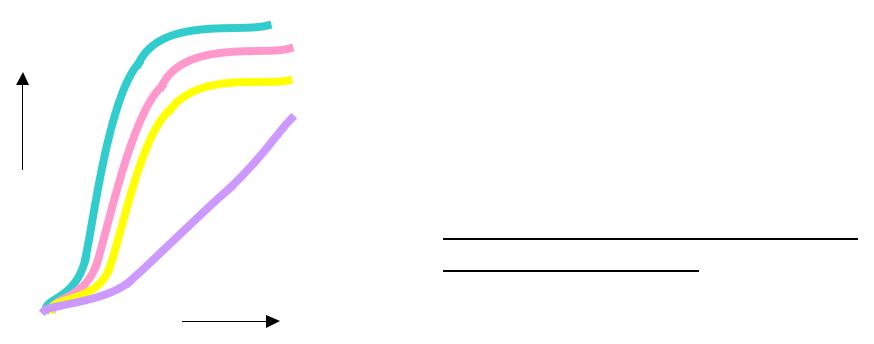
Алостерична регуляція :
її кінетика - відмінна від кінетики МіхаелісаМентен (тому її називають «не МіхаелісаМентен» кінетикою)
Звичайний ензим
|
Алостеричний ензим з активатором |
|
||
|
|
|||
|
Алостеричний (регуляторний) ензим |
|
||
|
Алостеричний ензим з інгібітором |
|
||
|
|
Рівняння |
Хіла |
часто |
V |
|
використовується |
для |
|
|
|
опису кількісного ступеня |
||
|
|
кооперативності у |
«не |
|
|
|
Міхаеліса-Ментен» |
|
|
|
[S] |
кінетики. |
|
|
Похідна коефіцієнта Хіла n вимірює як багато зв'язується субстрату до одного активного сайту, що впливає на звязування субстрату з іншими активними сайтами. Коефіцієнт Хіла від <1 вказує
на негативну кооперативність, а коефіцієнт від >1 25
вказує на позитивну кооперативність

Серинові протеази є дуже поширеними ферментами, включаючи травні ферменти (трипсин, хімотрипсин і еластаза), кілька ензимів каскаду згортання крові та ін.
26
Ензимні методи використовують для вимірювання швидкості реакції.
Оскільки ензими не знищуються реакціями, які вони каталізують, то за ензимними методиками зазвичай вивчають зміни у концентраціях
субстратів чи продуктів реакції з метою вимірювання швидкості ензимної реакції.
27

Є багато методів вимірювання активності ензимів. Спектрофотометричними методами спостерігають зміну в оптичній густині світла між продуктами і реагуючими речовинами; радіометричні методи базуються на основі включення і звільнення радіоактивності з метою вимірювання продукту через певний час.
DU640 спектрофотометр |
28 |

Спектрофотометри чні методи є найзручнішими через те, що дозволяють вимірювати швидкість реакції постійно.
Кювето
тримач
(каретка для кювет)
29

Оскільки радіометричні методи потребують видалення і обчислення проб (наприклад, у швидкоплинних дослідах), то вони є дуже чутливими і з допомогою них можна вимірювати досить низькі рівні активності ензимів.
Аналогічним підходом є використання масспектрометрії для моніторингу включення або ж вивільнення стабільних ізотопів у вигляді субстрату, який перетворено у продукт.
30
