
2015-СК-біохімія-07-Ензими-ІКТ-додатково
.pdf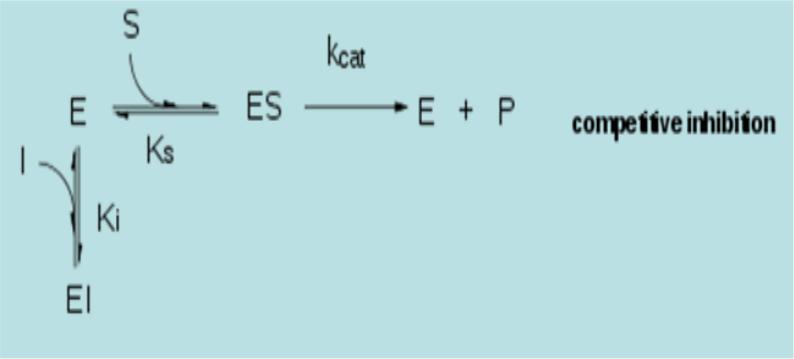
Конкурентне |
інгібування. |
Інгібітор і субстрат конкурують за ензим (вони не зв'язуються в один і той же час).
Конкурентне інгібування
11

Ензимна реакція
Е – ензим, S – субстрат, Р – продукт
 активний центр
активний центр
Конкурентне інгібування
Е – ензим, S – субстрат, І – інгібітор
активний |
|
|
центр |
Конкуренція І та S |
12 |
|
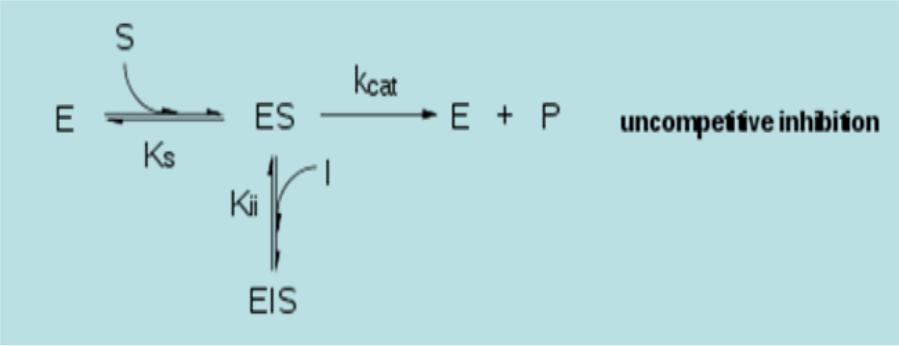
Неконкурентне інгібування. Інгібітор не звязується з вільним ензимом, а звязується із ESкомплексом. Утворений EIS-комплекс є ензимно неактивним. Це рідкісний тип інгібування, але трапляється у мультиферментних ензимів.
Неконкурентне інгібування
13
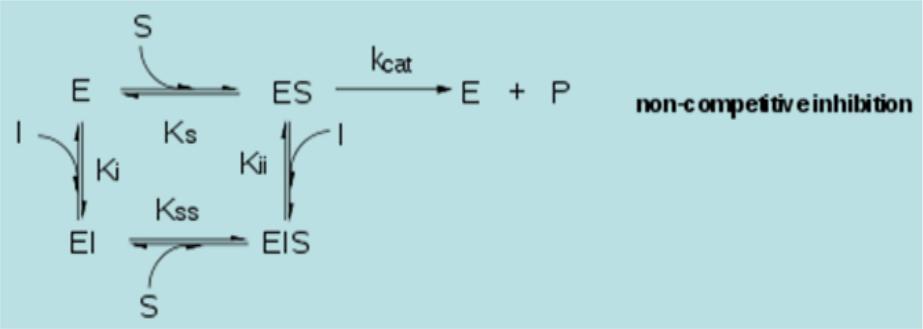
Нон-конкурентне інгібування. Інгібітори можуть зв'язуватися з ензимом у зв'язувальному сайті у той же час, що і субстрат, але не в активному сайті фермента. Обидва EI і EIS комплекси є ензиматично неактивними. Оскільки інгібітор не може видалитися за вищої концентрації субстрату (як у конкурентного інгібування), то явно Vmax змінюється. Але, якщо субстрат може залишатися зв'язаним з ензимом, то Kм залишається такою ж.
Нон-конкурентне інгібування
14
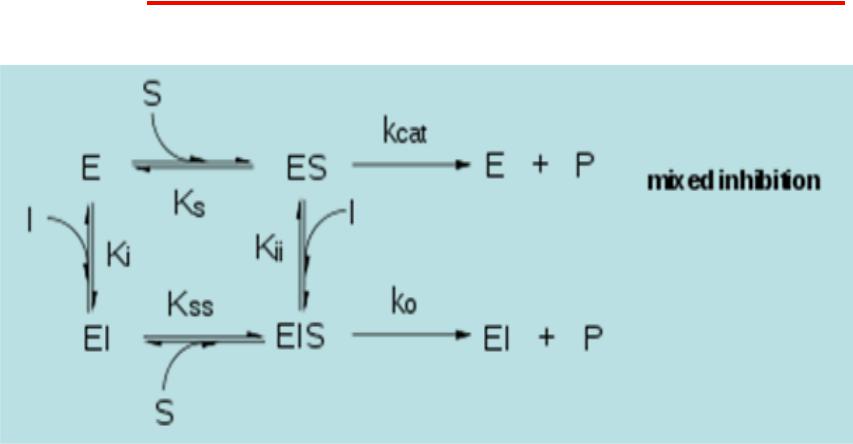
Змішане інгібування. Цей тип нагадує нон-
конкурентне інгібування, окрім того, що EIS-комплекс має залишкову ензиматичну активність. Цей тип інгібітору не узгоджується з кінетикою Міхаеліса- Ментен.
Змішане інгібування
15
Типи ензимних реакцій
Необоротна реакція з одним субстратом
Оборотна реакція з одним субстратом
Необоротна реакція з двома субстратами
Оборотна реакція з двома субстратами і т.д.
16

Кінетична схема для оборотних ензимних інгібіторів
Інгібітори ензимів – молекули, які знижують або повністю гальмують ферментативну активність, а активатори ензимів діють навпаки. Ці взаємодії можуть бути або оборотними (тобто видалений інгібітор відновлює ензиматичну активність), або необоротними (тобто інгібітор постійно інактивує фермент).
17
Односубстратні реакції
До ензимів з односубстратними механізмами реакцій відносять такі ізомерази, як тріозофосфатізомераза або біфосфогліцератмутаза, а також такі внутрішньомолекулярні ліази, як аденілатциклаза і рибозим – РНК-ліаза
Якщо ензим-каталізовані реакції насичуються, то їх каталітична швидкість не змінюється лінійно відповідно субстрату.
Якщо швидкість реакції вимірюється за понад норми субстратної концентрації (позначеної [S]), то початкова швидкість (v0) зростає із зростанням
[S].
Однак, із підвищенням [S] ензим стає насиченим, а швидкість досягає Vmax, максимальної її величини.
18

Вивчення ензимної кінетики є важливим з двох причин.
По-перше, це допомагає пояснити як працюють ензими, і по-друге, дає змогу передбачити як ензими будуть діяти у живих організмах.
Кінетичні константи: KM (константа Міхаеліса) і Vmax(максимальна швидкість), є критичними для розуміння того, як ензими працюють разом з метою контролю метаболізму.
19
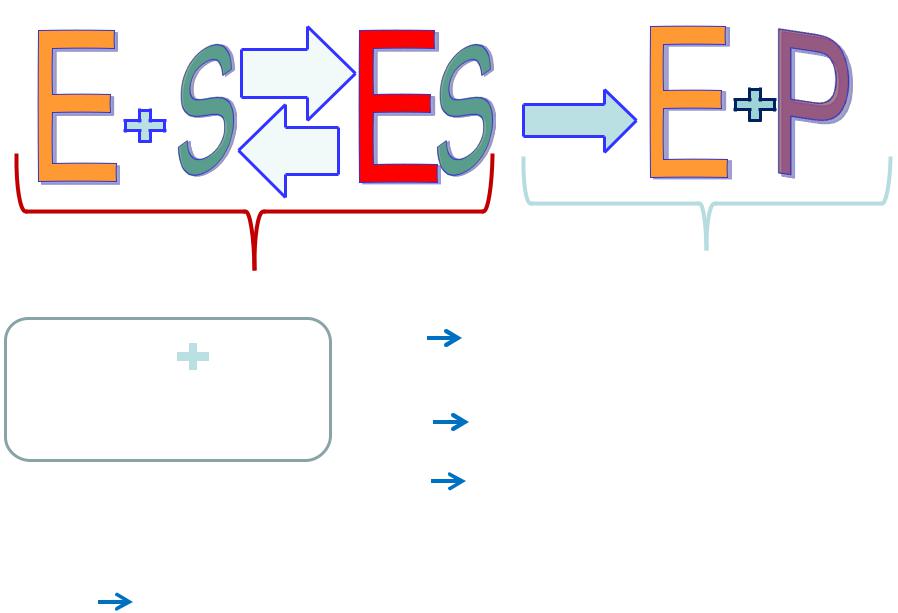
Для односубстратної ензимної реакції:
k+1 |
k |
|
+2 |
k-1
|
Зв'язування субстрату |
|
Каталітична стадія |
|||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k+1 |
|
константа швидкості утворення ES |
||
K = k-1 |
|
|
|
k+2 |
|
(ензим-субстратного комплексу) |
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k+1 |
k-1 |
|
|
|
|||||
|
|
константа швидкості розпаду ES |
|
|||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
k+2 |
|
константа швидкості розпаду ES |
|
|
|
|
|
|
|
|
|
на Е і продукт (Р) |
|
||
KM |
константа Міхаеліса показує |
повну |
|
характеристику ензимного процесу |
|
20 |
|
|
|
|
|
|
|
|
|
