
аналитика
.doc-
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов.Отвечает на вопрос – какие в-ва входят в обьект. Цель качественного анализа- обнаружение определенных вещ-в или их компонентов в анализируемом объекте. Реакции должны быть как можно более селективны(с несколькими компонантами) и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы. Если обьект новый, о нем ничего не известно, то в начале выполняют качественный анализ, а потом кол-й. Выпадение белого осадка:
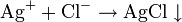 . Основные
типы химических реакций в аналитической
химии:
кислотно-основные, комплексообразования,
окисления-восстановления. Аналитические
реакции- они
сопровождаются внеш. визуальным
видом(осадок, окраска, выделение газа).
Образование окрашенных
растворов:Fe(3+)+3SCN(-)=Fe(SCN)3(кроваво-кр.)
Обьекты могут находится в твердом
состоянии и жидком, т.е. «сухим» и
«мокрым» путем. Окрашивание пламени:
Na-желтый,K-фиолетовый,Rb-малиновый,B-зеленый,B-зеленый,Pb-голубой.
«Мокрый»-чаще используется.
. Основные
типы химических реакций в аналитической
химии:
кислотно-основные, комплексообразования,
окисления-восстановления. Аналитические
реакции- они
сопровождаются внеш. визуальным
видом(осадок, окраска, выделение газа).
Образование окрашенных
растворов:Fe(3+)+3SCN(-)=Fe(SCN)3(кроваво-кр.)
Обьекты могут находится в твердом
состоянии и жидком, т.е. «сухим» и
«мокрым» путем. Окрашивание пламени:
Na-желтый,K-фиолетовый,Rb-малиновый,B-зеленый,B-зеленый,Pb-голубой.
«Мокрый»-чаще используется. -
МЕТОДЫ качественного анализа делятся на химические, физико-химические и физические.Физические методы основаны на изучении физ. св-в анализируемого вещ-ва. К этим методам относятся спектральный и др.В физико-химических методах течение реакции фиксируется измерением определенного физ. св-ва исследуемого р-ра. К этим методам относятся полярография, хроматография и др.К химическим методам относятся методы, основанные на использовании хим. св-в исследуемых вещ-в.В хим. методах качест. анализа используются только аналит. реакции. Аналитические реакции- они сопровождаются внеш. визуальным видом(осадок, окраска, выделение газа). Выпадение белого осадка:
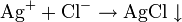 . Способы: обьекты могут находится в
твердом состоянии и жидком.
«Сухие»-окрашивание пламени, образование
свободных металлов и т.д. Окрашивание
пламени:
Na-желтый,K-фиолетовый,Rb-малиновый,B-зеленый,Pb-голубой.
«Мокрый»-чаще используется. В зависимости
от кол-ва обьекта сущ.:макроанализ0,1,
микроанализ<0,01, субмикроанализ<0.001,
ультроанализ<0,0001, капельный.
. Способы: обьекты могут находится в
твердом состоянии и жидком.
«Сухие»-окрашивание пламени, образование
свободных металлов и т.д. Окрашивание
пламени:
Na-желтый,K-фиолетовый,Rb-малиновый,B-зеленый,Pb-голубой.
«Мокрый»-чаще используется. В зависимости
от кол-ва обьекта сущ.:макроанализ0,1,
микроанализ<0,01, субмикроанализ<0.001,
ультроанализ<0,0001, капельный. -
Дробный метод основан на открытии ионов специфическими реакциями, проводимыми в отдельных порциях исследуемого раствора. Все катионы делят на 3 группы, включающие соответственно s-, р- и d-элементы. В дробном анализе применяют специфические реакции, которые позволяют обнаружить один ион в присутствии всех остальных ионов.Специфических реакций немного. Систематический метод - это последовательное разделение ионов и их открытие. Основан на том, что сначала с помощью групповых реактивов разделяют смесь ионов на группы и подгруппы, а потом в этих подгруппах обнаруживают каждый ион специальными реакциями. Дробный метод лучше чем систематический тем что, можно сэкономить реактивы и время. Но т.к. специфических реакций немного и влияние мешающих ионов нельзя устранить то обращаются уже к систематическому методу анализа.
-
Выполнение каждой аналитической реакции требует соблюдения определенных условий ее проведения, важнейшими из которых являются: концентрация реагирующих веществ, среда раствора, и температура. Напр.чтобы образовался какой-либо осадок, надо с помощью определенного реагента создать условия, при которых получается пересыщенный раствор. В присутствии избытка реагента реакция может не заканчиваться и идти далее. Например, при обнаружении ионов Hg2+ с помощью KI по реакцииHg(N03)2 + 2KI → 4HgI2 + 2KN03 в случае избытка реагента KI вместо осадка ярко-красного цвета Hgl2 образуется раствор в бледно-желтый цвет: HgI2 + 2KI —+ K2[HgI4].
-
Чувствительность химической реакции— наименьшее кол-во вещ-ва, которое можно обнаружить данной реакцией или количественно определить данным методом анализа..Высокочувствительная р-ция-требует небольших кол-в в-в Малочувствительная реакция-р-ция требующая больших содерж. анализ. в-а. Реакция называется специфической, когда позволяет обнаружить один ион в присутствии всех остальных. Специфической, например, на ион аммония является реакция: NH4Cl + KOH → NH3 + KCl + H2O.На чувствительность качественных реакций оказывают влияние такие факторы, как Аммиак обнаруживают по запаху или по посинению красной лакмусовой бумажки, смоченной в воде и помещенной над пробиркой. Селективные реакции(избирательные)-реакции с несколькими компонентами.
6) Методы:1)выпаривание воды- нагревание р-а над пламенем спиртовки, вода начнет испаряться, а объем р-ра уменьшится. По мере выпаривания воды раствор становиться более концентрированным. 2)метод экстракции- перевод компонента в органич. растворителях. Экстракция может быть разовой или непрерывной. 3)метод ионного обмена- это обратимая хим. реакция, при которой происходит обмен ионами между твердым веществом и раствором электролита. Ионный обмен может происходить как в гомогенной среде, так и в гетерогенной, в которой один из электролитов является твёрдым. 4)метод соосаждения- переход в осадок примесей, сопутствующий осаждению основного вещ-ва из р-ра, расплава или пара, содержащих несколько вещ-в. Соосаждение происходит тогда, когда раствор пересыщен в отношении вещ-ва.
-
V реакции-изменение концентрации в-ва в ед. времени(моль/л*сек) Т.к. концентрация непрерывно меняется во времени, то и скорость непрерывно меняется во времени.Факторы, влияющие на скорость реакции:-1) природа реагирующих веществ;-2) Концентрация реагентов. Закон действия масс: скорость гомогенной реакции в каждый момент времени пропорциональна произведению концентрации реагирующих вещ-в, возведенных в некоторую степень.Vпрям.реакции=K[A]^a*[B]^b, где[ ] –исх. молярн. концентр. в-в., K-константа скорости. Каждая реакция имеет свою контанту скорости. Порядок реакции может принимать произвольные значения..3) Зависимость от температуры. Скорость большинства реакций с ростом температуры возрастает, т.к. повышается число активных частиц.
-
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.А2 + В2 ⇄ 2AB. Константа равновесия показывает во сколько раз скорость прям. реакции>или< обратной реакции. К равн.=Кпрям/Кобр. Если константа >1-преобладает прямая, если <1-обратная. К=1-реакция не преобладает.Физ.смысл К: скорость реакции при концентрации реагирующих в-в 1моль /л. Зависит от природы в-в и t. От концентрации не зависит. Кпрям*[A]^a*[B]^b=Кобр.[C]^c*[D]^d
-
З. действия масс показывает как изменять реакции в нужном направлении. Нужно увелич. скорость прямой реакции и уменьшить-обратной. FeCl3+NH4SCN↔Fe(SCN)3(кроваво-кр)+3NH4Cl.
Kравн.=[ Fe(SCN)3]*[ NH4Cl]^3/[ FeCl3]*[NH4SCN]. Для смещения равновесия вправо необходимо увелич. концентрацию исх. в-в. Для смещения равновесия влево необходимо увелич. концентр. продуктов реакции. Факторы влияющие на химическое равновесие: 1) температура- При увеличении температуры хим. равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. 2) давление- При увелич. давления хим. равновесие смещается в сторону меньшего объёма веществ, а при понижении наоборот. 3) концентрация исх. в-в и продуктов реакции- При увелич. концентрации одного из исх. в-в равновесие смещается в сторону продуктов реакции, а при увелич. концентрации продуктов реакции в сторону исх. в-в. Катализаторы не влияют на смещение химического равновесия!
10) КОНСТАНТА РАВНОВЕСИЯ, отношение между концентрациями продуктов реакции и исходных веществ, которое характеризует ХИМИЧЕСКОЕ РАВНОВЕСИЕ ОБРАТИМОЙ РЕАКЦИИ при определенной температуре.Вид К. равновесия зависит от типа хим. реакции.1)кислотно-основные реакции-используется кислоты и основания. К. равновесия используется только для слабых кислот и оснований. Для слабых к-т: HA=H^+ +A^- Kравн=[H]*[A]/[HA] Для сильных кислот:BOH=B+OH Kравн=[B]*[OH]/[BOH] 2)образование осадка(гетерогенные системы) KA(осадок, твердая)=K^+ +A^-(насыщ., жидкая) Kравн=[ K]*[A]/[KA] 3)образование комплексных соед. Kравн=Kобразов. Комплексов=
Kравн обрт. р-ции=Кнестойкости комплекс. Для многоступенчатой хим. реакции сущ. след. равновесия: А+3В=АВ3. 1ступень:А+В=АВ Kравн=[АВ]/[A]*[B] 2ступень: АВ+В=АВ2 Kравн=[AB2]/[AB]*[B] 3)ступень:АВ2+В=АВ1/3 Общая К равновесия::А+3В=АВ2 К общ. равн.=[AB3]/[А]*[B3].
Выод: К общ.равн.хим.реакции=произведению ступ. К.равн.
11) Кравн. зависит от t для реакции протекающих стекловым эффектом. Экзотермические-с выделением тепла,при повешение t равновесие смещаетя влево, т.е. Кравн прямой реакции уменьшается. Эндотермические- с поглащением тепла из внеш. среды,при повышении t равновесие смещается вправо,т.е. Кравн прямой реакции увелич. Для реакции не идущих с тепловым эффектом Кравн не зависит от t.
12) Общая константа равновесия равна произведению ступенчатых констант. Общая хим.реакци::А+3В↔АВ3-многоступ. реакция.:1)ступень А+В↔АВ Кравн=[AB]/[A]*[B]. 2)ступень АВ+В↔АВ2 Кравн= [AB2]/[AВ]*[B]. 3)ступень АВ2+В↔АВ1/3. Общая реакция: А+3В↔АВ2. К общ. равн.=[AB3]/[А]*[B3]. Общая Кравн позволяет определить направление хим. реакции. Пример растворение сульфида Fe в кислоте: FeS+2H^+= Fe^2++H2O. 1стадия: FeS↔Fe^2++S^-. Кравн=[Fe^2+]*[S^-2]/[FeS]. К1=[FeS]=[FE^2+]*[S^-2] 2стадия: S^2++2H+↔H2S. Кравн=[H2S]/Кдис.H2S. Кобщ.=К1*К2=ПРFeS/Кдис.H2S. Чем больше ПР осадка и меньше Кдис образующего электрона, тем полнее идет прямая реакция(растворение осадка)
13) Электролиты, в-ва, в которых в заметной концентрации присутствуют ионы, обусловливающие прохождение эл. тока (ионную проводимость). К слабым электролитам относятся многие органические к-ты и основания в водных и неводных растворителях. Степень диссоциации зависит от природы растворителя, концентрации раствора, температуры и др. факторов. Один и тот же электролит при одинаковой концентрации, но в различных растворителях образует растворы с различной степенью диссоциации.Закон разбавления Освальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается.
14) Электролиты, вещества, в которых в заметной концентрации присутствуют ионы, обусловливающие прохождение эл. тока (ионную проводимость).Бывают сильные и слабые.Сильные электролиты практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорганические соли, кислоты и основания, обладающих высокой диссоциирующей способностью Концентрация ионов в растворах сильных электролитов настолько велика, что начинают проявляться силы межионного взаимодействия. Св-ва электролита, зависящие от числа ионов, проявляются при этом слабее. Активность иона(обозначается а) связана с его концентрацией соотношением: a = fC. где f – коэффициент активности иона. Хим. активность каждого иона зависит от концентрации всех ионов и зарядов. Чем больше эти величины, тем меньше хим. активность каждого иона. Коэф. активности ионов зависят от состава и концентрации р-ра, от заряда и природы иона и ряда др. условий.
15) Общей теории кислот и оснований не существует. Для аналитических целей
используют теорию кислот и оснований Аррениуса. Согласно этой теории, кислоты — это вещества кот. отдают катионы Н, донары. Основания — это вещества кот присоед., акцепторы. В протолитической теории кислоты - это доноры протонов, т.е. в-ва, отдающие протоны. Кислоты обозначаются буквой а. CH3COOH ↔ H+ +CH3COO-. Основания в данной теории обозначаются буквой b. К-ты и основан. могут быть нейтральными-HCl, H2SО4;анионные-HCO3.HSO3;катионные-NH4. Нейтральные-HCl, Y2SO4; Анионные-YCO3, HSO3 ; Катионные-NH4.
16) В выражении Ко= ,где Ко наз. термодинамич. константой равновесия, для идеальных и не идеальных систем зависит от t,давления и природы растворителя. При представлении вместо активностей равновесных концентраций Кр=[C]*[D]/[A]*[B] или К’= получаем концентрационные константы равновесия. На значения концентрационных констант влияет много факторов: на Ко и на К’-t, давление, природа растворителя (К-реальная концентр. константа равновесия, они хар-ют положение равновесия с учетом влияния электростатических взаимодействий К’-условная концентр. константа равновесия, они хар-ют с учетом суммарного влияния электростатических и хим. взаимодействий). Концентрационные константы можно вычислить из термодинамических предварительно рассчитав величины коэф. активности.
17)Водородный
показатель-величина,
характеризующая активность или
концентрацию ионов водорода в растворах.
Водородный показатель обозначается
рН. Водородный показатель численно =
отрицательному десятичному логарифму
активности или концентрации ионов
водорода, выраженной в молях на литр:
pH=-lg[ H+ ] нейтральный р-р рН=7, кислый р-р
рН<7, щелочной р-р рН>7. В воде концентрация
ионов водорода определяется
электролитической диссоциацией воды
по уравнению H2O=H++OH-. Константа диссоциации
при 22° С составляет:
![]() Ио́нное
произведе́ние воды́
— произведение концентраций ионов
водорода Н+ и ионов гидроксида OH− в воде
или в водных растворах
Шкала кислотности растворов:
Ио́нное
произведе́ние воды́
— произведение концентраций ионов
водорода Н+ и ионов гидроксида OH− в воде
или в водных растворах
Шкала кислотности растворов:
|
рН |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
рОН |
14 |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
|
Реакция среды |
Сильно-кислая |
Слабо-кислая |
Нейтра- льная |
Слабо-щело |
Сильно-щелочная
|
||||||||||
|
кислая |
щелочная |
||||||||||||||
18) Кислотно-основные
индикаторы
— органические соединения, способные
изменять цвет в р-ре при изменении
кислотности (pH). Универсальный
индикатор-смесь
нескольких индикаторов, ими пропитывают
полоски «индикаторной бумаги», с помощью
которых можно быстро определить
кислотность исследуемых водных растворов.
Индикаторы широко используют в титровании
в аналитической химии и биохимии.
![]()
Индикаторы обычно используют, добавляя несколько капель водного р-ра. Другой способ применения - использование полосок бумаги, пропитанных раствором индикатора (например, "Универсальный индикатор").
|
Индикатор |
рН раствора |
Цвет индикатора |
|
метилоранж |
4,4>pH <3,1 |
оранжевый |
|
лакмус |
≤5; ≥8 |
Розовый; синий |
|
фенолфталеин |
pH≥10; pH<8 |
Малиновый;бесцветный |
Для определения значения pH растворов широко используют несколько методик. 1)Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH. 2)Аналитический объёмный метод — кислотно-основное титрование. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, окончания реакции. 3) Влияние температуры на значения pH
19) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. а) Соль образована слабой кислотой и сильным основанием: рН>7
б) Соль образована сильной кислотой и слабым основанием: рН<7
в) Соль образована слабой кислотой и слабым основанием:
Протолитическое равновесие при гидролизе солей может быть смещено вправо или влево при изменении температуры, разбавлении р-ра. Типы гидролиза: • гидролиз по катиону (в реакцию с водой вступает только катион); • гидролиз по аниону (в реакцию с водой вступает только анион); • совместный гидролиз (в реакцию с водой вступает и катион, и анион).
20) Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Факторы влияющие на гидролиз солей: -природа соли; -концентрация соли; -t (чем >t, тем >h); -рН среды. Гидролиз солей понижает в качественном анализе их активность. 1)(NH4)2CO3-групп.реагент 2гр. катиона
Концентр. карбонат аммония уменьшается и активность реагента уменьшается. 2)(NH4)2S-групп.реагент 3гр. катиона
Активность сульфида аммония понижается. Применение:-обнаружение ионов BiCL3+H2O ↔Bi(OH)2CL+HCL; Bi(OH)2CL →BiOCL+H2O. Типы гидролиза: • гидролиз по катиону (в реакцию с водой вступает только катион); • гидролиз по аниону (в реакцию с водой вступает только анион); • совместный гидролиз (в реакцию с водой вступает и катион, и анион).
21) Гидролиз солей - это хим.взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Гидролиз может способствовать выполнению реакции, а иногда мешает проведению анализа. Бывают следующие способы подавления и усиления гидролиза солей.1. Прибавление к раствору соли др. электролита, к-ты или осн..Для усиления гидролиза солей добавляют основания для связывания в процессе гидролиза ионов H+. Равновесие реакции смещается в сторону гидролиза соли.Для подавления гидролиза указанных солей к р-ру добавляют к-ты, тогда:В такой ситуации увеличивается кол-во ионов H+ и реакция смещается в обратную сторону, т.е. уменьшается гидролиз соли.
22) Гидролиз солей - это хим. взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита..Гидролиз солей является обратимой химической реакцией. Количественными характеристиками его являются степень гидролиза (h) и константа гидролиза (Кг). h- показывает, какая часть соли прогидролизовалась,т.е. превратилась в свои составляющие;измеряется в %или долях единицы. Степень гидролиза не является константой. Кг-константа равновесия обратимой реакции. Зависит от t, но не зависит от концентрации р-ра. Кг=К(Н2О)/К дисс.к-ты*К дисс.осн. Степень гидролиза – отношение числа гидролизированных молекул к общему числу растворенных молекул; h= (Сгидр/Собщ)·100 %, где где Сгидр — число молей гидролизованной соли, Собщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Водоро́дный показа́тель, pH— мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: pH=-Lg[H+]
23) Буферными системами наз. р-ры, сохр. Постоянный рН, при добавлении в р-р или при разбавлении сильных к-т или оснований. Способность сохранять постоянное значение рН наз. буферным действием. Бывают: а)кислые-из слабых к-т и их солей(ацетатный); б)основные-из слабых оснований и их солей(аммиачный). Один компонент нейтрализует добавленную к-ту, второй-в добавляемую щелоч. Буферы могут быть кислыми, щелочными или нейтральными, напр.,фосфатный буфер, карбонатный. Для кислого буфера:рН=рКк-ты-LgСк-ты/Соли. Для щелочного буфера:рН=14-рКосн+LgСосн/Соли. Буферы-это двухкомпонентные системы. Буферные р-ры нужны для создания рН. Каждый буфер имеет опред. рН.
24) Каждый буфер имеет опред. рН зависящий от концентрации компонента и их обьемов. рН(кислого буф.)=рКк-ты-Lg *Ню к-ты/Ню соли. рН(щелочного буф.)=14-рКосн.+ Lg*Ню осн/Ню соли
Ацетатный буфер: CH3COOH ↔ CH3COO+H CH3COONa ↔ CH3COO+Na
1. Добавим небольшое кол-во NaOH(сильная щёлочь)
NaOH+CH3COOH → CH3COONa+H2O
2. Добавляем небольшое количество HCL(сильная к-та)
HCL+CH3COONa ↔ CH3COOH+HCL
3. Добавляем небольшое количество NaOH(щёлочь)
NaOH(сильное)+NH4C(очень слабое)L→ NH4OH+NaCL
4. Добавляем небольшое количество HCL(сильная кислота)
HCL(сильная)+NH4OH(соль) ↔ NH4CL+Н2О. Буферы могут быть кислыми, щелочными или нейтральными. Примеры буферов: 1)фосфатный NaH2PO4( к-та слабая) и Na2HPO4(соль)
H2PO4 ↔ H+HPO4
Na2HPO4 → 2Na+HPO4 2)карбонатный NaHCO3-слабая кислота и Na2CO3-соль
Каждый буфер имеет определённую ёмкость. При добавлении больших количеств кислот и оснований к буферу, его рН может изменяться.Буферная ёмкость-это кол-во (моль) сильной к-ты или сильного осн, которое необходимо добавить к 1 л буфера, для изменения его рн на 1. Чем больше концентрация компонента, тем больше буферная ёмкость.Оптимальное соотношение между компонентами 1:1
25) Буферы-это двухкомпонентные системы.Наиболее распространены ацетатный и аммиачный. Применяется для создания и поддержания веществ Кроме того, буферные растворы широко используются в химическом анализе и для калибровки рН-метров Буферные растворы играют огромную роль в жизни организмов, обеспечивая постоянство рН крови и лимфы. .И в количественном анализе при опред. жёсткости воды.(аммиачный буфер) формула: Ж=N*V1/V
26) Хим. равновесие- состояние системы в кот. скорость прямой реакции=скорости обратной. В основе смещения лежит з.действия масс. CH3COOH ↔ CH3COO+H(равнов.система)
Вводим в систему соль уксусной кислоты
CH3COONa ↔CH3COO+Na(сильный электролит)
После введения в раствор соли концентрация ацетата увеличивается. Скорость обратной реакции увеличивается, равновесие смещается влево, диссоциация уксусной кислоты уменьшается, она станет более слабым электролитом.
27) Гетерогенные системы- неоднородные, равнофазные системы, они состоят из двух фаз. В качественном анализе гетерогенные системы состоят из жидкости (фаза 1) , твёрдые(фаза2) и осадка. Фаза- агрегатное состояние(жидкое, твёрдое и газообразное). Гетерогенные используют в качественном анализе для обнаружения, для разделения веществ, также в количественном анализе. Области применения гетерогенных систем: 1)Выпадение и растворение осадков 2)Выпарение и испарение, перегонка.
Кравн.=
П.Р.- произведение молярных К ионов осадка в насыщ.енном р-ре. Произведение растворимости-константа гетерогенного процесса раств. Чем больше растворимость осадка,тем больше произведение осадка. Растворимость(моль/л)- концентрация малорастворимого в-ва в насыщенном р-ре в данных условиях.
Р в-ва=
28) Цель качественного анализа: обнаружение вещ-в. Чаще всего их осаждают. Поэтому нужно знать условие их осаждения: 1)растворимость в-в. Чем меньше растворимость осадка ,тем больше полнота осаждения. Осаждение осадка считается полным, если концентрация не превышает 10^-6 моль/л. 2) Кол-во осадителя . Чем больше концентрация осадителя, тем больше полнота осаждения. 3).Степень диссоциации осадителя. Целесообразно использовать осадитель сильный электролит. Активность его будит выше. NH4-слабый электролит и NaOH-сильный электролит
Mg+NaOH → Mg(OH)2+2Na
Полнота осаждения будит больше.
NH4OH ↔ NH4+OH
NaOH ↔ Na+OH 4)pH-р-ра
Каждый осадок выпадает при определённом рН-р-ра,это и позволяет разделять ионы. 5).Наличие посторонних электронов в р-ре. Посторонние электролиты-не содержат одинаковых ионов с осадителями и с осаждённым ионом.
Пример:
|
Осаждаемый ион |
осадитель |
Посторонний электролит |
|
Mg |
NaOH |
Na2SO4, KCI, LiNO3 |
|
Fe |
K4[Fe(CN)6] |
KCI,NaNO3,K2SO4 |
|
Al |
Na3PO4 |
K2SO4,KCI,NaNO3 |
29) Растворимость малорастворимого соед. зависит от присутствия в р-ре сильных электролитов, не имеющих общего иона с осадком и имеющего общий ион. Присутствие сильного электролита, не имеющего с осадком одноименного иона, увеличивает растворимость за счет снижения активности ионов в р-ре. Это явление получило название солевого эффекта. Солевой эффект-повышение растворимости осадков при постороннем электролите. Пример: Р-римость BaSO4 в 0,1М KNO3 повышает в 2,2 раза.
30) Для растворения осадка необходимо сделать р-р над осадком ненасыщ. Это достигается путем: 1)разбаления-добавление воды. Этот способ используется для хорошо растворимых осадков. 2) выделение газа FeS↓+2HCl →FeCl2+H2S↑ Kравн.=ПР(FeS)/Kдисс.Н2S >>1-реакция идет 3)Образование слабых электролитов 4) ОВР(изменение заряда ионов в р-ре) Растворение осадков зависит от К равновесия растворения осадка, если Крав.>1 идёт растворение.
31)Комплексообразование широко применяется, как в качественном, так и в кол-м анализе, т.к. они имеют окраску.
Комплексные соед-это сложная группа;сущ. В р-ре как одно целое, отличающееся по св-м от образующих его компонентов.В состав комплекса входит:центр. Атом и леганды. Центральный атом- частица вокруг, которой располагаются леганды. Лиганды-могут быть анионами(хлор, бор, йод)в состав молекулы могут входить органич и неорганич. соед.. Пример: [Cu(NH3)4] ^2+ CI2 Лиганды-доноры e.
32) Окислительно-восстановительные реакции широко применяются в аналитической химии как в качественном так и в количественном анализе. Окисление-это отдача электронов. Восстановление-применение электронов. Окислитель принимает электроны и переходит в восстановительную форму.Восстановитель отдавая электроны переходит в окислительную форму, следовательно каждому окислителю соотв. сопряжённый восстановитель или на оборот.
Виды ОВР:1) Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Н2S + Cl2 → S + 2HCl 2) Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: NH4NO3 → N2O + 2H2O. Чем сильнее окислитель, тем слабее сопряжённый восстановитель.Применяются в хим. методе анализа.
33) Сорбционные процессы- основаны на поглощении твёрдым веществом или жидким из р-ра или из газа. Вещ-ва, которые поглощают другие вещ-ва наз. сорбент.(вещ-во) Сорбция подразделяется на :-адсорбцию-поглощение вещества на поверхности;-абсорбция-поглощение вещества объёмом сорбента. Чем больше концентрация вещества, тем больше сорбция. Сорбенты подразделяются на молекулярные(поглощают молекулы) и ионообменные(поглащают ионы). Эффективность экстракции определяет коэф. распределения. К распр.= С в-ва(в органической фазе)/С в-ва (в водной фазе) Экстракция- поглащение, растворение одного компонента. Ее можно использовать для разделения и концентрирования катионов и анионов.
