
аналитика
.doc1) Задача кол-го анализа определение содержания анализируемого вещ-ва в объекте. Содержание может выражаться показателями:1)для твёрдых веществ-w(в-ва) в объекте, г/т, мг/кг; 2)для жидкостей- w(в-ва) в растворе, моль/л, г/л, и т.д.
Задача аналитич. химии в том числе и кол-го анализа в определении вещ-в, в состав которых входит тот или иной элемент- это фазовый анализ. Например: Si может находится в виде SiO2, AI2O3*SiO3.
Методы: химический(основан на химических реакциях), физический(на изучении физических свойств веществ зависящих от их состава.), химико-физический(на изучении физических свойств веществ полученных при химической реакции).
2) Бывают:систематические, случайные, промахи. Систематические можно предусмотреть:
-методические(ошибки зависящие от приборов и частоты реактивов)
-оперативные ошибки – не чательно выполняют анализ.
Случайные ошибки- нет закономерности, не могут быть предусмотрены(температура, влажность)
Промахи -грубые ошибки (не правильный расчёт, просеивание раствора).
Ошибки могут быть абсолютные и относительные.
Абсолютные - разность между полученным и истинным результатом.
Относительные - масса абсолютной ошибки к истинному результату.
3.)Метод основан на взвешивании исх. обьектов и полученных при хим. реакциях в-в на аналит. весах.Точность взвешивания на аналит. весах = 2*10^-4. Метод точный, но очень длительный. Применяется при анализе вина, молока и т.д. Он подразделяется на:-метод осаждения(основан на осаждении вещ-в их фильтрации, промывки и сушки); и -метод отгонки(основан на удалении летучих веществ при нагревании или при обработки реактивами).
Требования к осадкам: Должна иметь низкую растворимость, быстро фильтроваться и омываться от примесей.
Требования к осадителю: Осадитель должен полностью осаждать компонент. Требования к весовой(это осадок кот. взвыешивают): состав весовой формы должен точно соответствовать её хим. формуле и должна выдерживать высокие температуры и хим. устойчива.
4.)Соосаждение - совмесное осаждение нескольких веществ. Бывает поверхностное(поглощение вещ-в поверхностью осадка) или внешнее и внутреннее соосаждение(механический захват частицами осадка частью р-ра).
Способы уменьшения соосаждения: переосаждение осадка, промывание осадков. Применение соосаждений: Для повышения концентраций микрокомпонентов, для обнаружения веществ Mg+2OH Mg(OH)2, некоторые осадки могут поглощать индикаторы, при этом цвет индикатора меняется.
5)1. Присутствие посторонних электролитов(температура, рн среды, природа раств.) Присутствие солевого эффекта. 2. С повышением температуры растворимость большинства осадков увеличивается . 3.Влияние рН: Раствор осадков зависит от рН среды..рН осаждения зависит от р-ра индикаторов. 4. Влияние природы растворителя. 5. наличие посторонних в-в
6. )Фактор пересчета F-отношение моляр. массы опред. в-ва и моляр. массы весовой формы. F=x*М опред..формы/у*М вес.формы. Где х и у-числа уравнивающие число атомов в числителе и знаменателе. В методе осажления различают:1)определяемая форма-анализируемое в-во. 2)осаждаемая форма-осадок, к-й осаждается и 3)весовая-осадок, к-й взвешивают. m(опред. форма)=F*m(вес.форма)*100%/m образца. Напр.:Fe(опред.форма) →Fe(OH)3 ↓(осаждаемая форма)→Fe2O3(весовая форма).
7) Оъёмный метод- основан на измерении объёма р-ра пошедшего на реакцию с другим раствором. Для анализа необходимо иметь: анализируемый раствор, раствор титранта- это раствор с точной известной концентрацией, а титрование-это постепенное добавление одного р-ра к др. р-ру до оканчания р-ции. Один раствор добавляют в колбу для титрования, а другой раствор в бюретку. Потом один раствор титруют другим. Преимущество метода: метод быстрый, но менее точный чем весовой. Задача анализа точно установить точку эквивалентности.
8) В основе метода реакция нейтрализации H3O+ OH↔ 2H2O
H+ OH ↔ H2O
Метод применяется для отделения кислот, оснований, солей имеющих кислую или щелочную реакцию. Точка эквивалентронсти- момент окончания реакции.Ее определяют по изменении окраски титруемого р-ра. Один из способов фиксации это индикаторный метод. Индикаторы — вещества, благодаря которым можно установить конечную точку эквивалентности(момент резкого изменения окраски титруемого раствора).Интервал перехода окраски индикаторов рН 8-10(ф-ф)
9).Метод пипетирования. Навеску анализируемого в-ва растворяют в мерной колбе, разбавляют водой до метки, перемешивают р-р, пипеткой отбирают аликвотную часть р-ра и титруют. Измерять надо 3 раза. Берут средний объём р-ра, пошедший на титрование. Метод отдельных навесок. Берут отдельные, близкие по величине навески анализируемого в-ва. Растворяют в произвольном объёме воды и целиком титруют получаемые при этом р-ры. Ошибка должна не превышать 0,1%
10.)Кислотно-основные индикаторы- это растворимые сложные органические соед., способные изменять собственную окраску в зависимости от pH раствора. По химической природе они являются слабыми кислотами или основаниями, частично диссоциирующими в растворе. Кислотно-основные индикаторы, как правило, - обратимые индика-торы, способные обратимо изменять окраску в зависимости рН раствора.
|
Индикатор |
рН раствора |
Цвет индикатора |
|
метилоранж |
4,4>pH <3,1 |
оранжевый |
|
лакмус |
≤5; ≥8 |
Розовый; синий |
|
фенолфталеин |
pH≥10; pH<8 |
Малиновый;бесцветный |
Хромофорная теория объясняет наличие окраски индикаторов.Ионная теория предполагает наличие в растворе двух форм молекулы индикатора - кислой формы, и основной формы
11) Приготовленные р-ры готовят из точной навески химически чистого в-ва и растворов её в определённом объёме воды это- стандартные. Стандартизованные- их концентрацию устанавливают по стандартным растворам. К ним относится неустойчивые вещества. Титр-показывает массу опред. в-ва взаимодействующую с 1мл этого р-ра. Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества. Эквивалент вещества —молекула или ее часть отсоед. или присоед. 1 однозарядный ион. Н+ и ОН-
12) Кривые титрования -показывают изменение рн раствора при титровании. Используют для подбора индикатора. На кривой будит резкий скачок рН, момент окончания реакции.Скачок рН начинается с более высокого рН и заканчиввется при рН=10 . Слабой к-ты сильным основ. Т.э. при рН=8,9 используют индикатор фенолфталеин т.к. он изменяет окраску при рН=8-10. Один из способов фиксации это индикаторный метод. Индикаторы — вещества, благодаря которым можно установить конечную точку эквивалентности(момент резкого изменения окраски титруемого раствора).
13) Титрование многоосновных кислот или многокислотных оснований имеет несколько точек эквивалентности, и соответственно кривая рН дает несколько перегибов, в большинстве случаев, однако, не резко выраженных. Многоосновные кислоты (H3PO4, H2CO3) диссоциируют ступенчато. Например: H3PO4↔ H2PO-4 + H+, H2PO-4 ↔
HPO2-4 + H+, ( HPO^-2)4 ↔PO3-4 + H+.
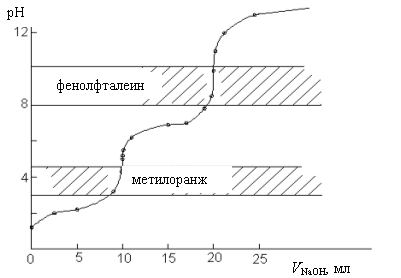 это
кривая титрования 0,1 H3PO4 раствором 0,1 М
NaOH
это
кривая титрования 0,1 H3PO4 раствором 0,1 М
NaOH
кривые титрования многоосновных кислот имеют несколько перегибов, отвечающих разным ступеням диссоциации. С м-о к-та титруется как одноосновная. С ф-ф титруется как двуосновная.
14) Метод основан на осаждении. Методы осадительного титрования: аргентометрия(титрант AgNO3), роданитометрия(титрант NH4SCN), меркурометрия(титрант Hg2(NO3)2)
Метод Мора: наиболее простой из всех методов аргентометрии и в то же время достаточно точный. Используется в нейтральной или слобощелочной среде. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия. AgNO3+K2CrO4(индикатор) → Ag2CrO4.↓(красный)+2KNO3. Метод Мора широко применяется при анализе пищевых продуктов. Метод Фольгарда: используют в кислых средах. Основан на титровании раствора, содержащего ионы серебра, стандартными растворами NH4NCS или KNCS: Ag+ + NCS- ↔ AgNCS↓. Индикатором в этом методе являются ионы Fe3+. Адсорбционные индикаторы - вещества, способные адсорбироваться на поверхности осадка и менять при этом окраску или интенсивность люминесценции.
16) Титрант- реагент с точно известным титром(концентрацией).Индикатор- хим. в-ва, изменяющие окраску, образующие осадок при изменении концентрации какого-либо компонента в р-ре. Сущ. 2 типа: 1)вступают в реакции с окислителем или вос-лем с изменением окраски Напр. Крахмал(индикатор,бесцветный)+I2→ I2*крахмал(синий цвет). 2)изменяет свою окраску в зависимости от ОВ потенциала. А)Перманганатометрия- титрант KMnO4, кислая среда. MnO4+5e+8eH→Mn^2++4H2O (fэ=1/5). Б)Хроматометрия-титрант K2Cr2O7, среда кислая. Cr2O7+6e+14H→2Cr^3++7H2O (fэ=1/6) Применяется для опред. всех восс-лей. В)Йодометрия-титрант I2. KI. Na2SO3+I2+H2O→2I+Na2SO4. Применяют при анализе восс-лей. Г)Броматометря-титрант Br2 C6H5OH+3Br2→C6H2Br3OH+3HBr. Применяется очень редко Д)Броматометрия-титрант NaBrO3. 2BrO3+6H+5e→Br2+3H2O (fэ=1/6)
17) ) Титрант- реагент с точно известным титром(концентрацией).Индикатор- хим. в-ва, изменяющие окраску, образующие осадок при изменении концентрации какого-либо компонента в р-ре. Ж=N*V*1000/V(H2O), где N-нормальность р-ра,V-обьем р-ра. Жесткость воды измеряется в мг*экв/л .Жесткость мы определяем с помощью Трилона Б. Комплексометрия основана на реакциях образования растворимых комплексных соед. Комплексометрическое титрование подразделяют на комплексонометрию и меркуриметрию. В основе этих методов лежит протекание реакции между опред. в-м и реагентом и в результате этой реакции образуюся комплексные соед.( это соед, которые состоят из комплексообразователя и лигандов, кот. окружены возле него).
18) Основаны на движении частиц заряженных в эл.поле. Частицы находятся в жидкости. Частицы движутся в эл.поле
с разной скоростью. Катод-отрицательно заряженный е; анод-положительный. Нейтральные частицы также будут идти на электрод, но медленнее.Скорость частиц зависит от их заряда и от подвижности, а подвижность частиц зависит от размера частиц. Чем больше заряд частиц и меньше их размеры, тем быстрее они движутся. Применяется для анализа всех органич. и неорганич. в-в Классификация: зональный электрофорез и капиллярный. Зональный электрофорез применяется при анализе молока, а капиллярный-при анализе вина. РИСУНОК
19) Бывают прямые и косвенные. Основаны на измерении эл. параметров зависящих от состава р-ра Большинство из них основано на электролизе. Могут измеряться след. параметры:сопротивление и электропроводность р-ра, сила тока, потенциал электрода. Электрохим. методы подразделяются на:кондуктрометрию, потенциометрию, вольамперометрию, кулометрию, электрогравиметрию. К кондуктометрии относятся методы, в которых измеряют электропроводность электролитов. Потенциометрия основана на измерении потенциала индикаторного электрода.(электрод-это датчик).Вольамперометрия основана на излучении зависимости силы тока от внеш. напряфжения. Кулометрия основана на измерении кол-а электричества. Электрогравиметрия-на электролизе анализируемого р-ра эл. током.
20)Метод основан на электропроводности р-ра. В кодуктрометрии измеряют сопротивление р-ра в спец. электролитич. ячейки. Кондуктрометрия подразделяется на прямую и кондуктрометрическое титрование. .Кондуктрометрич. титрование- это косвенный метод, служит для опред. точки эквивалентности. Используется для опред. точки эквивалентности, с помощью графика, кот. показывает зависимость электоопроводности р-ра от обьема титранта. Т. эквивалентности- момент титрования, когда число эквивалентов добавляемого титранта равно числу эквивалентов определяемого в-ва в образце.
21) Основан на измерении потенциала индикатороного электрода..(электрод-датчик). Индикатор.электрод-электрод, потенциал кот. зависит от состава анализ. р-ра.Абсолютный потенциал электрода измерить невозможно. дельтаЕ(потенциал электрода)=Е(инд.)-Е^0 Для измерения потенциала электрода используют приборы потенциометры, они состоят из двух электродов. Индикаторные электроды бывают: электроды, на поверхности кот. идет обмен электронов и электроды, где идет обмен ионов.Потенциометрич. титрование основано на измерении потенциала индикатороного электрода при титровании. Точку эквивалентности можно увить по резкому скачку, для этого нужно построить график и увидить это.
22) Кулометрия основана на измерении кол-ва электричества, затраченного на электропревращение опроеделяемого в-ва. Бывает и косвенная кулометрия или кулометрическое титрование основана на взаимодействии анализируемого в-ва с титрантом. Вольтамперометрия осована на излучении зависимости силы тока от внеш. напряжения. Для этого метода используется 2 электрода индикаторный и стандартный. Кулометрия хороша тем., что не обящательно использовать стандартные р-ры. Формла для кол-ва электричества:Q(кулон) =I(сила тока) *тау(время анализа).
23) Метод разделения и анализа в-в, основанный на распределении между двумя фазами, кот не смешиваются-подвижной и неподвижной. Неподвижная фаза-это твердое в-во, а подвижная фаза это жидкость или газ, кот проходит через неподвижную фазу.Чем хороша хроматография,, так это тем что можно много раз повторять процессы. Этот метод универсален, т.е. разделение и определение твердых, жидких и газообразных соед. Любой сорбционный процесс хр-ся константой распределения Краспред.=Снеподв.*Сподвиж. Колонки в хроматографии имеют диаметр 4-6мм.Ионообменная хроматография-это жидкостная хроматография для разделения катионов и анионов.Эта хроматография применяется например для очистки воды. Еще существует бумажная хроматотграфия, но она плоха тем что медленно разделят и нельзя сразу большое кол-во в-в.
24) Основана на обмене ионов между подвижной и неподвижной фазами(ионит) Еще бывают катионит(обменивается катионами), анионит(анионами) и амфолит(обменивается анионами и катионами). Иониты бывают натуральными и природными и еще искусственными. Применяется для разделения катионов, отделение электролитов от не электролитов, и еще при анализе вина и молока. Сорбенты- твердые тела или жидкости, кот поглащают из окр. Среды газы. Бывают абсорбенты-образует с поглащенным в-м раствор и адсорбенты-поглащают в-во. Существуют твердые сорбенты, кот. деляться на гранилированные и волокнистые.
25) Основан на взаимодействии анализ. в-ва с электромагнитным излучением. Каждое в-во при взаимодействии с излучением образует спектр. Спектр-упорядоченная по длинам волн электромагнитное излучение. Резонанс-совпадение частот. Виды излучений: ренгеновское, УФ, ИК, радиоволны, магнитное поле. Атомы и молекулы способны поглащать, испускать и рассеивать излучение. Спектральные методы подразделяются на атомную и молекулярную. Атомная основана взаимодействии атомов с электромагнитным излучением, она подразделяется на атомно-эмиссионный и атомно-абсорционный анализ. Эмиссия-это испускание, излучение. Молекулярные спектры —электромагнитные спектры испускания и поглощения. ГРАФИКИ2
26) Основана на способности опред. в-ва, компонента смеси поглощать электромагнитное излучение.Бывают фотометрические и спектрофотометрические методы. Фотометрический метод измеряется фотометром, а спектрофотометрический метод-спектрофометром. Существует з. поглащение Бугера: D=-LgT= E*L*c, где D-это плотность р-ра, T-пропускание, L-толщина, с-концентрация. Из этого з. следует, что чем выше концентрация р-ра, тем выше плотность р-ра. Обычно при фотометрическом анализе сравнивают интенсивность излучения. На градуировочном графике строят зависимость плотности р-ра от его концентрации., и по этому графику опред. его концентрацию.
27) Эти два методы основаны на измерении интенсивности света. Турбидиметрия -метод анализа мутных сред. Применяется для аналитич. определений в разных средах. Но этот метод не очень точен, и применяется только для определения компонентов, где не нужна высокая точность. Нефелометрия- применяют для определения хлоридов(AgCl) и сульфатов(BaSO4).
28) Атомно-эмиссионный-основан на излучении атомами электромагнитного излучения, кот помещены в пламя. Суть метода: анализируемый р-р в пламени газовой горелки. Применяется в металлургии. Этот метод основан на том, чтобы атомы каждого элемента могли испускать свет определенных длин волн, но для того чтобы атомы начали испускать свет, их нужно возбудить, чем больше атомов будут возбуждены, тем ярче будет излучение. Этот метод очень точен. Атомно-абсорбционный-основан на поглощении света. Этот метод также применяется в металлургии, для большинства металлов.Метод хорош тем что он очень прост, но нельзя применять несколько элементов одновременно.
29) Основан на явлении люминесценции. Этод метод используют в органич. химии, он позволяет обнаруживать в-ва в смесях. Различают флуоресцентный(этот метод мало селективен), фосфоресцентный анализ(обладает высокой селективностью)Селективность-это св-во одного в-ва подбирать св-во другого в-ва.
30) Этот метод использует рентгеновские спектры для хим. анализа в-в. С помощью него можно определить качественный и кол-й анализ. Он основан на том, что при возбуждении у атома удаляются электроны из внутренних оболочек. Электроны из внеш. оболочек перескакивают на пустые места, освобождая избыточную энергию в виде кванта. И по кол-ву этих квантов можно определить кол-й и качественный анализ.
31) Рефрактометрия-это метод исследования вещ-в, основанный на определении показателя преломления света. Она применяется для опред. физ-хим. параметров в-в. n-показатель преломления. Коэф. преломления:n=sin(альфа)/cos(бета) Применяется для определения состава и в-в, а также для качества хим. состава в продуктах. Поляриметрия-основанные на степени излучении света. Этод метод используется в аналитической химии, при анализе эфирных масел и для исследования излучений. Все измерения проводятся поляриметрами.
32) Ядерно-магнитный резонанс-это резонансное поглощение электромагнитной энергии вещ-м. Это явление открыто в 1945г. Применяется в физ-хим. методах анализа. Главной частью спектрометра является магнит, кот. помещается в сосуд между полюсами электромагнита. Потом этот сосуд начинает вращаться. Когда магнитное поле начинает усиливаться начинают резанировать ядра, к которым настроен спектрометр.Эти показание записывают и вращать начинают на столько быстро на сколько это возможно.
33) ИК спекторометрия-основана на поглащении ИК света. При поглащении ИК света в молекуле усиливается колебательные и вращательные движения. Применение-опред. качественный и кол-й анализ. Ультрафиолетовая-метод основан на поглащении в-м ультрофиолетового излучения. Ход анализа: через р-р пропускается УФ свет, каждая молекула поглащает опред. свет.
34) Масс-спектрометрия - это физ. метод измерения отношения массы заряженных частиц материи к их заряду. С помощью этого метода разрабатывают новые лекарственные средства от неизличимых болезней. Применяется с незаконным распространением наркотиков . Ядерная энергетика немыслема без масс-спектроскопии. Чтобы получить масс-спктрометр нужно превратить молекулы в ионы, потом эти ионы нужно перевести в газовую фазу в вакууме, вакуум нужен для того чтобы ионы двигались без препятстсвий, а если вакуума нет то ионы превращаются в незаряженные частицы.
35) ЭПР- поглощение энергии вещ-ми содержащие паромагнитные частицы. Основан на взаимодействии вещ-ва с магнитным полем. Применяется для исследования парамагнитных частиц, широко применяется в химии. ЭПР - частный случай магнитного резонанса Лежит в основе радио-спектроскопич. методов исследования вещ-ва Суть явления ЭПР заключается в резонансном поглощении электромагнитного излучения неспаренными электронами. ЭПР открыт Завойским в 1944г.
