
Проблема оптимизации коэффициентов
Основная проблема метода ВС заключается в оптимизации волновой функции, т.е. в установлении значений коэффициентов (С1,С2, ...,CN). Известно несколько общих правил, облегчающих выполнение этой задачи.
1) Волновая функция молекулы должна удовлетворять требованиям симметрии. Для молекул эти требования более разнообразны, чем для атомов.
а) Должен выполняться принцип Паули— волновая функция должна бытьантисимметричной, относительно перестановки местами двух любых электронов:Ф(1, 2, …,i,j, …,n) = –Ф(1, 2, …,j,i, …,n).
В частности, все слагаемые, входящие в волновую функцию должны быть либо антисимметричными, либо образовывать с другими слагаемыми антисимметричные комбинации.
б) У любой молекулы имеется пространственная симметрия, выражаемая одной из точечных групп симметрии (ТГС). Волновая функция молекулы должнапринадлежать одному из типов симметрии(неприводимых представлений) этой ТГС или, другими словами,быть собственной функцией операторов симметрии, входящих в ТГС.
Ф НП ТГС или FФ = Ф = (1)Ф
Так, если имеется несколько РФ, переводимых друг в друга операциями пространственной симметрии, то коэффициенты при их волновых функциях должны быть одинаковы по модулю (т.е. могут отличаться только знаками).
2) Абсолютная величина коэффициентов при базисных волновых функциях конкретных РФ сильно зависит от их энергий: чем выше энергия РФ, тем меньший вклад в молекулярную волновую функцию она вносит. Например, энергии РФ, составленных их "ионов", существенно выше энергии РФ, составленных из нейтральных "атомов". Это обстоятельство, в большинстве случаев, позволяет не рассматривать полный набор РФ, а ограничиться небольшим их числом, т.е. включать в линейную комбинацию только те РФ, энергии которых заметно ниже остальных.
3) Волновая функция должна быть нормированной.
После учета всех этих правил, коэффициенты линейной комбинации оптимизируются на основе вариационного принципа: составляется выражение для полной энергии молекулы, включающее неизвестные коэффициенты, и этот функционал минимизируется.
E=f(С1,С2, ...,CN)min
Для явного выражения энергии молекулы как функции коэффициентов Сiиспользуется стандартное уравнение:E=ФНФdv.
Оператор Гамильтона для молекулы можно легко построить в любом случае. Если считать ядра неподвижными и пренебречь магнитными взаимодействиями (нерелятивистская модель), то он будет иметь вид:

где i= (–2/2m)2i— оператор кинетической энергииi-го электрона,
Ui= –Ze2/ri— оператор потенциальной энергииi-го электрона в кулоновском поле-го ядра,
Uij=e2/rij— оператор кулоновского отталкивания для пары электронов (с номерамиiиj),
U=Z Ze2/r— оператор кулоновского отталкивания для пары ядер (с номерамии).
Эта форма гамильтониана приводит к тому, что выражение для полной энергии молекулы приобретает вид:
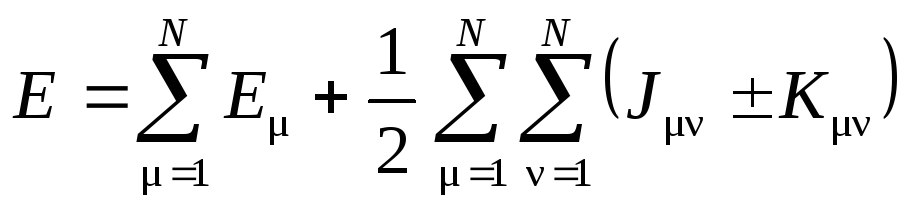
где Е— полная энергия изолированного атома с номером,
J— межатомные кулоновские интегралы (энергии кулоновского отталкивания атомов),
K— межатомные обменные интегралы (поправки к энергии за счет перехода электронов от одного атома к другому.
Можно заметить, что сами одноатомные энергии (Е) могут быть выражены сходными формулами (см. теорию МЭА):
Е=Hi+(JijKij) (i<j)
где Hi — остовные интегралы, аJijиKij— кулоновские и обменные межэлектронные интегралы, соответственно, для-го атома. Следует всегда различать межатомные (J,K) и межэлектронные (Jij,Kij) интегралы, несмотря на сходство их названий и физической природы.
Таким образом, в основе метода ВС лежит вспомогательная структурная модель, заимствованная из классической теории химического строения, согласно которой молекула представляет собой агрегат из индивидуальных атомов, свойства которых, однако, изменены за счет межатомных взаимодействий кулоновской природы («химических связей»). Поэтому метод ВС позволяет сопоставить вводимые в его рамках поправки на межатомное взаимодействие (J— межатомные кулоновские интегралы иK— межатомные обменные интегралы) обычным химическим связям, которым в классической химии также приписывается локализованный бинарный характер. Это позволяет получать в квантовой химии некоторые количественные оценки таких характеристик химических связей, как длины, энергии диссоциации и др.
Вследствие больших вычислительных проблем метод ВС редко применяется в полном виде. Чаще можно встретить различные упрощенные варианты, например, т.н. полуколичественный "метод резонанса", особенно широко распространенный в органической химии.
В основе теории резонансалежит представление метода ВС о том, что волновая функция молекулы может быть получена как суперпозиция базисных волновых функций резонансных форм.
молекулы=С11+С22+ ... +Сnn
Однако, в отличие от полного метода ВС, в теории резонанса учитывают не все базисные функции (резонансные формы), а только их небольшое число. Иначе говоря, дело сводится к "урезанию" базисного набора, что чрезвычайно упрощает математические проблемы метода ВС.
Например, для молекулы воды можно построить несколько миллионов РФ, отличающихся способом распределения 10 электронов (с учетом их спиновых состояний) по трем фрагментам разрезанной молекулы. Из них можно оставить только две группы аналогичных РФ:

Если суперпозицию волновых функций РФ распространить на сами РФ, то получится нечто среднее — т.н. "резонансный гибрид" или "мезомерная(т.е. промежуточная, усредненная) структура", в которой:
а) на атомах водорода будет наблюдаться избыточный положительный заряд (пропорциональный квадрату коэффициента С2);
б) на атоме кислорода будет наблюдаться избыточный отрицательный заряд (пропорциональный удвоенному квадрату коэффициента С2);
в) порядки ковалентных связей О—Н будут иметь величину между 1 и 0 (пропорционально квадрату коэффициента С1).
Основная проблема метода резонанса — рациональный отбор резонансных форм (резонансных структур). Наиболее полезным в этом отношении является правило, связывающее вклад данной РФ с ее энергией: чем выше энергия РФ, тем меньше ее вклад. Соответственно, в методе резонанса ограничиваются только теми РФ, энергии которых особенно низки. К ним относятся:
а) атомная форма(состоящая из нейтральных атомов) в которой электроны распределены в соответствии с зарядами ядер,
б) ионные формы, в которых избыточное число электронов принадлежит наиболее электроотрицательным атомам; при этом, как правило, рассматриваются только РФ с небольшими (единичными) зарядами атомов.
Дополнительно можно отметить, что часто в методе резонанса используются не полные, а частичные резонансные формы, в которых атомной локализации подвергаются не все электроны молекулы, а только некоторые из них, обладающие особенно высокой энергией. Частичная резонансная форма отличается тем, что ее можно однозначно изобразить классической структурной формулой или формулой Льюиса.
Например, молекулу диоксида углерода можно рассматривать как резонансный гибрид ковалентной и ионной форм, отличающихся локализацией подвижных электронных пар двойных связей:

Аналогично, молекула монооксида углерода представляется в виде резонансного гибрида структур, отличающихся состояниями неподеленной пары электронов кислорода и вакантной АО атома углерода:

При описании молекулы бензола можно вообще не учитывать ионные резонансные структуры, имеющие в данном случае гораздо более высокие энергии, чем ковалентные, так как в молекуле нет атомов с высокой электроотрицательностью:

Таким образом, метод резонанса позволяет использовать основные идеи метода ВС и получать без особых математических затруднений качественные или полуколичественные результаты, которые достаточны для решения многих чисто химических задач, связанных с электронным строением молекул.
Метод МО
В отличие от метода ВС, метод МО не основан на представлениях классической структурной химии, а представляет собой теорию многоэлектронного атома, распространенную на молекулы, которые рассматриваются как атомы особого типа — многоядерные. Возьмем, например, атом неона, состоящий из ядра сZ= +10 и 10-ти электронов, каждый из которых находится в своем стационарном состоянии, описываемом определенной атомной спин-орбиталью. Разделим ядро атома на три части с зарядовыми числамиZ1=Z2= +1 и Z3= +8 и разнесем эти ядерные фрагменты в пространстве на определенные расстояния. Если перемещение ядер будет сравнительно медленным (адиабатическим), то электроны не будут участвовать в каких-либо квантовых скачках, а просто будут приспосабливаться к новой конфигурации электрического поля (новой форме потенциальной ямы), оставаясь все время в стационарных состояниях. В результате такого процесса получится трехядерная молекула воды:

При таком подходе электронная оболочка молекулы считается полностью обобщенной, и каждый электрон в ее составе принадлежит только всей молекуле целиком, но не какому-либо отдельному атому. В рамках метода МО предполагается, что электроны в получившейся молекуле, так же как и в исходном атоме, находятся в стационарных состояниях, описываемых молекулярными спин-орбиталями(МСО), которые представляют собой видоизмененные (деформированные) атомные спин-орбитали (АСО).
Каждый электрон характеризуется тем же набором локальных наблюдаемых, что и в атоме: энергией (i), спиновым моментом (s) и орбитальным моментом (). Более низкая симметрия электрического поля ядер в молекуле приводит к более сложному в пространственном отношении характеру движения электронов. Поэтому в молекулах электронам, как правило, нельзя приписать определенных значений орбитального момента (исключением являются только линейные молекулы и плоские циклические молекулы типа бензола).
Таким образом, в основе метода МО лежит утверждение, что движение каждого молекулярного электрона описывается одноэлектронной волновой функцией — МСО и набором одноэлектронных наблюдаемых:
электрон 1 1 ;1 , |s|1,sz1, { ||1 ,z1 }
электрон 2 2 ;2 , |s|2,sz2, { ||2 ,z2 }
………………………………………………..
электрон nn ;n , |s|n,szn, { ||n ,zn }
Подобно АСО, каждую МСО можно (пренебрегая магнитными взаимодействиями) представить в виде произведения пространственного и спинового множителей: =•, причем пространственный множитель(x,y,z) называетсямолекулярной орбиталью(МО). Ввиду отсутствия сферической симметрии у молекул МО представляют, как правило, в декартовой системе координат.
Связь между глобальной волновой функцией и одноэлектронными МО устанавливается так же как в атоме — посредством определителя Слэтера:
Ф = || 1 2 … n ||
либо в виде линейной комбинации таких определителей, что иногда бывает необходимо для выделения глобального спинового множителя: Ф=• .
Основная теоретическая проблема метода МО состоит в установлении явного вида МО. Найти этот вид посредством решения какого-либо уравнения на собственные значения невозможно. Поэтому для их анализа используют стандартный прием — разложение по некоторому базисному набору:
1=С111+С122+ … + С1nn
2=С211+С222+ … + С2nn
……………………………………
n = Сn11 + Сn22 + … + Сnnn
То же самое можно записать в матрично-векторной:
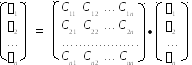
или в соответствующей операторной форме:
= С • .
Б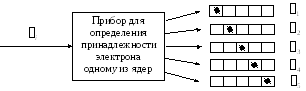 азисных
наборов, как обычно, существует бесконечно
много, и различные базисы будут,
естественно, приводить к различным
представлениям молекулярных орбиталей.
Поэтому орбитальная модель молекулы
может выглядеть по-разному, в зависимости
от выбранного базиса. Наиболее широко
используемым базисным набором является
т.н. "атомный базис". Его, в соответствии
с общим правилом квантовой механики,
можно определить с помощью измерительного
прибора следующей конструкции. Удалим
из молекулы все электроны, кроме одного.
Затем поместим ядерный остов молекулы
в ящик с перегородками так, чтобы каждое
ядро попало в свой отсек. В ходе такого
"измерения" электрон случайным
образом будет обнаруживаться в одном
из "атомных" отсеков и ему можно
будет приписать номер того ядра, в чей
отсек он попал.
азисных
наборов, как обычно, существует бесконечно
много, и различные базисы будут,
естественно, приводить к различным
представлениям молекулярных орбиталей.
Поэтому орбитальная модель молекулы
может выглядеть по-разному, в зависимости
от выбранного базиса. Наиболее широко
используемым базисным набором является
т.н. "атомный базис". Его, в соответствии
с общим правилом квантовой механики,
можно определить с помощью измерительного
прибора следующей конструкции. Удалим
из молекулы все электроны, кроме одного.
Затем поместим ядерный остов молекулы
в ящик с перегородками так, чтобы каждое
ядро попало в свой отсек. В ходе такого
"измерения" электрон случайным
образом будет обнаруживаться в одном
из "атомных" отсеков и ему можно
будет приписать номер того ядра, в чей
отсек он попал.
Таким образом, базисное состояние i — это такое состояние, когда электрон вынужден двигаться в окрестности единственного ядра, подобно тому, как это имеет место в атоме. Однако такие базисные состояния несколько отличаются от атомных орбиталей изолированных атомов, поскольку электрон находится под влиянием электрических сил со стороны всех ядер молекулярного остова. Влиянием удаленных ядер часто пренебрегают и полагают, что базисные состоянияi описываются обычными АО. Поэтому описанный способ конструирования МО называется ЛКАО (линейная комбинация атомных орбиталей). ОператорСв этом случае называетсяатомно-молекулярным оператором, так как он преобразует орбитали от их атомной формы к молекулярной.
После выбора базисного набора остается проблема определения коэффициентов разложения Сij(матричных элементов атомно-молекулярного оператораС). Решение этой задачи облегчается тем, что на коэффициентыСijнакладывается ряд ограничений.
а) МО должны удовлетворят стандартному условию ортонормированности:
ij dV = ij
б) каждая МО должна иметь определенную пространственную симметрию, в соответствии с симметрией ядерного остова, а именно: принадлежать одному из неприводимых представлений точечной группы симметрии молекулы
i НП ТГС ,
поскольку только в этом случае электронное облако, форма которого определяется квадратом МО, будет соответствовать форме самой молекулы.
После анализа и учета указанных ограничений коэффициенты Сijопределяются посредством обычной процедуры самосогласования. Для этого:
1) выбирают электронную конфигурацию,
2) выражают каждую МО в виде ЛКАО,
3) выражают полную энергию через молекулярные орбитали, в результате чего она получается в виде функции от коэффициентов Е=F(Сij),
4) дифференцируют эту функцию по коэффициентам и приравнивают производные к нулю: Е/Сij= 0.
Получаемая система уравнений (содержащая nnуравнений), называетсяуравнениями Хартри-Фока-Рутана(ХФР). Она состоит изnодинаковых экземпляров системы изnуравнений следующего вида:
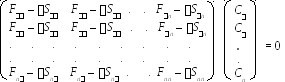
где F— матричные элементы оператора Фока, характеризующие либо энергию электрона в изолированном атоме с номером(при=), либо изменение энергии электрона при его обобществлении двумя атомами с номерамии(при),S — интегралы перекрывания для базисных АО с номерамии, а— энергия МО с коэффициентами {СС. .Сn }.
Основные проблемы метода МО связаны с необходимостью процедуры самосогласования, включающей многократные вычисления интегралов типа FиS. Идея решения сводится к следующему. Всякая система однородных линейных уравнений имеет решение только в том случае, если ее определитель равен нулю. Приравнивание определителя системы ХФР к нулю дает характеристическое уравнение относительно, имеющееnкорней:1,2, … ,n. Подставляя поочередно эти корни в систему, находятnрешений, каждое из которых представляет собой набор коэффициентов для одной из МО. Найденные коэффициенты используют для вычисления матричных элементовFиSи повторяют процедуру решения.
После достижения заданной точности получают самосогласованное решение в виде набора МО и их энергий:
1* 2* … n*
1* 2* … n*
Такой подход к решению системы ХФР носит называние "метод ab initio" и отличается тем, что в нем все интегралыFиSрассчитываются в ходе решения уравнений ХФР. Существуют и альтернативные методы, которые называютсяполуэмпирическими, так как в них часть или даже все интегралыFиSнаходятся из эмпирических данных (например, спектральных). Это позволяет значительно снизить число итераций и ускорить процедуру решения. Полуэмпирических методов существует чрезвычайно много, причем все они дают несколько различные результаты.
Оператор Гамильтона в методе МО строят в виде:
H = (i) + (Ui) + (Uij) + (U) = (hi) + (Uij)
где i= (–2/2m)2i— оператор кинетической энергииi-го электрона,
Ui= –Ze2/ri— оператор потенциальной энергииi-го электрона в кулоновском поле-го ядра,
Uij=e2/rij— операторы межэлектронного отталкивания,
hi =i+(Ui) — т.н. "одноэлектронные гамильтонианы".
Поэтому полная энергия молекулы в методе МО задается в виде суммы орбитальных энергий с поправками на межэлектронное взаимодействие:
Е = i* + ( Jij Kij )
где Jij—кулоновскиеинтегралы, аKij—обменныеинтегралы (их физический смысл тот же, что и в теории МЭА).
В большинстве случаев наилучших результатов удается достичь, если использовать многодетерминантные волновые функции, каждая из которых соответствует своей электронной конфигурации. Выигрыш в энергии, достигаемый за счет перехода от однодетерминантной волновой функции к многодетерминантной приписывается действию т.н. "конфигурационного взаимодействия" (КВ). Следует иметь в виду, что КВ — это не особый вид физического взаимодействия, а всего лишь способ введения поправок в волновую функцию молекулы и ее энергию.
Важное место в описании молекул методом МО занимают энергетические диаграммы, изображающие графически совокупность молекулярных орбиталей в отношении их расположения на энергетической шкале. Указание заселенностей этих орбиталей (энергетических уровней) приводит к такой характеристике молекулы, как ее электронная конфигурация, смысл которой аналогичен электронной конфигурации атома. Наряду с энергетическими, широко используются и т.н.корреляционные диаграммы, представляющие собой совместное изображение энергетических диаграмм электронных состояний атомного (i) и молекулярного (i) типов.

Такие диаграммы позволяют проследить характер изменения состояния каждого электрона и изменения в его энергии при образовании молекулы из "атомов".
Канонические МО
Молекулярные орбитали, находимые как решения уравнений ХФР, называются каноническими(КМО). Их отличительная черта — полная делокализованность. Другими словами, каждая КМО распространяется на всю молекулу в целом, что отражает тот факт, что любой электрон молекулы может быть найден в любой точке внутри молекулярного объема. КМО, помимо их энергии, могут быть охарактеризованы и с пространственной точки зрения, аналогично атомным орбиталям.
Наиболее важными из пространственных характеристик КМО являются:
1) узловая структура, т.е. совокупность узловых поверхностей, разделяющих объем молекулы на части, и на которых КМО и вероятность обнаружения электрона равна нулю; здесь выполняется общее квантово-механическое правило — число узлов КМО пропорционально орбитальное энергии;
2) пространственная симметрия, которую можно описать, указав неприводимое представление (тип симметрии) точечной группы молекулы; например, все КМО молекулы воды должны иметь один из четырех типов симметрии группы С2v, а все КМО молекулы метана — один из пяти типов симметрии группыTd.
Например, в молекуле бутадиена имеется 4 КМО такой формы:




Из рисунков видно, что первая КМО является безузловой, вторая имеет один узел, третья — два узла, а четвертая — три. Соответственно, симметрия этих КМО описывается НП группы С2v: первая и третья КМО принадлежат типу В2(антисимметричны относительно операции С2) а вторая и четвертая — типу А2(симметричны относительно операции С2).
Симметрия часто используется для классификации МО. Так, для плоских молекул имеется операция отражения в плоскости молекулы. Соответственно, МО может быть либо симметричной, либо антисимметричной, относительно этой операции. В поперечном разрезе такие МО имеют следующий вид:

Локальные характеристики молекулы в методе КМО
Знание коэффициентов МО позволяет рассчитывать некоторые полезные характеристики молекулы, имеющие локальный характер — отнесенные к отдельным атомным фрагментам в составе молекулы. Расчет основан на матричном представлении коэффициентов КМО:

Каждая строка матрицы коэффициентов соответствует определенной КМО, т.е. некоторому электрону. Каждый столбец матрицы соответствует определенному атому молекулы, и коэффициенты, входящие в этот столбец, показывают вклад отдельных электронов в свойства атома. В частности, квадрат коэффициента Сikдает вероятность нахождения электрона с номеромiв окрестности атома с номеромk, или, другими словами, электронную плотность на атоме с номеромk, создаваемую электроном с номеромi.
Электронная плотность атомов
Для расчета электронной плотности атома следует просто просуммировать такие плотности по всем электронам молекулы. Отсюда получается простая формула:

где Ci— коэффициент МО с номеромiпри атоме с номером,
ki— заселенность данной МО (число электронов).
Кроме средней электронной плотности, рассчитываемой по данной формуле, каждый атом можно охарактеризовать еще одним числом no, которое равно числу электронов, поставляемых данным атомом в общую электронную оболочку молекулы. Тогда разность между этим числом и реальной электронной плотностью будет представлять собой избыточный электрический заряд, локализованный в области пространства молекулы, занимаемой данным атомом:

Порядок химической связи
Порядок связи между парой атомов пропорционален величине электронной плотности в пространстве между соответствующими атомными ядрами. В свою очередь, электронная плотность определяется интерференционным эффектом для пары перекрывающихся АО. Этот эффект может быть конструктивным, когда перекрывающиеся АО имеют один и тот же знак (перекрывание "в фазе"), или деструктивным, когда перекрывающиеся АО имеют разные знаки (перекрывание "в противофазе"). В первом случае электрон, заселяющий МО, создает избыток отрицательного заряда в пространстве между ядрами, что приводит к появлению сил притяжения. Во втором случае между ядрами появляется узловая поверхность и электрон, заселяющий МО, вызывает отталкивание между ядрами.
В результате, порядок связывания между атомами, обусловленный электроном, заселяющим некоторую МО, пропорционален произведению коэффициентов этой МО при базисных АО, соответствующих данным атомам. Следовательно, для заданной пары атомов с номерами ипорядок связи может быть рассчитан по формуле:

Индекс свободной валентности.
Индекс свободной валентности некоторого атома молекулы рассчитывается по формуле:
Imax – P
гдеmax — некоторая калибровочная константа (для атомов углерода она, обычно принимается равной 4,732), аP— сумма порядков всех связей, которые атом с номеромобразует со своими соседями.
Результаты расчета молекулярных характеристик принято выражать в виде т.н. ”молекулярной диаграммы”, представляющей собой топологический граф молекулы, снабженный значениями зарядов атомов, порядков связей и индексов свободной валентности. В качестве примера приведем молекулярную диаграмму фульвена. Пользуясь молекулярной диаграммой, можно получить множество полезных сведений о свойствах молекул. Так, например, для молекулы фульвена мы видим, что эта молекула поляризована, несмотря на то, что ее скелет состоит из одинаковых атомов углерода.

Для отображения такой поляризации часто изображают структуру фульвена в виде резонанса между двумя крайними (резонансными) формами:
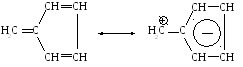
Кроме того, можно встретить и другой способ описания молекулярных характеристик — в виде т.н. "PQ-матрицы" (матрицы зарядов и порядков). Это квадратная матрица, размером (nn), причем по диагонали ее располагаются электронные плотности атомов (иногда — заряды атомов), а недиагональным элементам соответствуют порядки связей для данной пары атомов:

Возможность построения такой матрицы обусловлена использованием одинаковой расчетной формулы и для электронных плотностей атомов и для порядков связей. Эти формулы были предложены Коулсоном, и матрица поэтому часто называется "матрицей Коулсона". Очевидно, что рассмотренные расчетные формулы имеют конвенциональный характер и могут быть изменены. Действительно, существует и ряд других определений для величин, называемых "электронная плотность атома" и "порядок связи", приводящих к другим численным значениям. В качестве примера приведем т.н. "матрицу Малликена":

Здесь величины Sпредставляют собой интегралы перекрывания, а величиныxi — собственные числа т.н. "топологической" матрицы.
Поляризуемости.
Введем два типа параметров, характеризующих атомы и связи в молекуле.
1) остовный интегралr, равный энергии электрона, локализованного на АО данного атома молекулы с номеромr (абсолютная величина этого интеграла пропорциональна электроотрицательности атома);
2) резонансный интегралrs, равный энергетическому эффекту делокализации электрона (абсолютная величина этого интеграла пропорциональна прочности химической связи между атомами):

В результате, молекула будет характеризоваться набором локальных атомных (1,2, … ,n) и связевых (12,23, … ) параметров, которые определяют собой характер распределения электронной плотности в молекуле, т.е. заряды атомов (qr) и порядки связей (Prs). В частности, выполняются следующие соотношения:
nr = E / r и Prs = (1/2) E / rs
где Е— полная электронная энергия молекулы.
Более отрицательные значения остовных интегралов соответствуют более высокой электронной плотности. Например, в молекуле HClэлектронная плотность выше на атоме хлора, которому соответствует более отрицательное значение интеграла. Более отрицательные значения резонансного интеграла соответствуют более высоким порядкам связей, т.е. сосредоточению электронной плотности в промежутках между соответствующими атомами.
С помощью интегралов иудобно описывать различные внешние возмущения, которые носят локальный характер, т.е. направлены и влияют на отдельные атомы и связи (пары атомов). Такие возмущения могут возникать за счет химических изменений в молекуле (например, замещение одного атома на другой), взаимодействия с молекулами реагентов, молекулами растворителя, активными центрами катализатора и т.д. Предполагается, что эти возмущения приводят к изменению интегралови, и как следствие — к перераспределению электронной плотности в молекуле, т.е. к изменениям значений зарядов атомов (qr) и порядков связей (Prs).
Поляризуемости представляют собой количественные оценки степени восприимчивости (чувствительности) молекулы к внешним возмущениям.
Возмущения атомов.
Пусть за счет внешнего возмущения, направленного на атом r, его остовный интегралrизменился на небольшую величинуr:
r r + r
Тогда это возмущение вызовет — в качестве следствия — изменения во всех атомных электронных плотностях и порядках связей:
ns ns + ns
Pst Pst + Pst
Изменения nsиPstв первом приближении будут пропорциональны степени возмущения r(т.е. следствие пропорционально причине):
ns = s, r • r
Pst = st, r • r
Коэффициенты пропорциональности называются поляризуемостями "атом-атом" (s, r) и "связь-атом" (st, r). Поляризуемостьs, rпоказывает, насколько электронная плотность на атомеsчувствительна к возмущениям остовного интеграла атомаr. Поляризуемостьst, rпоказывает, насколько электронная плотность между атомамиsиt(т.е. порядок связиPst) чувствительна к возмущениям остовного интеграла атомаr.
Возмущения химических связей.
Пусть за счет внешнего возмущения, направленного на химическую связь между атомами r иs, соответствующий резонансный интегралrsизменился на небольшую величинуrs:
rs rs + rs
Тогда это возмущение, аналогично возмущению атома, вызовет изменения во всех атомных электронных плотностях и порядках связей:
nt nt + nt
Ptu Ptu + Ptu
Изменения ntиPtuв первом приближении будут пропорциональны степени возмущенияrs(т.е. следствие пропорционально причине):
nt = t, rs • rs
Ptu = tu, sr • rs
Коэффициенты пропорциональности называются поляризуемостями "атом-связь" (t, sr) и "связь-связь" (tu, rs). Поляризуемостьt, srпоказывает, насколько электронная плотность на атомеtчувствительна к возмущениям резонансного интеграла связи между атомамиr и s. Поляризуемостьtu, srпоказывает, насколько электронная плотность между атомамиtиu(т.е. порядок связиPtu) чувствительна к возмущениям резонансного интеграла связи между атомамиr и s.
Поляризуемости r, r и rs, rsчасто называют атомными и связевымисамополяризуемостями.
Для поляризуемостей выполняется ряд полезных соотношений.
1) rs = sr = ns / r = nr / s
2) st, r = Pst / r
3) t, rs = nt / rs = 2st, r = 2 Pst / r
4) tu, rs = rs, tu = Ptu / rs = Prs / tu
5) r, r 0; rs, rs 0
6) rs = 0; t, rs = 0
Зная величины поляризуемостей, можно сравнительно легко и надежно решать ряд химических задач:
1) предсказывать результат внешнего возмущения в виде изменений в зарядах атомов и порядках связей, а, следовательно, и в реакционной способности молекулы:
2) анализировать закономерности в изменения свойств в рядах аналогичных по строению молекул.
Например, в молекуле нафталина все атомы скелета одинаковы (атомы углерода) и поэтому электронная плотность распределена равномерно — заряды всех атомов равны нулю. Замещение одного из атомов углерода на атом азота с более отрицательным значением остовного интеграла (N) вызовет перераспределение электронной плотности. На некоторых атомах, для которых поляризуемость отрицательна, электронная плотность возрастет (0) и появятся отрицательные заряды. На других атомах, для которых поляризуемость положительна, электронная плотность снизится (> 0) и появятся положительные заряды.

Рассмотренные численные характеристики молекулы, имеющие локальный характер: атомные электронные плотности и заряды атомов, порядки связей, индексов свободной валентности, поляризуемости и др. часто используются для оценки реакционной способности молекулы и в этом случае называются индексами реакционной способности(ИРС).
Так же как метод ВС, метод МО имеет множество приближенных вариантов, основным из которых является метод локализованных МО (ЛМО).
Метод ЛМО (локализованные молекулярные орбитали)
Рассмотренный выше вариант метода МО ЛКАО — метод канонических молекулярных орбиталей (КМО), отличается тем, что он плохо согласуется с классическими структурными представлениями о молекуле, как совокупности атомов, связанных локализованными и бинарными химическими связями. Строго говоря, в методе КМО отсутствуют даже сами понятия "атом" и "химическая связь". Поэтому были разработаны и другие варианты метода МО, более адаптированные к классическим структурным моделям молекулы. Одним из них является метод локализованных молекулярных орбиталей(ЛМО).
В основе метода лежит предположение о том, что любую молекулу можно построить из двух фрагментов: XnA* + *BYmXnA—BYm
Предполагается также, что реакционная способность фрагментов локализована на их отдельных атомах A* и *B, так что в результате их химического взаимодействия образуется бинарная и локализованная связьA—B. При этом остальные фрагменты молекулы (атомыXиY) сами не изменяются и не влияют на взаимодействие химически ненасыщенных атомов А и В.
В результате такого представления оказывается возможным описать в рамках метода МО только фрагмент молекулы, включающий два выделенных атома и химическую связь между ними, абстрагируясь от остальных ее частей. Затем процедура описания поочередно повторяется для всех остальных связей:

Другими словами, вместо одной глобальной модели молекулы получается множество локальных моделей — по одной для каждой химической связи (пары связанных атомов). Эти модели удобны еще и тем, что они являются двухэлектронными, как в простейшем случае молекулы водорода (см. задачу о молекуле водорода в семинарских занятиях):
–А• •В– –А—В–( –А:–+В– )
В результате построение таких локальных моделей гораздо проще, чем глобальной КМО-модели. Из теории двухатомных молекул известно, что при взаимодействии двух атомов (А и В), поставляющих по одному электрону, каждый из которых находится на своей атомной орбитали (аиb, соответственно), волновая функция молекулы получается в виде определителя Слэтера:
Ф = || 1 2 ||
где молекулярные орбитали (1 и2) имеют универсальную форму:
1 = C11 • a + C12 • b 2 = C21 • a – C22 • b
причем для разных типов взаимодействующих атомов отличия сводятся лишь к конкретным числовым значениям коэффициентов Сij. Другими словами, всегда образуется одна безузловая МО и одна МО с единственным узлом между ядрами взаимодействующих атомов.

Энергетические и корреляционные диаграммы разных двухатомных молекул также выглядят в качественном отношении одинаково.

Можно заметить, что одна из МО (безузловая) всегда имеет энергию ниже, чем у любой из базисных АО, тогда как энергия второй МО всегда выше. Поэтому переход электрона с АО на безузловую МО (1) сопровождается уменьшением энергии и возрастанием устойчивости молекулы. Напротив, переход электрона с АО на МО с узлом (2) сопровождается возрастанием энергии и снижением устойчивости молекулы. По этой причине первая МО обычно называетсясвязывающей, а вторая —разрыхляющей.
Ввиду локального характера ЛМО, их симметрия также описывается локальным образом — относительно ТГС не всей молекулы, а лишь ее двухатомного фрагмента. Такие фрагменты всегда имеют одну и ту же аксиальную симметрию. ЛМО, соответствующие типам симметрии в этом случае имеют в поперечном разрезе следующий вид:

Здесь легко увидеть аналогию с шаровыми АО s-,p-,d-типов, из которых данные ЛМО и образуются. Отсюда следует важный вывод: при образовании химической связи состояния электронов взаимодействующих атомов должны относиться к одному типу симметрии. В противном случае интеграл перекрывания будет равен нулю и взаимодействие атомов не приведет к образованию химической связи. В этом отношении часто говорят об "эффективных" и "не эффективных" способах перекрывания АО.

Таким образом, модель электронной оболочки молекулы в методе ЛМО выглядит следующим образом.
1) Каждой паре химически связанных атомов (т.е. химической связи, валентному штриху, льюисовской связывающей электронной паре) сопоставляется орбитальная модель, включающая две ЛМО:
а) связывающую(не имеющую узлов), с пониженной энергией, заселенную электронной парой,
б) разрыхляющую(с одним узлом), с повышенной энергией, не заселенную электронами (вакантную).
2) В случае кратных связей между двумя атомами, каждая связь считается независящей от остальных и описывается отдельно.

3) У некоторых атомов остаются электроны, не участвующие в образовании связывающих пар — несвязывающиеилинеподеленныеэлектроны или электронные пары. Такие электроны описываются локализованными АО, не участвующими в линейных комбинациях с другими АО. Некоторым атомам приписываются вакантные АО, также не участвующие в линейных комбинациях с другими АО. Такие АО называютсялакунами.
Примерами таких молекул могут служить соединения трехвалентного азота и трехвалентного бора:

Главное достоинство метода ЛМО заключается в его почти полном соответствии классическим структурным представлениям, когда молекула рассматривается как совокупность атомов, связанных химическими связями. Классический подход к строению молекулы сохраняется и в электронной теории Льюиса, где в структурной модели молекулы валентные штрихи заменяются связывающими электронными парами, и, кроме того, добавляются неподеленные электронные пары и лакуны. В методе ЛМО связывающим электронным парам сопоставляется связывающая ЛМО, а неподеленным парам и лакунам — атомные орбитали.
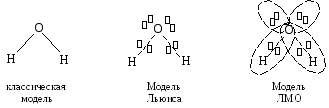
Другими словами, модель ЛМО можно рассматривать как развитие и усовершенствование классической теории химического строения молекул.
В результате введения модели ЛМО химики получают возможность решать ряд важных задач:
1) обсуждать и объяснять химические свойства молекул, установленные экспериментально,
2) интерпретировать классические структурные характеристики молекулы с учетом движения электронов и квантовомеханических законов,
3) ввести и использовать новые характеристики химических связей, такие как:
а) симметрия и узловая структура электронного облака;
б) тип связи: -,-,- связи,s-s,s-p,p-p-связи и т.д.;
в) частичные электрические заряды атомов;
г) порядки связи;
д) индексы свободной валентности;
е) поляризуемости различных типов и др.
4) интерпретировать квантовомеханические понятия и численные параметры орбитальной модели на основе экспериментальных химических данных.
Модель ЛМО имеет ряд существенных недостатков. Во-первых, эта модель явным образом противоречит квантовой механике: всякий электрон в составе молекулы должен двигаться во всем ее объеме и не может быть локализован в окрестности только двух ядер. Второй, наиболее важный, момент заключается в том, что во многих случаях простая модель ЛМО приводит к противоречию с опытом, что требует введения многочисленных поправок и дополнений в структурную модель молекулы, получаемую в рамках метода ЛМО. Рассмотрим два типа таких поправок.
Гибридизация АО
Возьмем для примера комплексный ион аммиаката никеля: [Ni(NH3)6]2+. Классическая структурная модель предсказывает наличие в этом ионе шести одинаковых связей (Ni—NH3) между ионом-комплексообразователем и лигандами. Поскольку в рамках метода ЛМО каждой связи соответствует пара перекрывающихся АО, ион никеля должен располагать шестью вакантными АО, необходимых для принятия электронных пар от лигандов, причем все они должны быть абсолютно одинаковы:

В то же время, орбитальная модель иона никеля приводит к другой картине:

Следовательно, мы должны либо отказаться от применения метода ЛМО, либо предположить, что в процессе образования комплекса некоторые орбитали иона никеля претерпевают определенное изменение:

В результате такой "перегруппировки" из разных АО образуются одинаковые:
4s + 4px + 4py + 4pz + 4d' + 4d'' = 6
Такой процесс называется гибридизацией, а образующиеся АО — гибридизованнымиилигибриднымиорбиталями (ГАО). Возможность такого процесса вполне очевидна с точки зрения основного закона квантовой механики — принципа суперпозиции. Шаровые АО образуют всего лишь один их базисных наборов в пространстве состояний атома. Именно этот набор является стационарным в условиях полной изоляции атома, когда атом сферически симметричен. Однако, когда атом взаимодействует с окружением из шести лигандов, расположенных по вершинам октаэдра, стационарным становится другой набор, а именно — набор гибридизованных АО. Отсюда вытекает и способ построения ГАО из исходных шаровых АО. Два любых базиса связаны линейным преобразованием посредством некоторого унитарного оператора:

Другими словами, каждая ГАО является линейной комбинацией шаровых АО, задаваемой коэффициентами матрицы U. Конкретный тип гибридизации определяется симметрией окружения атома. Так, для иона никеля в октаэдрическом окружении шести лигандов стационарными являются ГАОsp3d3-типа, для атома углерода в тетраэдрическом окружении (метан, четыреххлористый углерод и др.) стационарным является базисный набор ГАОsp3-типа и т.д.
Несмотря на большое разнообразие геометрических форм молекул, обычно используется небольшой набор типов гибридизации, который соответствуют геометрически правильным многогранникам:
|
Тип молекулы |
Тип гибридизации АО центрального атома |
|
Линейный L1—A— L2 |
sp |
|
Плоский треугольный АL3 |
sp2 |
|
Тетраэдрический AL4 |
sp3 |
|
Плоский квадратный ML4 |
dsp2 |
|
Тригональная бипирамида ML5 |
sp3dилиdsp3 |
|
Тетрагональная бипирамида (октаэдр) ML6 |
sp3d2илиd2sp3 |
Можно отметить, что ГАО отличаются от шаровых АО в отношении пространственной формы. Если шаровые АО центрированы на ядре и принадлежат определенному типу симметрии (т.е. при действии операций симметрии переходят сами в себя с сохранением знаков или с переменой их на противоположные), то ГАО уже не являются центрально-симметричными. Хотя узловая структура сохраняется, части ГАО, разделенные узловой поверхностью, не равны друг другу. Следствием этого является наличие выделенной пространственной ориентации ГАО в пространстве. Для примера рассмотрим простой случай гибридизации: ГАО1=s+px

Из рисунка видно, что полученная ГАО вытянута в положительном направлении оси Х и имеет не шаровую, а только аксиальную симметрию. Аналогичный вид имеет и вторая ГАО ( s–px ), но она вытянута в противоположном направлении.
В случае молекулы метана исходный шаровой базис надо преобразовать так, чтобы в результате получить набор 4-х ГАО, отличающихся друг от друга только ориентацией в пространстве около ядра атома С. Для решения этой задачи подходит следующее преобразование:

ГАО данного вида называются sp3-гибридизованными(каждая является ЛКs‑орбитали и трехр-орбиталей). Если построить полярные диаграммы этих ГАО, то будет ясно видна их идентичность друг другу. Единственное отличие между ними заключается в том, что они ориентированы по различным направлениям в пространстве — по вершинам тетраэдра.

Другой случай гибридизации имеет место для атомов углерода, имеющих только три соседних (химически связанных) атома, как это имеет место в случае молекул этилена или бензола. Такие атомы имеют плоскую конфигурацию и для образования трех однотипных связей со своими соседями атом углерода должен иметь три идентичные ГАО, направленные по вершинам плоского треугольника. Такие ГАО можно получить, строя ЛК из трех шаровых АО: ( 2s2px2py)( ГАО1ГАО2ГАО3 ). Они имеют следующий вид:

ГАО такого типа называются sp2-гибридизованными. Характерно, что, наряду с тремя ГАО, атом углерода сохранил и одну негибридизованную (шаровую) АО, которая может участвовать в образовании ЛМО-типа.
Таким образом, ГАО вытянуты вдоль определенных пространственных осей, соответствующих расположению химических связей в молекуле. Поэтому геометрия совокупности ГАО всегда полностью соответствует геометрии молекулы. Это позволяет, с одной стороны, подбирать тип гибридизации на основе информации о геометрии молекулы, а с другой стороны, по типу гибридизации предсказывать эту геометрию. Следует подчеркнуть, что концепция гибридизации АО необходима только в рамках приближенной модели ЛМО.
Эффекты сопряжения
В модели ЛМО предполагается, что электроны образуют локализованные двухцентровые облака, которым и соответствуют ЛМО. Достаточно очевидно, что такое представление физически неверно — каждый электрон молекулы может двигаться во всем ее объеме. Для того, чтобы в некоторой степени исправить этот недостаток модели ЛМО, ее дополняют т.н. "эффектами сопряжения", смысл которых сводится к учету перекрывания соседних двухцентровых электронных облаков. Например, в молекуле бутадиена ( С=С—С=С ) предполагается наличие двух пар -ЛМО:

Электронные облака предполагаются достаточно объемными, так что они способны перекрываться в пространстве. Это перекрывание должно приводить к взаимодействию электронных пар и изменениям в характере их движения. На энергетической диаграмме это выражается следующим образом:

В результате взаимодействия электронные облака делокализуются и соответствующие им делокализованные орбитали (ДЛМО) становятся похожими на КМО.
Характер перераспределения электронной плотности в молекуле за счет эффекта сопряжения отражается в классических структурных формулах с помощью изогнутых стрелок или т.н. "неклассических формул":

На этом примере можно видеть, что введение эффектов сопряжения сближает метод ЛМО с методом резонанса. Неклассическая формула, получаемая посредством учета эффекта сопряжения, может быть получена как резонансный гибрид двух РФ:

Поэтому, по аналогии с методом резонанса, эффекты сопряжения в методе ЛМО часто называют "мезомерными эффектами".
Эффекты сопряжения проявляются не во всех случаях одинаково. Можно выделить несколько типичных ситуаций, когда этими эффектами нельзя пренебрегать.
1) –-сопряжение, имеющее место при определенном (соседнем) расположении в молекуле кратных связей-типа (аналогично тому, как это имеет место в молекуле бутадиена):

.
2) n–-сопряжение, когда вместо одной из кратных связей имеется неподеленная пара электронов, заселяющая атомную орбиталь:

3) р–-сопряжение, когда вместо одной из кратных связей имеется вакантная АО, локализованная на электронодефицитном атоме:

4) –-сопряжениеилигиперконъюгация(сверхсопряжение), когда вместо одной из кратных связей имеется достаточно полярная-связь (обычно, с атомом водорода):

Результатом учета эффектов сопряжения (мезомерных эффектов) является некоторая делокализация электронов молекулы, и, следовательно, приближение грубой модели ЛМО к более правильной — модели КМО.
Индуктивные эффекты.
Двухцентровые орбитали, используемые в модели ЛМО, также позволяют рассчитывать атомно-связевые характеристики, такие как средние электронные плотности на атомах, порядки связей, поляризуемости и т.д. Все эти характеристики, однако, относятся лишь к тому двухядерному фрагменту молекулы, но который распространяются ЛМО. В частности, избыточные электрические заряды, рассчитываемые через коэффициенты ЛМО, всегда характеризуют только два химически связанных атома.
Например, в молекуле алкилгалогенида связь C—Clможно описать парой электронов, заселяющей ЛМО-типа:
= D1 • sp3(C) + D2 • p(Cl)
При этом, в соответствии с общим правилом, средние электронные плотности атомов углерода и хлора будут равны 2(D1)2и 2(D2)2, соответственно. Поскольку коэффициенты неодинаковы (D1<D2), то на атоме хлора будет избыточный отрицательный заряд, а на атоме углерода — положительный.
В действительности, распределение электронной плотности более равномерное, что отражается поправкой, вносимой в модель ЛМО, называемой индуктивным эффектом. Смысл этого эффекта сводится к индуктивному поляризующему влиянию дипольного момента связи C—Clна соседние фрагменты молекулы:

Другими словами, индуктивный эффект показывает, что влияние электроноакцепторного или электронодонорного атома не ограничивается только его непосредственными соседями, но и распространяется на атомы второго окружения и т.д., а в конечном итоге — на всю молекулу. Индуктивное влияние значительно ослабевает по мере увеличения числа участвующих в нем химических связей.
Таким образом, мезомерные и индуктивные эффекты позволяют до некоторой степени исправить грубую картину распределения электронной плотности в молекуле, даваемую методом ЛМО. Соответственно, такие исправления вносятся и в заряды атомов, и в порядки связей.
Следует подчеркнуть, что поправки в виде мезомерных и индуктивных эффектов носят, как правило, качественный характер. К сожалению, простых и надежных способов количественного учета таких эффектов не существует. Поэтому при необходимости получать количественные результаты следует пользоваться методом КМО, невзирая на отсутствие у него наглядности и согласованности с классическими структурными представлениями.
Таким образом, строение электронной оболочки молекулы можно описывать по-разному:
1) посредством полных методов ВС или КМО, позволяющих построить глобальную электронную волновую функцию в виде комбинации АО тех атомов, которые участвуют в построении молекулы;
2) посредством различных приближенных и упрощенных вариантов, таких как метод резонанса, метод ЛМО и др., которые более или менее адаптированы к классическим химическим представлениям.
Выбор варианта описания определяется характером поставленных химических задач. Профессиональная грамотность и искусство химика определяются его умением выбрать такой способ описания, который приводил бы к надежным и полезным результатам с наименьшими усилиями.
