
Строение В-ва и Осн.Квант.Химии / лекции (текст) / 11-Ядерный остов молекул
.docЯдерный остов молекул
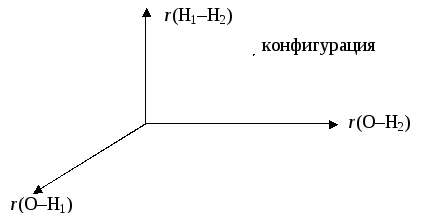
Наиболее существенным отличием молекул от атомов является наличие нескольких атомных ядер, составляющих, в совокупности ядерный остов молекулы. Относительное расположение ядер в пространстве можно задать совокупностью межъядерных расстояний {rij}. Ядра молекулы не закреплены какими-либо жесткими связями и могут перемещаться относительно друг друга, так что межъядерные расстояния оказываются переменными величинами. Для описания всех возможных состояний ядерного остова удобно использовать т.н. "конфигурационное пространство" (КП), координатным осям в котором соответствуют отдельные межъядерные расстояния. Каждая точка КП изображает некоторую конкретную пространственную конфигурацию ядерного остова молекулы. Например, для трехядерной молекулы воды КП будет аналогичным обычному трехмерному евклидовому пространству:
Знание конфигурации молекулы важно в том отношении, что от межъядерных расстояний зависит характер движения электронов и, следовательно, суммарная электронная энергия молекулы Еэл. Кроме того, электрические заряды ядер порождают кулоновские силы отталкивания между ними, с которыми связан еще один вклад в полную энергию молекулы — Еяд. Эта ядерная энергия также зависит от межъядерных расстояний. В результате можно определить функцию: Е = Еэл + Еяд = f(rij), которая является важной характеристикой любой молекулы. Она называется поверхностью потенциальной энергии (ППЭ). Точный вид ППЭ (за исключением простейших молеклу типа Н2) неизвестен. Однако для любой заданной конфигурации (конкретной точки КП) ее значение можно вычислить методами ВС и МО. Повторяя такие расчеты для множества соседних точек КП, можно с достаточной точностью построить любой интересующий нас фрагмент ППЭ.
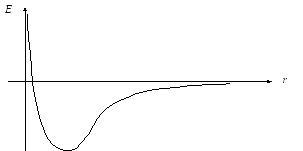
В простых случаях можно построить график этой функции. Например, для двухатомных молекул конфигурационное пространство одномерно и представляет собой прямую линию ( r ),. Соответственно, графиком ППЭ является одномерная кривая: E = f ( r ):
Для двумерного (плоского) конфигурационного пространства график ППЭ представляет собой искривленную двумерную поверхность, а в более сложных случаях — гиперповерхность той же размерности, что и само КП.
Для описания особенностей ППЭ можно использовать два приема:
а) энергетические карты,
б) энергетические профили.
Энергетическая карта ППЭ представляет собой совокупность уровней постоянной энергии E = const. Ее размерность такая же, как у КП, и поэтому карта является наглядной только для простых молекул.
Энергетический профиль — это сечение ППЭ вертикальной поверхностью, обычно соответствующей некоторому направлению в КП (определенное межъядерное расстояние или их комбинация). Профиль всегда двумерный, и поэтому данный метод пригоден для любых случаев.
Молекулы, как и атомы, являются агрегатами из атомных ядер и электронов. Однако существенным отличием молекул является наличие нескольких атомных ядер, составляющих в совокупности ядерный остов молекулы. Это приводит к появлению у молекул целого ряда дополнительных характеристик. Выделим основные из них.
1) Пространственные (геометрические) характеристики. В отличие от электронов, каждое атомное ядро можно охарактеризовать определенным (средним) положением в пространстве относительно остальных ядер молекулы. Соответственно, вся совокупность ядер молекулы обладает определенной пространственной конфигурацией, характеризующей такие относительные положения ядер, и которую удобно описывать:
а) совокупностью межъядерных расстояний { rij },
б) определенной геометрической моделью — ядерным полиэдром (отрезок прямой, угол, треугольник, квадрат, тетраэдр, пирамида, бипирамида, октаэдр и т.д.)
У атомов подобные геометрические характеристики отсутствуют. Более того, все атомы в геометрическом отношении совершенно однотипны — их можно описать единственной моделью «шар», форма которой обусловлена сферической симметрией электрического поля единственного атомного ядра.
2) Кинематика. Ядра молекулы не закреплены какими-либо жесткими связями и могут перемещаться относительно друг друга. (Амплитуда этих движений невелика, так что в результате пространственная форма молекулы может искажаться, но не изменять свой тип. Так, в пирамидальной молекуле аммиака при относительном движении ядер искажаются валентные углы между связями N–H, но форма молекулы остается пирамидальной.) Следовательно, молекулы имеют дополнительные степени свободы, связанные с изменением межъядерных расстояний. Другими словами, молекуле можно приписать множество состояний, каждое из которые характеризуется определенной пространственной конфигурацией ядерного остова. Полная совокупность таких состояний образует особое пространство состояний, которое называется конфигурационным пространством (КП), координатные оси которого соответствуют межъядерным расстояниям. Например, для молекулы воды (и других трехъядерных молекул) КП является трехмерным:

3) Энергия. Атомные ядра имеют одноименные электрические заряды и отталкиваются друг от друга. Это приводит к появлению специфического вклада в полную энергию — ядерной энергии молекулы:
Е = Еэл. + Еяд.
Ядерная энергия, очевидно, зависит от химической природы атомов (зарядов ядер), образующих молекулу, и от ее пространственной конфигурации:
Еяд = f (rij, Zk)
Кроме того, характер движения электронов существенным образом зависит от суммарного электрического поля, создаваемого ядрами. Следовательно, и энергия электронной оболочки, и полная энергия молекулы зависят от ядерного остова:
Е = Еэл. + Еяд. = g (rij, Zk) + f (rij, Zk)
4) Силы. Поскольку энергия молекулы явным образом зависит от конфигурации ядерного остова, то при любых изменениях межъядерных расстояний внутри молекулы будут возникать механические силы притяжения или отталкивания:
Fij = – dE / drij
которые, в общем случае, должны вызывать относительные перемещения ядер. Опыт говорит о том, что молекулы, как правило, существуют в устойчивых, стационарных состояниях с неизменными межъядерными расстояниями. Отсюда следует, что таким состояниям соответствуют минимумы полной энергии молекулы, когда все силы полностью уравновешены.
{Стационарное состояние} Емин. Fij = 0
Для решения указанных проблем, связанных с дополнительными характеристиками молекул, удобно использовать специальную модель — поверхность потенциальной энергии (ППЭ), которую можно определить как функцию:
E = f(rij ),
где Е — полная внутренняя энергия молекулы, включающая энергию электронной оболочки и энергию межъядерного отталкивания (ее можно рассчитать методами ВС и МО).
Топология молекул
С помощью энергетических профилей можно решать ряд важных химических задач, касающихся строения молекул.
Если выбрать в КП определенную точку (геометрическую конфигурацию), то для нее можно исследовать энергетические профили, соответствующие всем межъядерным расстояниям. При этом оказывается, что все эти профили можно отнести к одному из двух стандартных типов.

Соответственно, все пары ядер молекулы можно также подразделить на два типа:
несвязанные (энергетический профиль I типа)
связанные (энергетический профиль II типа)
Если ядра изобразить точками и точки, соответствующие связанным парам ядер, соединить линиями, получится графический образ молекулы — ее топологический граф Разновидностью таких графов являются известные структурные формулы классической химии.
С помощью топологического графа можно определить важную характеристику для определенной совокупности атомных ядер и электронов — химическую форму. Любой ХФ соответствует определенная область КП. Любая точка КП в этой области характеризуется одним и тем же топологическим графом.
Например, для линейной трехъядерной системы (A•••B•••C) КП двумерно и его можно изобразить на плоскости. Если ядра А, В и С соответствуют одновалентным атомам, то в КП существуют две области, соответствующие двум химическим формам:

Переход через границу раздела между двумя разными ХФ соответствует некоторому химическому превращению, в ходе которой меняется топология или связность системы (одни химические связи исчезают, а другие появляются).
Совокупность таких химических форм и химических превращений для некоторой ядерно-электронной системы удобно изображать с помощью специального конфигурационного графа, в котором вершины соответствуют химическим формам, а ребра — химическим реакциям.
Если проанализировать одно из ребер такого графа с помощью ППЭ, то можно заключить, что химическое превращение должно осуществляться с наименьшими энергетическими затратами. Тогда ему будет соответствовать некоторая кривая в КП, соединяющая две ХФ. Такая кривая называется траекторией химического превращения (координатой реакции).
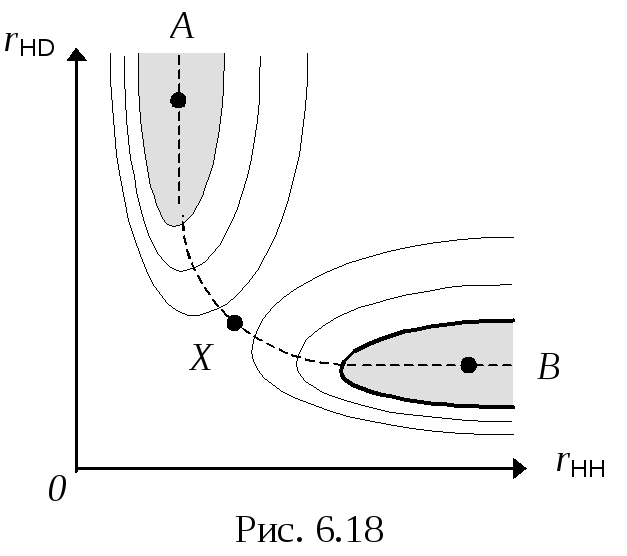
Построив вдоль этой траектории вертикальную поверхность, можно получить специальный энергетический профиль — профиль элементарного акта (элементарной химической реакции).
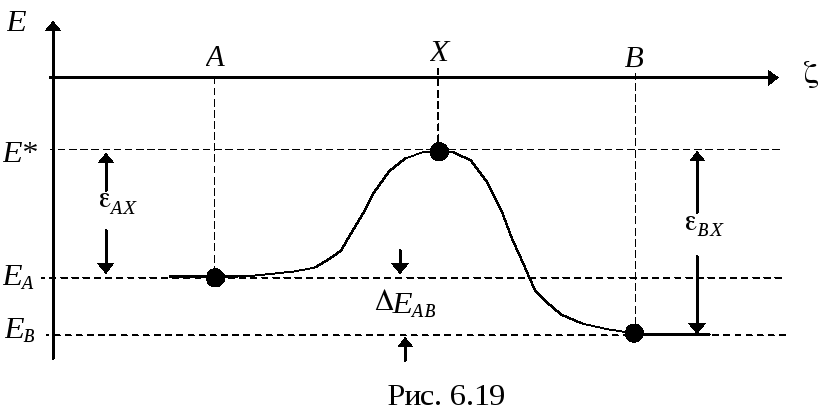
На таком профиле всегда имеются два минимума, соответствующие двум устойчивым состояниям — начальному и конечному. Разность энергий этих минимумов представляет собой важную характеристику ЭА — энергетический эффект (Е), который можно использовать для оценивания энергетических эффектов (Н) макроскопических химических процессов
Кроме того, относительные глубины минимумов определяют собой положение химического равновесия. Используя модель канонического ансамбля, можно получить константу равновесия в виде отношения заселенностей двух химических форм:
K = NII / NI = exp (– EII / kT) / exp (– EI / kT) = exp (– Е / kT)
Между минимумами химических форм всегда находится разделяющий их энергетический (потенциальный) барьер, высота которого имеет важное значение для скорости химического превращения. Для преодоления барьера молекулы исходной ХФ должны получить извне порцию энергии, равную Еа (энергия активации). Как правило, эта энергия заимствуется молекулами из термостата. В этом случае с помощью фактора Больцмана можно оценить вероятность превращения, пропорциональную константе скорости реакции:
РIII ~ exp (– Ea / kT) ~ k
и обосновать известное равенство химической кинетики:
K = k / k
Вероятности переходов:
-
энергетический множитель,
-
стерический множитель,
-
трансмиссионый коэффициент.
Переходное состояние, его структура, связь с энергией активации.
Толщина потенциального барьера. Химическое расстояние.
Форма потенциального барьера. Постулат Хэммонда. Два типа химических реакций:
-
деформация электронной оболочки,
-
образование интермедиатов,
-
механизм реакции.
Геометрическая форма молекул:
-
длины связей и валентные углы,
-
тип формы (метод ОЭПВО).
Молекулы с флуктуирующей структурой:
-
топологические флуктуации,
-
геометрические флуктуации,
-
конформационные степени свободы.
Спиновые свойства ядерного остова.
Ядерные спины, их описание.
Глобальные спиновые состояния.
Расщепление во внешнем магнитном поле. ЯМР-спектроскопия.
