
- •Физика атома, атомного ядра и элементарных частиц
- •Уравнение Шредингера для водородоподобного ато-
- •Волновые -функции (собственные функции урав- нения (12.1)) содержат три целочисленных пара-
- •Графические изображения некоторых функций
- •Вид волновой функции и вероятности нахождения электрона в основном состоянии атома водорода.
- •Вид волновой функции и вероятности нахождения электрона в первом возбужденном состоянии атома водорода.
- •Энергия электрона определяется формулой, в точ- ности совпадающей с результатом, полученным в рамках
- •Момент импульса электрона в атоме определяет- ся орбитальным квантовым числом l:
- •Проекция момента импульса на выделенное на- правление (например, на направление внешне- го магнитного
- •Для наглядности пространственное квантова- ние вектора момента импульса часто изобра- жают графически на
- •Спин (собственный механический момент импуль- са электрона) определяется спиновым кванто-
- •Уровни энергии атома водорода. Толщина линии соответствует вероятности перехода.
- •Схематическое изо- бражение уровней энергии и переходов между ними в атоме водорода
- •Итак, состояние электрона в атоме определяется четырьмя квантовыми числами, перечисленны- ми выше:
- •Согласно принципу Паули, для каждого электрона в атоме эта четверка чисел должна быть
- •Число различных состояний, соответствующих данному орбитальному квантовому числу l, рав-

Спин (собственный механический момент импуль- са электрона) определяется спиновым кванто-
вым числом s, которое для одного электрона имеет фиксированное значение s = 1/2:
S = h s(s +1) |
3 |
h |
(12.7) |
2 |
|
Проекция спина на выделенное направление (на- |
||
пример, на направление внешнего магнитного |
||
поля) определяется магнитным спиновым кван- |
||
товым числом ms: |
SZ = hms |
(12.8) |
Магнитное спиновое квантовое число ms может |
||
принимать два значения: |
|
|
|
ms = ±1/2 |
(12.9) |

Уровни энергии атома водорода. Толщина линии соответствует вероятности перехода.
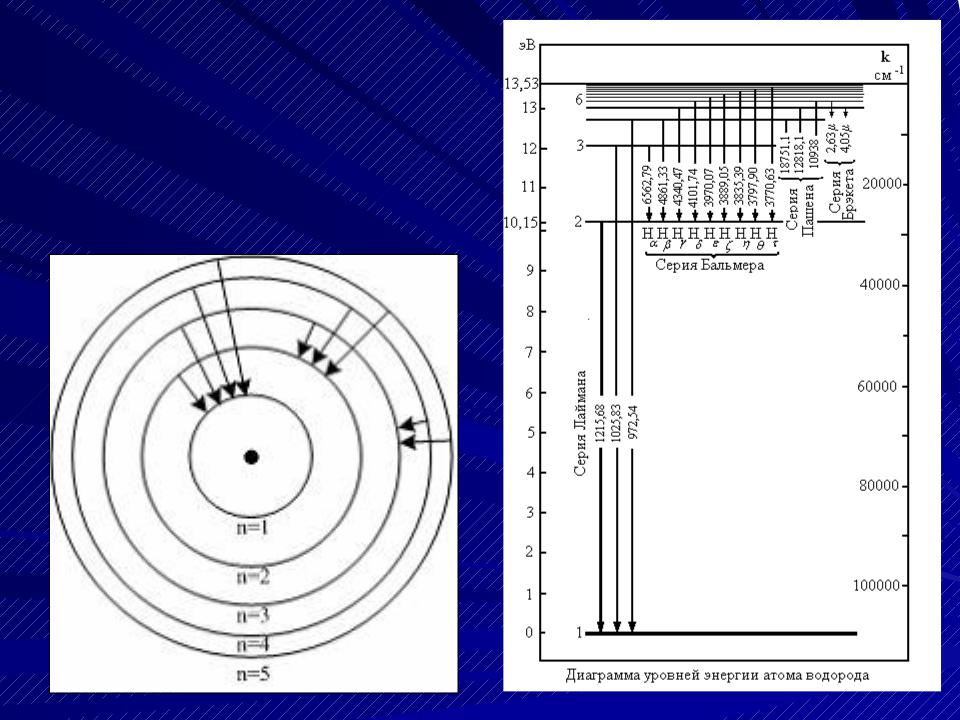
Схематическое изо- бражение уровней энергии и переходов между ними в атоме водорода

Итак, состояние электрона в атоме определяется четырьмя квантовыми числами, перечисленны- ми выше:
главным n: |
n = 1, 2, 3, ... |
|
|
орбитальным l: |
l = 0, 1, 2, ..., (n-1) |
||
магнитным m: |
m = 0, ±1, ±2, …, ± l, |
||
магнитным спиновым ms : |
ms |
= ±1/2 |
|

Согласно принципу Паули, для каждого электрона в атоме эта четверка чисел  должна быть уникальной, или по-друго- му: в атоме не может быть двух элект- ронов с одинаковой четверкой кванто- вых чисел, т.е. хотя бы одним квантовым числом каждый электрон должен отли-
должна быть уникальной, или по-друго- му: в атоме не может быть двух элект- ронов с одинаковой четверкой кванто- вых чисел, т.е. хотя бы одним квантовым числом каждый электрон должен отли-  чаться от всех остальных электронов в атоме.
чаться от всех остальных электронов в атоме. 

Число различных состояний, соответствующих данному орбитальному квантовому числу l, рав-
но 2(2l+1) (это максимально возможное число электронов на оболочке), а число состояний, соответствующих данному главному квантовому
числу n, равно: n-1 |
|
2(2l +1)= 2n2 |
(12.10) |
l=0
это максимально возможное число электронов на слое. 
