
X-сн2соон
|
Х |
Наименование кислоты |
Константа ионизации, Ка . 105 |
Знак индукционного эффекта |
|
CH3 |
Пропионовая |
1.35 |
+I |
|
H |
Уксусная |
1.77 |
I =0 |
|
CH2=CH |
3-Бутеновая |
4.57 |
–I |
|
C |
3-Бутиновая |
25.70 |
–I |
|
CH3O |
Метоксиуксусная |
29.5 |
–I |
|
F |
Фторуксусная |
269 |
–I |
C удя
по величине константы ионизации Ка
следует, что –I-эффект
возрастает в ряду CH2=CH
< СН=С< CH3O
< F.
удя
по величине константы ионизации Ка
следует, что –I-эффект
возрастает в ряду CH2=CH
< СН=С< CH3O
< F.
Другим путем отражения индукционного эффекта является метод протонного магнитного резонанса (ПМР). Не вдаваясь в подробности, скажем, что наличие электроноакцепторных заместителей уменьшает электронную плотность на атоме водорода (атом водорода «менее экранирован»). При этом сигнал наблюдается в области «слабого поля», чему соответствует большее значение химического сдвига (см. Табл.6).
Таблица 6
Значение величины химического сдвига (δ) ядер водорода в метане
и его производных СН3Х
|
Х |
Наименование соединения |
Химический сдвиг, δ, м.д. |
|
H |
Метан |
0.23 |
|
I |
Йодометан |
2.16 |
|
Br |
Бромометан |
2.68 |
|
Cl |
Хлорометан |
3.05 |
|
F |
Фторометан |
4.26 |
|
NO2 |
Нитрометан |
4.30 |
Нетрудно видеть, что величина химического сдвига в производных метана растет в ряду, соответствующем росту –I-эффекта заместителей:
H < I < Br < F < NO2
Интенсивность (сила) индукционного эффекта быстро уменьшается с расстоянием. Нам уже известно, что введение электроноакцепторного заместителя в боковую цепочку приводит к увеличению силы кислоты (см. Табл.5). Но если этот заместитель удалять от карбоксильной группы, влияние вносимых изменений будут быстро уменьшаться. Рассмотрим это на примере бутановой кислоты и её хлорсодержащих производных. Примем за ∆рКа разность рКа бутановой и хлорбутановой кислот.
-
Кислота
рКа
∆ рКа
CH3-CH2-CH2-COOH
бутановая
4.82
-
CH2Cl-CH2-CH2-COOH
-γ-хлорбутановая
4.52
0.30
CH3-CHCl-CH2-COOH
β-хлорбутановая
4.06
0.76
CH3-CH2-CHCl-COOH
α-хлорбутановая
2.84
1.98
Из риведенных данных следует, что наибольшее изменение ∆рКа наблюдается для α-хлорбутановой кислоты, а наименьшее – для -γ-хлорбутановой, в которой атом хлора наиболее удален от карбоксильной группы.
Обобщая экспериментальные данные, можно сделать следующие основные выводы относительно изменения индукционного эффекта.
Сила индукционного –I-эффекта определяется электро-отрицательностью атома и возрастает в соответствии с его положением в Периодической системе элементов
- NR2 -OR -F

рост
–I-эффекта
-Br
-I
Положительно заряженные заместители ,например, -N+R3, (тянут на себя «электронное одеяло»), являются акцепторами электронной плотности, поэтому проявляют отрицательный индукционный эффект (–I-эффект).
Отрицательно заряженные заместители являются донорами электронной плотности, поэтому проявляют положительный индукционный эффект (+I-эффект).
Ненасыщенные углеводородные группы обладают –I-эффектом, возрастающим с увеличением доли s-электронов в гибриде:
СН3–СН2-
СН2=СН-
СН![]() С-
С-
 (+I-эффект)
(+I-эффект)
рост –I-эффекта
Интенсивность (сила) индукционного эффекта быстро уменьшается с расстоянием.
Следует помнить, что при электронных эффектах ни отдачи, ни притяжения электрононов не происходит. Имеет место отличие распределения электронной плотности от того распределения, которое было при отсутствии эффекта.
В таблице 7 приведены группы, разбитые по знаку индукционного эффекта (в порядке уменьшения )
Таблица 7
Индукционные эффекты заместителей
|
+I-эффект |
–I-эффект | ||
|
-O– |
-NR3+ |
-F |
-SH |
|
-COO– |
-SR2+ |
-Cl |
-SR |
|
-CR3 |
-NH3+ |
-Br |
-OH |
|
-CHR2 |
-NO2 |
-I |
С |
|
-CH2R |
-SO2R |
-OAr |
-Ar |
|
-CH3 |
-CN |
-COOR |
-CH=CR2 |
|
-D |
-SO2Ar |
-OR |
|
|
|
-COOH |
-COR |
|
Однако объяснить некоторые результаты только с позиции индукционного эффекта невозможно. Посмотрим, например, на значение Ка некоторых бензойных кислот. Введение в пара-положение атома хлора (4-хлорбензойная кислота) приводит к увеличению константы кислотности с 6.50 ( у бензойной кислоты) до 10.4. Однако при введении более электроотрицательного атома фтора (4-фторбензойная кислота) наблюдается значение Ка равное 7.22 (меньшее, чем у 4-хлорбензойной кислоты). Кроме того, 4-метоксибензойная кислота имеет значение Ка (3,38) меньшее, чем у бензойной кислоты, хотя СН3О-группа проявляет отрицательный индукционный эффект (–I-эффект).
-
Кислота
Ка.105
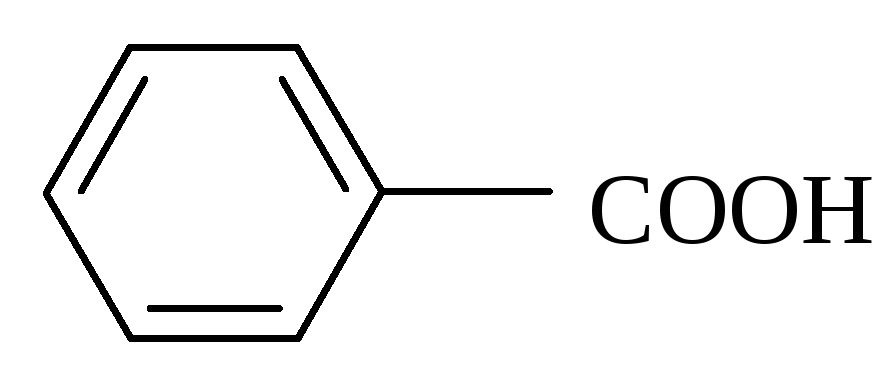
Бензойная
6.50
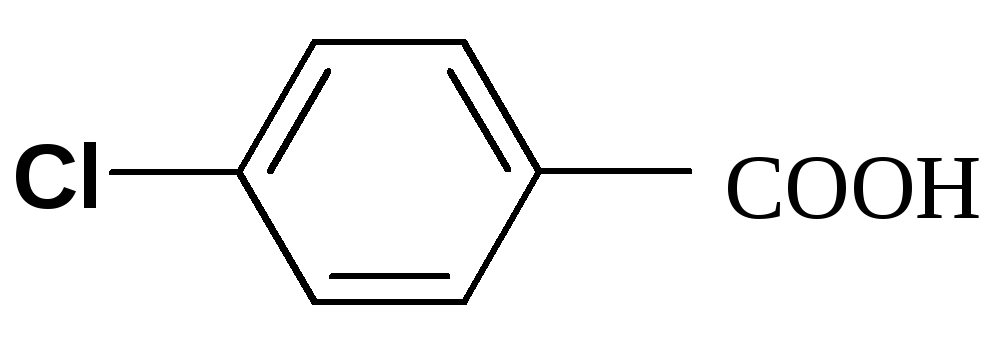
4-хлорбензойная
10.4

4-фторбензойная
7.22
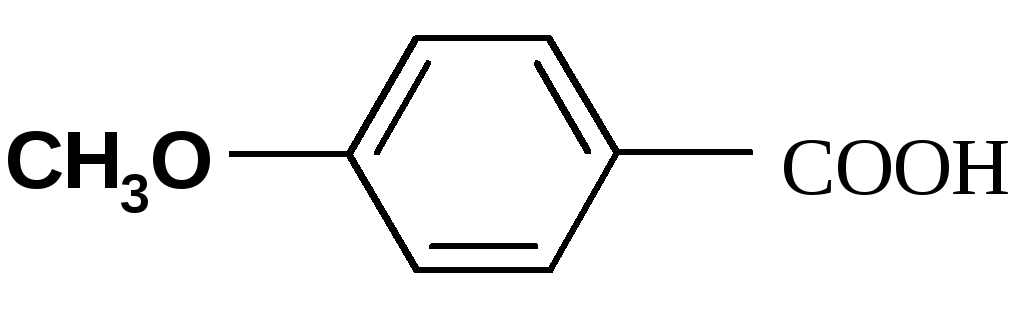
4-метоксибензойная
3.38
Эти данные свидетельствуют о том, объяснять наблюдаемые результаты только при помощи индукционного эффекта невозможно. По-видимому, имеет место еще какой-то эффект. Какой?

 H=C
H=C