
- •5. Проводящие материалы
- •7.Проводящая разводка ис на основе меди.
- •16.Формирование примеси в монокристаллическом кремнии.
- •17.Микродефекты монокристаллического кремния.
- •27. Применение мкр Si
- •28. Получение мкр Si
- •29. Свойства мкр Si
- •30.Применение гетероструктур на основе эпитаксиальных слоев Si-Ge.
- •31.Формирование эритксиальных слоев SiGe.
- •32.Проблемы кремниевой оптоэлектроники.
- •33.Светоизлучающие структуры на основе Si легированного эрбием.
- •34.Методы получения кремния легированного эрбием.
- •35. Люминисценция в системе Si-эрбий
- •41. Свойства SiC
- •42. Получение SiC
- •43. Применение Проводников a3b5.
- •44. Свойства п/п типа a3b5.
- •45. Свойства и получение монокристаллов GaAs.
- •46. Свойства GaN
- •47. Получение GaN
- •48. Применение полупроводников типа a2b6
- •50. Применение термоэлектрических Материалов
- •51 Термоэлектрические материалы
- •52. Cовременные Тенденции в области термоэлектричества.
- •53 Классификация диэлектрических материалов
- •54 Стекла.
- •55. Строение стекол.
- •57 Функции пассивных диэлектриков в микроэлектронике.
- •59. Свойства Керамических материалов.
- •60.Технология керамических материалов.
- •63. Ксерогель и аэроргель
- •69.Применение проводящих полимерных пленок в микроэлектронике.
№1. Типы химической связи, Особенности материалов электрон. техники
Природу и основные свойства материала определяет тип химической связи между частицами. Химической связью называется совокупность сил, удерживающих атомы в веществе. Она может возникать как между отдельными атомами, так и между сложными химическими .частицами - молекулами, ионами, радикалами и т.п. При сближении атомов между ними начинается взаимодействие, характер которого существенно зависит от структуры их электронных оболочек, причем решающую роль играют электроны внешнего слоя - валентные электроны. Химическую связь образуют два электрона с противоположными спинами, при этом за счет перекрывания электронных оболочек взаимодействующих атомов происходит перераспределение электронной плотности. Участие в химических процессах электронов следующего слоя значительно слабее, а электроны, расположенные на внутренних оболочках, практически не оказывают влияния на химические свойства атомов. Силы, действующие между атомами, являются силами электрического взаимодействия, в котором основную роль играют именно валентные электроны.
Известны четыре типа химической связи - ионная, ковалентная, металлическая и молекулярная, Или связь Ван-дер-Ваальса, что и объясняет огромное разнообразие свойств веществ.
Особенности материалов микроэлектроники
Электрофизические свойства являются одними из основных свойств материалов, определяющих их применение в микроэлектронике. В этой связи наиболее распространена классификация материалов, по их способности проводить электрический ток. В соответствии с данной классификацией материалы делятся на проводники, полупроводники и диэлектрики.
Проводники имеют удельное электросопротивление от 10-6 до 10-3 Ом*см, а их валентная зона и зона проводимости перекрываются,
полупроводники имеют удельное электросопротивление от 10-2 до 109 Ом*см и ширину запрещенной зоны от 0,1 до 3,0 эВ;
диэлектрики имеют удельное электросопротивление более 10* Ом-см и ширину запрещенной зоны более 3,0 эВ
По структурным особенностям материалы микроэлектроники делятся на кристаллические и аморфные, при этом кристаллические материалы могут быть как монокристаллическими, так и поликристаллическими.
Монокристаллические материалы, такие как кремний и арсенид галлия, являются базовыми материалами электроники.
Другая особенность состоит а использовании материалов как в объемном, так и в пленочном виде. При этом свойства материалов в пленочном исполнении могут существенно отличаться от свойств объемных материалов.
В микроэлектронике применяются вещества высокой чистоты, так как малейшее изменение количества примесей может привести к резкому изменению свойств полупроводников. Микроэлектроника является не материалоемкой отраслью техники, в отличие, например, от машиностроения, но для ее целей используются драгоценные металлы, дефицитные и очень дорогостоящие материалы, к которым относятся элементарные полупроводники и полупроводниковые соединения.
№2. Ковалентная связь. При этой связи у веществ объединение атомов в молекулу достигается за счет электронов, которые становятся общими для пар атомов. Каждая пара атомов в молекуле удерживается при помощи одной или нескольких пар, образующихся за счет .двух электронов, которые до образования связи принадлежали разным атомам. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Поскольку при образовании перекрывающиеся электронные облака определенным образом направлены в пространстве, возникающая химическая связь будет иметь направленный характер.
Возможен и другой механизм образования ковалентной связи - за счет неподеленных электронных пар одного атома (донора) и свободных орбиталей другого (акцептора). Такая связь называется донорно-акцепторной и отличается от обычной ковалентной связи только происхождением электронной пары (пример - СаАS).
Ковалентная связь типична для твердых неорганических кристаллов с п/п(и) свойствами: алмаза, кремния, германия, карбида кремния и других соединений. Данная связь характеризуется высокой прочностью. Например, алмаз и карбид кремния обладают высокой твердостью и высокой температурой плавления.
Для оценки способности атома притягивать к себе общую электронную пару при образовании химической связи пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. При образовании связи возможны три случая:
1) молекула образуется из двух одинаковых атомов. В этом случае электронная плотность поровну распределена между связывающимися атомами. Возникает неполярная ковалентная связь;
2) связь образуется из атомов с различающимися электроотрица- тельностями. Возникает полярная ковалентная связь; 3) связь образуют два атома С резко различающимися электроотри- цательностями. Возникает ионная связь.
№3 Ионная связь. Связь образуют два атома С резко различающимися электроотрицательностями. Возникает ионная связь. Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. При большом различии электроотрицательностей у взаимодействующих атомов образующиеся соединения состоят из ионов, а электроны в ионных соединениях локализованы и принадлежат одному из атомов.
Ионная связь реализуется в ионных кристаллах, к которым относится преобладающая часть неорганических соединений. Такие кристаллы состоят из положительно и отрицательно заряженных ионов. Силы взаимодействия не имеют направленного характера, каждый ион связан одинаковыми силами со всеми своими соседями. Таким образом, внутри ионного кристалла нельзя обнаружить группировки ионов, которые соответствовали бы молекулам.
Деление связей на ковалентные и ионные условно, поскольку не существует резкой границы между этими типами связи. Можно говорить о ковалентной связи с некоторой долей ионности, и наоборот.
№4. Металлическая связь. Специфика металлической связи состоит в том, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким отдельным атомам, а всему кристаллу. При этом обобществленные электроны не локализованы вблизи своих атомов, а свободно перемещаются внутри всей решетки, образуя "электронный газ". Такая связь сферически симметрична и имеет ненаправленный характер. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений. Не имея локализованных связей, металлические кристаллы (в отличие от ионных) не разрушаются при изменении положения атомов, т.е. им свойственна высокая пластичность при деформациях (ковкость). Благодаря наличию свободных электронов металлы обладают высокими электропроводностью и теплопроводностью.
Молекулярная связь, или связь Ван-дер-Ваальса обусловлена взаимодействием электрически нейтральных молекул или атомов. Взаимодействие между молекулами имеет электрическую природу и связано с наличием у них постоянных и мгновенных диполей. Межмолекулярное взаимодействие складывается из сил притяжения (ориентационных, индукционных и дисперсионных) и сил отталкивания. Ориентационные силы действуют между полярными молекулами. Индукционные (поляризационные) сипы существуют между полярной и неполярной молекулами. При этом полярная молекула создает электрическое поле, которое поляризует другую молекулу, индуцируя в ней дипольный момент.
Дисперсионные межмолекулярные силы наблюдаются между неполярными молекулами. Движение электронов в атомах, колебание ядер и связанное с этим непрерывное изменение взаимного положения электронов и ядер вызывает появление мгновенных диполей. Мгновенный диполь создает электрическое поле, поляризующее соседние молекулы, в результате возникает взаимодействие мгновенных диполей. Энергия взаимодействия неполярных молекул есть средний результат взаимодействия таких мгновенных диполей, в частности, дисперсионное взаимодействие обусловливает переход благородных газов при низких температурах в жидкое состояние.
Молекулярная связь объясняет существование жидкостей и молекулярных кристаллов. Однако ее энергия примерно на два порядка ниже энергии ионной и ковалентной связей, что определяет низкую температуру плавления молекулярных кристаллов.
5. Проводящие материалы
Особенности тонкопленочных металлов
Электросопротивление чистых металлов всегда ниже, чем электросопротивление металлов с примесями и сплавов, и повышается с увеличением температуры. Согласно правилу Маттиссена удельное сопротивление металла равно сумме сопротивления, обусловленного рассеянием электронов на тепловых колебаниях узлов кристаллической решетки, и остаточного сопротивления, вызываемого рассеянием электронов на статических дефектах структуры
ρ= ρт +ρост
где рт - удельное сопротивление, обусловленное рассеянием электронов на тепловых колебаниях узлов кристаллической решетки; рост - остаточное сопротивление.
Наиболее существенный вклад в остаточное сопротивление вносит рассеяние на примесях, которые всегда присутствуют в реальном проводнике либо в виде загрязнений, либо в виде легирующего элемента. Помимо примесей некоторый вклад, в остаточное сопротивление вносят собственные дефекты структуры - вакансии, атомы внедрения, дислокации, границы зерен.
В микроэлектронике наиболее часто применяются не объемные проводники, а пленки на их основе. Такие пленки используются в качестве межэлементных соединений с низким сопротивлением, контактных площадок, обкладок конденсаторов, выпрямляющих и омических контактов.
Электрические свойства тонких пленок металлов и сплавов могут значительно отличаться от свойств объемных образцов тех же материалов. Одной из причин такого различия является разнообразие структурных характеристик тонких пленок.
Зависимость удельного сопротивления тонкой проводящей пленки ρплоттолщины dпл
С труктура
тонких пленок на разных стадиях осаждения
существенно изменяется. При приложении
электрического поля происходит переход
электронов через узкие диэлектрические
зазоры между соседними островками за
счет термоэлектронной эмиссии и
туннелирования. При увеличении количества
осажденного металла зазор между
островками уменьшается, проводимость
пленок растет. При образовании сплошной
пленки ее удельное сопротивление
приближается к удельному сопротивлению
объемного материала ρобно остается больше
него из-за большой концентрации
дефектов.
труктура
тонких пленок на разных стадиях осаждения
существенно изменяется. При приложении
электрического поля происходит переход
электронов через узкие диэлектрические
зазоры между соседними островками за
счет термоэлектронной эмиссии и
туннелирования. При увеличении количества
осажденного металла зазор между
островками уменьшается, проводимость
пленок растет. При образовании сплошной
пленки ее удельное сопротивление
приближается к удельному сопротивлению
объемного материала ρобно остается больше
него из-за большой концентрации
дефектов.
Для сравнительной оценки проводящих свойств тонких пленок используют удельное поверхностное сопротивление (или сопротивление на безразмерный квадрат). Удельное поверхностное сопротивление численно равно сопротивлению участка пленки, длина которого равна его ширине
R□=ρ/d где ρ - удельное электросопротивление; d - толщина пленки.
Подбором толщины пленки можно изменить R□ независимо от удельного сопротивления. Кроме того, для определения удельного поверхностного сопротивления не требуется измерения толщины пленки. Так как удельное поверхностное сопротивление не зависит от величины квадрата, сопротивление тонкой пленки рассчитывается по формуле
R= R□lo/do где lо - длина резистора; dо - ширина резистора.
№6. Проводящая разводка ИС на основе Al
В интегральных схемах для формирования электрической разводки наиболее часто используется алюминий. Алюминий имеет малое удельное сопротивление (2,8 мкΩ*см), обладает хорошей адгезией к SiO2, легко напыляется, дает возможность осуществить контакт с алюминиевой и золотой проволокой, имеет низкую стоимость.
Однако при использовании А1 в качестве металлизации возникают следующие проблемы:
1) Al проникает через переход с малой глубиной залегания, что приводит к возникновению утечек тока через переход и проколу перехода;
2) при высоких плотностях тока происходит разрыв элементов алюминиевой разводки в результате электромиграции;
3) в многослойной алюминиевой разводке образуются выступы Al, что ухудшает изоляцию между слоями и может даже привести к их зако-
Проникновение Al вчерез переход развивается след. образом.
После формирования слоя Аl и фотолитографии проводят операцию вжигания при температуре 400 - 500 "С. Такая операция необходима, так как на поверхности Si всегда есть тонкий слой естественного оксида. Алюминий начинает взаимодействовать с оксидом кремния уже при 300 °С и граница контакта смещается в глубь Si. Происходит растворение Si в А1, а после охлаждения - рекристаллизация. Алюминии свою очередь Проникает в подложку, что может привести к проколу перехода. Для устранения этого эффекта используется предварительное введение в Аl добавок Si в пределах 1 -1,5 %.
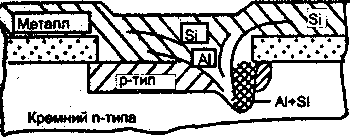
Другой метод устранения эффекта прокола заключается в формировании тонкого подслоя поликристаллического кремния перед нанесением АЦ8») слоя, что задерживает развитие прокола и способствует продлению срока службы контакта. Однако в этом случае повышается контактное сопротивление.
Явление разрыва элементов алюминиевой разводки, возникающее при высоких плотностях тока и повышенной температуре после продолжительной работы, обусловлено эффектом электромиграции. Это один из основных факторов, снижающих надежность интегральных схем. Электромиграция представляет собой массоперенос проводящего материала. Он происходит путем передачи импульса от электронов, движущихся под влиянием электрического поля, положительным ионам металла.
Сопротивление электромиграции проводящих пленок Аl может быть увеличено несколькими способами. Во-первых, прибегают к формированию алюминиевого слоя с большими размерами зерен, например, напылением на нагретую подложку. Во-вторых, легируют алюминий медью до 4%.
Ухудшение изоляции между слоями многослойной алюминиевой разводки, связанное с образованием выступов А1, происходит по следующей причине. Выступы Аl образуются в результате многократных термообработок и охлаждений из-за рассогласования температурных коэффициентов линейного расширения с примыкающими слоями и релаксации напряжений в пленках Аl. В результате образующиеся шипы могут достигать 5 - 7 мкм и прокалывать межслойный диэлектрик. В качестве контрмеры применяются сплавы Аl(Сu) и Аl с увеличенным размером зерен.
