
- •Бийский технологический институт (филиал)
- •Массообменные процессы
- •Предисловие
- •Введение
- •Лабораторная работа 1 «ознакомление с основами расчета массообменных аппаратов на примере ректификации» (4 часа)
- •1.1 Цель работы
- •1.2 Подготовка к лабораторной работе
- •1.3 Теоретические сведения
- •1.3.1 Равновесие массообменных систем
- •1.3.2 Движущая сила массообменных процессов
- •1.3.3 Основное уравнение массопередачи
- •1.3.4 Основы расчета массообменных аппаратов
- •1.4 Оборудование, технические средства и инструменты
- •1.5 Описание установки
- •1.6 Методика проведения работы
- •1.7 Обработка опытных данных
- •1.8 Контрольные вопросы
- •1.9 Тестовые задания
- •Лабораторная работа 2 «исследование процесса
- •2.3.2 Сущность процесса ректификации
- •2.3.3 Непрерывная ректификация
- •2.3.4 Периодическая ректификация
- •2.4 Оборудование, технические средства и инструменты
- •2.5 Описание установки
- •2.6 Методика проведения работы
- •2.7 Обработка опытных данных
- •2.8 Контрольные вопросы
- •2.9 Тестовые задания
- •Лабораторная работа 3 «изучение гидродинамики насадочных колонн» (4 часа)
- •3.1 Цель работы
- •3.2 Подготовка к лабораторной работе
- •3.3 Теоретические сведения
- •3.4 Оборудование, технические средства и инструменты
- •3.5 Схема и описание установки
- •3.6 Методика проведения работы
- •3.6.1 Гидравлические испытания сухой насадки
- •3.6.2 Гидравлические испытания орошаемой насадки
- •3.8 Контрольные вопросы
- •3.9 Тестовые задания
- •Лабораторная работа 4 «исследование процесса конвективной сушки» (4 часа)
- •4.1 Цель работы
- •4.2 Подготовка к лабораторной работе
- •4.3 Теоретические сведения
- •4.3.1 Виды сушки
- •4.3.2 Кинетика сушки
- •4.3.3 Изменение температуры материала в процессе сушки
- •4.3.4 Продолжительность сушки
- •4.3.5 Массоперенос при сушке
- •4.4 Оборудование, технические средства и инструменты
- •4.5 Описание установки
- •7,8,9,12,13,14,15 – Термометры сопротивления; 10 – чашка; 11 – весы; 16 – преобразователь ис-3358; 17 – мост ксм-2-019;
- •4.6 Методика проведения работы
- •4.7 Обработка результатов
- •4.8 Контрольные вопросы
- •13. Назовите методы интенсификации процессов сушки
- •4.9 Тестовые задания
- •Приложение а порядок оформления отчета по лабораторной работе
- •Приложение б основные термины и определения
- •Приложение в инструкция по техникЕ безопасности при выполении лабораторных работ
- •Приложение г справочный материал
- •Приложение д графики тарировки
- •Литература
- •Содержание
1.3 Теоретические сведения
1.3.1 Равновесие массообменных систем
Замкнутая система может быть равновесной, если в ней не происходит никаких качественных и количественных изменений. Необходимым условием фазового равновесия является постоянство температуры и давления во всех фазах этой системы, так как при непостоянной температуре, равновесие нарушается из-за теплообмена, а при непостоянном давлении, равновесие нарушается из-за массообмена между фазами. Знание равновесия в процессах массопередачи позволяет установить пределы, до которых могут протекать эти процессы.
Количественную характеристику системы определяют экспериментальным путем и заносят в справочники. По справочным данным строят диаграммы равновесия, необходимые для анализа и расчета массообменных процессов и аппаратов. Вид диаграмм изменяется в зависимости от физико-химических свойств систем. Ниже рассмотрим равновесие в системе «пар – жидкость».
Как правило,
компоненты жидких смесей имеют при
постоянном давлении различные температуры
кипения, а при постоянной температуре
разные давления насыщенных паров.
Очевидно, что при постоянной температуре
большее давление паров имеет компонент
с меньшей температурой кипения,
проявляющий, следовательно, большую
летучесть. Отношение давлений насыщенных
паров двух компонентов при постоянной
температуре характеризует их относительную
летучесть и называется коэффициентом
разделения α. Системы, в которых
относительная летучесть компонентов
остается постоянной, подчиняются закону
Рауля, согласно которому равновесное
давление пара над раствором (ра)
пропорционально его мольной доле в
растворе (ха),
то есть
![]() .
.
Состав бинарной смеси однозначно определяется концентрацией низкокипящего компонента. Таким образом,
![]() ;
;
![]() ;
;![]() .
(1.1)
.
(1.1)
Из выражений 1.1 следует, что при постоянной температуре парциальные давления компонентов в паровой фазе и полное давление последней находятся в линейной зависимости от мольной концентрации низкокипящего компонента в равновесной жидкой фазе.
Кривая равновесия подобных систем представляет собой равностороннюю гиперболу, симметричную относительно диагонали квадрата.
1.3.2 Движущая сила массообменных процессов
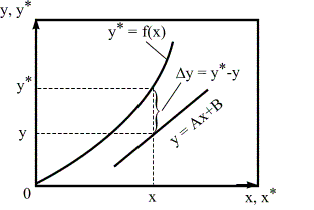
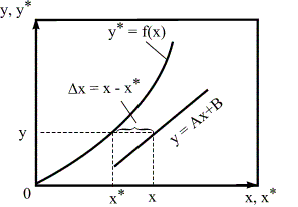
Движущая сила массообменных процессов есть разность между рабочими и равновесными концентрациями. Движущая сила характеризует степень отклонения системы от равновесия (рисунок 1.1). При установлении равновесия между фазами массообмен между ними прекращается.
Рассмотрим случай, когда линия равновесия является прямой, то есть у* = mх и m > 1. Перенос вещества происходит из фазы Фх в фазу Фy (рисунок 1.2). Для каждой точки или сечения аппарата Δу = у*-у, т.е. получается, что движущая сила изменяется с изменением рабочей концентрации. Поэтому для всего процесса (или для всей поверхности массопередачи) должна быть найдена средняя движущая сила.
а б
Рисунок 1.1 – Выражения движущей силы массообменных процессов
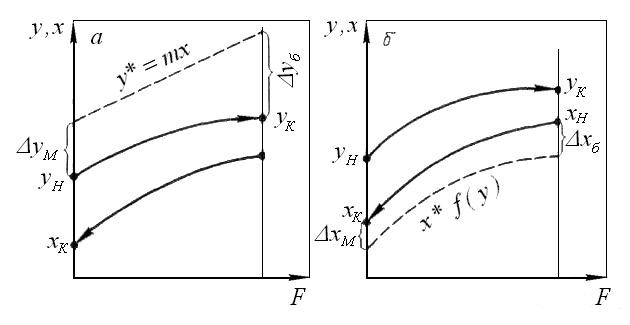
По аналогии с теплопереносом можно написать для массопереноса следующее выражение движущей силы процесса Δyср в концентрациях фазы Фу (рисунок 1.2а):
![]() ,
(1.2)
,
(1.2)
а для фазы Фх (рисунок 1.2б):
![]() ,
(1.3)
,
(1.3)
где Δyб и Δxб – большая, а Δyм и Δxм – меньшая разности концентраций на концах массообменного аппарата.
а б
Рисунок 1.2 – К определению движущей силы процесса
массопереноса в концентрациях фаз Фy (а) и Фх (б)
Если
![]() то тогда средняя
движущая сила определится как:
то тогда средняя
движущая сила определится как:
![]() .
(1.4)
.
(1.4)
Аналогичные выражения будут и для прямоточного движения фаз, участвующих в массообмене.
В случае, если линия равновесия не является прямой (m ≠ const), среднее значение движущей силы процесса определяется по формуле:
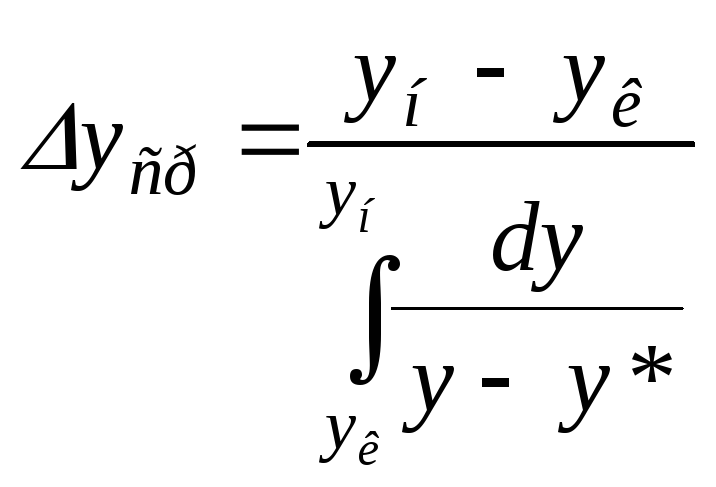 .
(1.5)
.
(1.5)
Средняя движущая сила процесса зависит от:
а) начальных и конечных концентраций компонентов – yн, yк, xн, xк ;
б) взаимного
направления движения фаз:
![]() ;
;
в) структуры потока
в аппарате:
![]() ;
;
г) температуры и давления.
