
- •Министерство транспорта Российской Федерации
- •Подписано в печать . Формат 60х90 1/16.
- •Введение
- •1. Эквивалент. Закон эквивалентов
- •Примеры решения задач
- •2. Строение атомов
- •3. Периодическая система химических элементов
- •4. Химическая связь
- •Примеры решения задач
- •5. Энергетика химических процессов
- •Примеры решения задач
- •6. Химическое сродство Примеры решения типовых задач
- •Поскольку rН0, rS0 и rG0 реакции связаны друг с другом уравнением:
- •7. Скорость химических реакций Примеры решения типовых задач
- •8. Химическое равновесие Примеры решения типовых задач
- •9. Коллигативные свойства растворов Примеры решения типовых задач
- •10. Ионно-молекулярные реакции обмена Примеры решения задач
- •Решение. В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
- •Решение.
- •Решение.
- •12. Окислительно – восстановительные реакции
- •Примеры решения задач
- •Основные типы окислительно-восстановительных реакций (овр)
- •13. Электродные процессы и гальванические элементы
- •Примеры решения задач
- •14. Электролиз Примеры решения задач
- •15. Коррозия металлов Примеры решения задач
- •16. Комплексные соединения Примеры решений типовых задач
- •Взаимодействие металлов со щелочами
- •Взаимодействие металлов с кислотами
- •18. Полимеры
- •Примеры решения задач
- •19. Дисперсные системы Примеры решений задач
- •20. Количественный анализ
- •Примеры решения задач
- •Константы нестойкости ряда комплексных ионов
1. Эквивалент. Закон эквивалентов
Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1/2 иона) или их группы.
Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении fэ(х) = 1/В, где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Молярная масса эквивалента вещества Мэ(х) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Мэ(х) = fэ (х) · Мх (кг/моль, г/моль).
Например, молярные массы эквивалентов простых веществ:
Мэ(Н) = 1 · 1 г/моль;
Мэ(Na) = 1· 23 = 23 г/моль;
Мэ(Mg) = ½ · 24 = 12 г/моль;
Mэ(О) = ½ · 16 = 8 г/моль.
Если одно из реагирующих веществ – газ, то для него вводится понятие объема эквивалента вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.):
Рo = 1 атм.; То = 273 К
1 эквивалент газа массой Мэ занимает объем Vэ при н.у.
отсюда Vэ = 22,4 · Мэ / М (л/моль);
Например, при нормальных условиях 1 моль эквивалентов водорода занимает объем, равный:
Vэ (Н2) = 22,4 · 1 / 2 = 11,2 л/моль.
Для кислорода эта величина составляет
Vэ (О2) = 22,4 · 8 / 32 = 5,6 л/моль.
Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ.
m1 / m2 = Mэ (1) / Мэ (2).
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде
m1 / Мэ(1) = V2 / Vэ (2).
Примеры решения задач
Пример 1. Рассчитайте эквивалентную массу трёхвалентного металла, навеска которого массой 1,44 г при его полном окислении превращается в 2,72 г соответствующего оксида. Какой металл используется в качестве исходного реагента?
Решение. На основании закона эквивалентов составим пропорцию
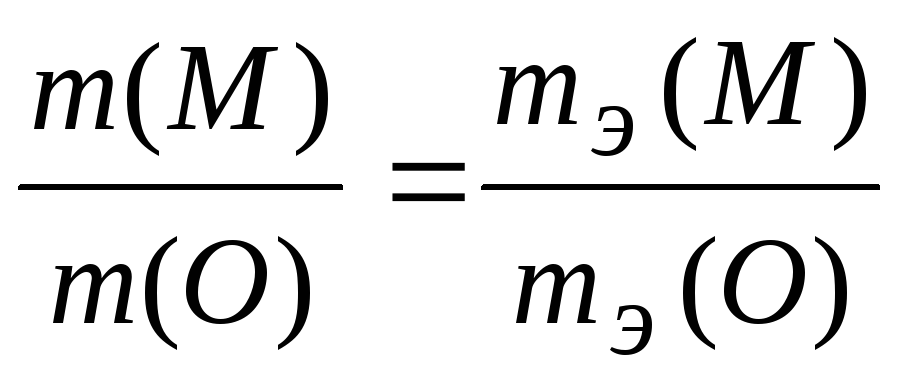 ,
,
где
m
– масса
реагента,
![]() - его молярная эквивалентная масса.
- его молярная эквивалентная масса.
Таким
образом,
![]()
Из условия задачи находим m(O)=m(окс.)-m(M)=2,72 – 1,44 =1,28 (г).
![]() (O)
= 8
(O)
= 8
![]() ,
получим:
,
получим:
![]() .
.
По определению грамм-атомная масса (A) простого вещества равна произведению его молярной эквивалентной массы на валентность (В)
![]() .
.
В итоге, сравнив найденный результат с значениями средних масс в таблице Д.И. Менделеева, приходим к выводу, что в качестве металла был использован алюминий.
Пример 2. Сколько граммов цинка растворилось в соляной кислоте, если известно, что в ходе этой реакции выделилось 1,2 л водорода.
Решение. С учётом объёмных отношений газообразных реагентов из закона эквивалентов следует, что
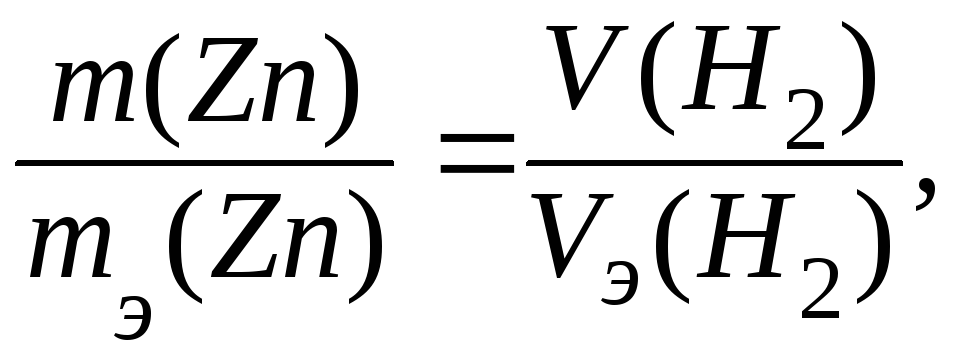
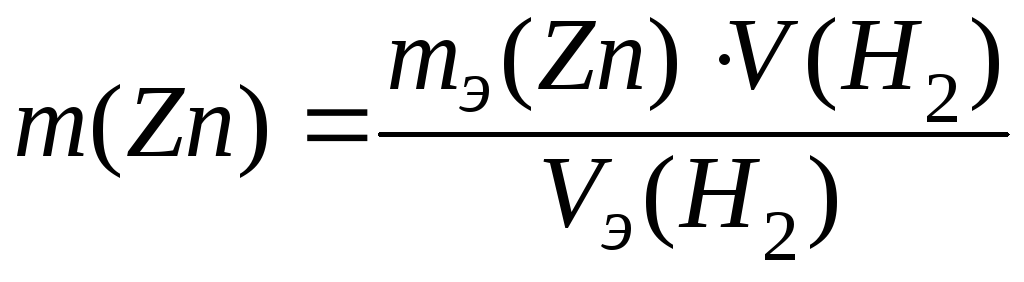 ,
,
где
m
- масса
металла,
![]() - его молярная эквивалентная масса,V
– объём газообразного продукта реакции,
- его молярная эквивалентная масса,V
– объём газообразного продукта реакции,
![]() - его молярный грамм-эквивалентный
объём.
- его молярный грамм-эквивалентный
объём.
Из данных таблицы Менделеева определим, что
![]()
![]() (
(![]() )=11,2
л · моль-1,
получим:
)=11,2
л · моль-1,
получим:
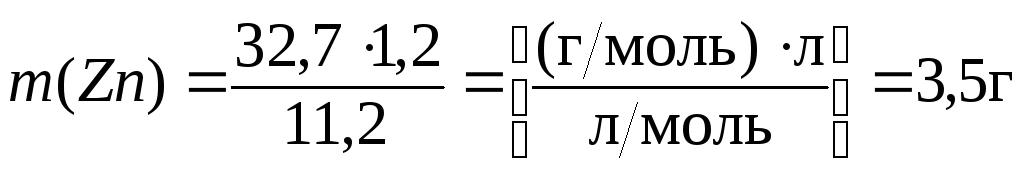 .
.
Пример 3. Вычислите эквиваленты и эквивалентные массы H2SO4 и Al(OH)3 в реакциях, выраженных уравнениями:
H2SO4 + KOH = KHSO4 + H2O (1)
H2SO4 + Mg = MgSO4 + H2 (2)
Al(OH)3 + HCl = Al(OH)2Cl + H2O (3)
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O (4)
Решение. Фактор эквивалентности или эквивалентная масса сложного вещества, как и фактор эквивалентности или эквивалентная масса элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основания) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл или на число вступающих в реакцию гидроксильных групп. Следовательно, молярная эквивалентная масса H2SO4 в
реакции (1) MH2SO4 = 98 г/моль, а в реакции (2) MH2SO4 / 2 = 49 г/моль. Эквивалентная
масса Al (OH)3 (3) MAl(OH)3 = 78 г/моль, а в реакции (4) MAl(OH)3 / 3 = 26 г/моль.
Пример 4. Вычислите абсолютную массу молекулы серной кислоты.
Решение. Моль любого вещества содержит постоянную Авогадро (NА) структурных единиц (в нашем примере молекул). Мольная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы:
98 / 6,02 · 1023 = 1,63 · 10-22 г.
