
- •Министерство транспорта Российской Федерации
- •Подписано в печать . Формат 60х90 1/16.
- •Введение
- •1. Эквивалент. Закон эквивалентов
- •Примеры решения задач
- •2. Строение атомов
- •3. Периодическая система химических элементов
- •4. Химическая связь
- •Примеры решения задач
- •5. Энергетика химических процессов
- •Примеры решения задач
- •6. Химическое сродство Примеры решения типовых задач
- •Поскольку rН0, rS0 и rG0 реакции связаны друг с другом уравнением:
- •7. Скорость химических реакций Примеры решения типовых задач
- •8. Химическое равновесие Примеры решения типовых задач
- •9. Коллигативные свойства растворов Примеры решения типовых задач
- •10. Ионно-молекулярные реакции обмена Примеры решения задач
- •Решение. В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
- •Решение.
- •Решение.
- •12. Окислительно – восстановительные реакции
- •Примеры решения задач
- •Основные типы окислительно-восстановительных реакций (овр)
- •13. Электродные процессы и гальванические элементы
- •Примеры решения задач
- •14. Электролиз Примеры решения задач
- •15. Коррозия металлов Примеры решения задач
- •16. Комплексные соединения Примеры решений типовых задач
- •Взаимодействие металлов со щелочами
- •Взаимодействие металлов с кислотами
- •18. Полимеры
- •Примеры решения задач
- •19. Дисперсные системы Примеры решений задач
- •20. Количественный анализ
- •Примеры решения задач
- •Константы нестойкости ряда комплексных ионов
16. Комплексные соединения Примеры решений типовых задач
Пример
1. Вычислите
заряды комплексных ионов , образованных
платиной (IV):
1) [![]() ];
2) [
];
2) [![]() ];
3) [
];
3) [![]() ].
Назовите эти соединения.
].
Назовите эти соединения.
Решение.
Степень
окисления атома платины (комплексообразователя)
равна +4, заряд молекулы аммиака (лиганда)
равен нулю, а заряд хлорид-аниона (другого
лиганда) равен -1; в итоге в соединении
1) - пентахлорамминплатине (IV)
([![]() ]
]![]() )
- суммарный заряд составляет +4 + (-5) = -1.
)
- суммарный заряд составляет +4 + (-5) = -1.
Аналогичным образом находим заряды других комплексов:
2)
в тетрахлордиамминплатине (IV)
([![]() ])
+4 + (-4) = 0,
])
+4 + (-4) = 0,
3)
в дихлортетраамминплатине (IV)
([![]() ]
]![]() )
+4 + (-2) = +2.
)
+4 + (-2) = +2.
В первом случае внешняя сфера содержит катионы, во втором – соединение является неэлектролитом, а в третьем – внешнюю сферу содержит анионы.
Пример
2. В
результате приливания раствора
![]() к раствору тиосульфата калия
к раствору тиосульфата калия![]() образуется комплексная соль
образуется комплексная соль![]() .
Составьте уравнение реакции и укажите
причину её протекания.
.
Составьте уравнение реакции и укажите
причину её протекания.
Решение: Учтём, что прочность аммиачных комплексов значительно ниже, чем тиосульфатных: это видно из сравнения соответствующих констант нестойкости (см. табл. 3 Приложения). Реакция всегда протекает в направлении образования более прочного комплексного иона. В рассматриваемом случае уравнение реакции в молекулярной форме имеет следующий вид:
![]() ,
,
В полной ионно-молекулярной форме это уравнение записывается так:
![]() .
.
Принимая
во внимание, что ионы
![]() и
и![]() практически не изменяют своей концентрации
в растворе, окончательно имеем:
практически не изменяют своей концентрации
в растворе, окончательно имеем:
![]() .
.
Пример
3. Константа
нестойкости иона
![]() составляет
составляет![]() .
Вычислить концентрацию ионов серебра
в 0,05M
растворе
.
Вычислить концентрацию ионов серебра
в 0,05M
растворе
![]() ,
содержащем, кроме того, 0,01 моль/л
,
содержащем, кроме того, 0,01 моль/л![]() .
.
Решение. Вторичная диссоциация комплексного иона протекает по уравнению:
![]() .
.
В
присутствии избытка ионов
![]() ,
создаваемого в результате диссоциации
,
создаваемого в результате диссоциации![]() (которую
можно считать полной), это равновесие
смещено влево настолько, что количеством
ионов
(которую
можно считать полной), это равновесие
смещено влево настолько, что количеством
ионов![]() ,
образующихся при вторичной диссоциации,
можно пренебречь. Тогда
,
образующихся при вторичной диссоциации,
можно пренебречь. Тогда![]() моль/л.
По той же причине равновесная концентрация
ионов
моль/л.
По той же причине равновесная концентрация
ионов![]() может быть приравнена общей концентрации
комплексной соли (0,05 моль/л).
может быть приравнена общей концентрации
комплексной соли (0,05 моль/л).
По условию задачи:
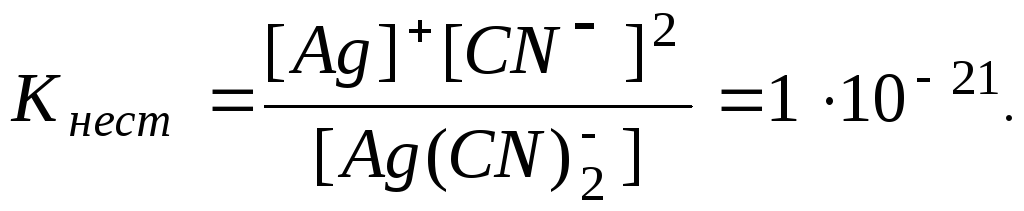
В
итоге определим концентрацию ионов
![]() :
:

Пример
4. Растворы
простых солей кадмия образуют с щелочами
осадок гидроксида кадмия
![]() ,
а с сероводородом – осадок сульфида
кадмияCdS.
Чем объяснить,
что при добавлении щёлочи к 0,05 M
раствору
,
а с сероводородом – осадок сульфида
кадмияCdS.
Чем объяснить,
что при добавлении щёлочи к 0,05 M
раствору
![]() ,
содержащему 0,1 моль/лKCN,
осадок не образуется, тогда как при
пропускании через этот раствор
сероводорода выпадает осадок CdS
? Константу нестойкости иона
,
содержащему 0,1 моль/лKCN,
осадок не образуется, тогда как при
пропускании через этот раствор
сероводорода выпадает осадок CdS
? Константу нестойкости иона
![]() принять
равной
принять
равной![]()
Решение.
Из условий
образования осадков
![]() иCdS
следует:
иCdS
следует:
![]() ,
,
![]() .
.
Учтём,
что в растворе комплексной соли
концентрацию ионов
![]() можно
аппроксимировать уравнением (см. пример
3):
можно
аппроксимировать уравнением (см. пример
3):
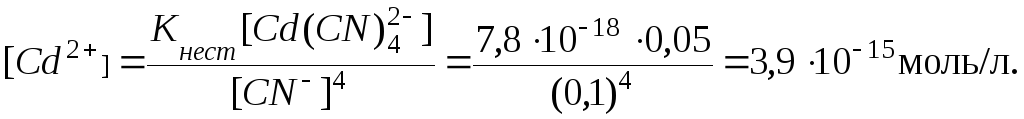
Концентрация
ионов
![]() ,
достаточная для осаждения гидроксида
кадмия, может быть определена из
неравенства:
,
достаточная для осаждения гидроксида
кадмия, может быть определена из
неравенства:
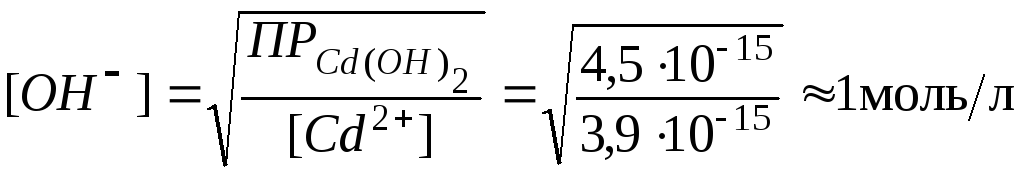 .
.
Следовательно,
в рассматриваемой системе при концентрациях
ионов
![]() меньших, чем 1
меньших, чем 1![]() ,
равновесие
,
равновесие![]() смещено в сторону образования комплексного
иона.
смещено в сторону образования комплексного
иона.
Условие образования осадка сульфида кадмия из заданного раствора тетрацианокадмата калия отражает неравенство:
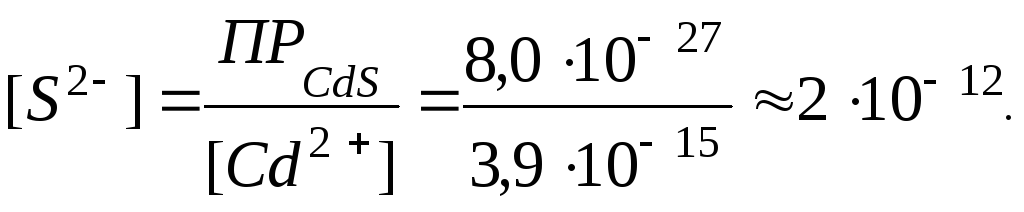
Таким
образом, даже при малых концентрациях
сульфид-иона равновесие
![]() практически полностью смещено в сторону
образования сульфида кадмия.
практически полностью смещено в сторону
образования сульфида кадмия.
17. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Физические свойства металлов. В обычных условиях все металлы, кроме ртути, - твердые вещества, резко отличающиеся по степени твердости. Металлы, являясь проводниками первого рода, обладают высокой электропроводностью и теплопроводностью. Эти свойства связаны со строением кристаллической решетки, в узлах которой находятся ионы металлов, между которыми перемещаются свободные электроны. Перенос электричества и тепла происходит за счет движения этих электронов.
Химические свойства металлов. Все металлы являются восстановителями, т.е. при химических реакциях они теряют электроны и превращаются в положительно заряженные ионы.
Взаимодействие металлов с кислородом. Большинство металлов, реагируя с кислородом, образуют оксиды, которые в большинстве случаев покрывают плотным слоем поверхность металлов.
Mgo + O20 = 2Mg+2O-2
M g
- 2ē = Mg2+
2
g
- 2ē = Mg2+
2
O2 + 4ē = 2O2-
Оксиды металлов
Различают 4 типа оксидов:
Основные оксиды (способны образовывать соли при взаимодействии с кислотами).
Амфотерные оксиды (образуют соли при взаимодействии с кислотами и щелочами).
Кислотные оксиды (образуют соли при взаимодействии с основаниями).
Несолеобразующие оксиды.
Гидроксиды металлов
Гидроксиды щелочных и щелочноземельных металлов образуются при взаимодействии соответствующих металлов с водой, они хорошо растворимы в воде и называются щелочами:
2K0+2H2O = 2KOH+H20
K 0
- ē = K+ 2
0
- ē = K+ 2
2H+ + 2ē =H20 1
Гидроксиды остальных металлов не растворимы в воде и образуются при взаимодействии соли металла со щелочью:
MnSO4 + 2NaOH = Mn(OH)2 + Na2SO4
Гидроксиды металлов бывают:
Основные (Fe(OH)2,Mg(OH)2,Cu(OH)2и др.)
Амфотерные (Zn(OH)2,Al(OH)3,Cr(OH)3и др.)
Основные гидроксиды взаимодействуют только с кислотами с образованием соли и воды:
Mn(OH)2 + H2SO4 = MnSO4 + 2H2O
Mn(OH)2 + 2H+ = Mn2+ + 2H2O
Амфотерные гидроксиды взаимодействуют как с кислотами, так и со щелочами:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Cr(OH)3 + KOH = K[Cr(OH)4]
Cr(OH)3 + OH- = [Cr(OH)4]-
