
- •Принятые в книге сокращения
- •ВВЕДЕНИЕ
- •Глава 1. Из истории развития биохимии
- •Формирование и развитие современных направлений в биохимии
- •Развитие биохимии
- •Обмен веществ - основной признак живой материи
- •Материал для биохимических исследований
- •Уровни изучения обмена веществ
- •Классификация биохимических методов
- •Статистическая обработка результатов биохимических исследований
- •Химические элементы
- •Группы веществ
- •Биологические структуры
- •Общая характеристика углеводов
- •Обмен углеводов
- •Общая характеристика липидов
- •Обмен липидов
- •Общая характеристика нуклеиновых кислот
- •Обмен нуклеиновых кислот
- •Общая характеристика белков
- •Обмен белков
- •Значение и распределение воды в организме животного
- •Обмен воды
- •Общая характеристика минеральных веществ
- •Обмен минеральных веществ
- •Общие сведения
- •Витамин А
- •Витамин D
- •Витамин К
- •Витамин F
- •Убихинон
- •Витамин В2
- •Витамин B5
- •Витамин В6
- •Витамин Вc
- •Витамин B12

274 :: 275 :: 276 :: 277 :: Содержание
Витамин B12
Витамин B12 (цианкобаламин) назвали антианемическим, так как он предохраняет организм от злокачественной анемии. Болезнь возникает из-за отсутствия в организме двух факторов - внешнего и внутреннего. Внешний фактор представлен витамином B12 и содержится в кормах, внутренний - мукопротеидом желудочного сока.
Гипо- и авитаминозы. Гипо- и авитаминозы встречаются чаще всего у свиней, собак и птицы. При этом задерживается рост, уменьшаются привес, продуктивность, возникают понос, рвота, восприимчивость к заболеваниям, высокая эмбриональная смертность, парез и паралич конечностей. В кровеносной системе появляются незрелые и большие эритроциты, в желудке атрофируется слизистая оболочка, поражается нервная система. Причина этих явлений - недостаток или отсутствие в кромах витамина, Со, желудочнокишечные заболевания, при которых нарушаются ассимиляция кормового витамина, его всасывание и биосинтез микробами.
274
Химическое строение и свойства. Молекула витамина B12 включает две части - хромофорную и нуклеотидную. Хромофорная часть состоит из четырех частично восстановленных пиррольных ядер, которые соединены между собой обычной связью (ядро D) и координационной (ядра A, В и С) - с кобальтом, Нуклеотидная часть витамина состоит из 5,6-диметилбензимидазола, остатка рибозы и фосфорной кислоты. Она связана ковалентно с хромофорной частью (через ядро D) и координационно - с атомом кобальта. Ядра пиррола содержат восемь метальных групп, три остатка пропионовой кислоты и три остатка уксусной кислоты. Карбоксильные группы амидированы. Атом кобальта связан с группой CN(R). Молекулярная масса витамина B12 равна 1356. Элементарный состав витамина B12 - С63Н90N14РСо. Структурная формула имеет следующий вид:
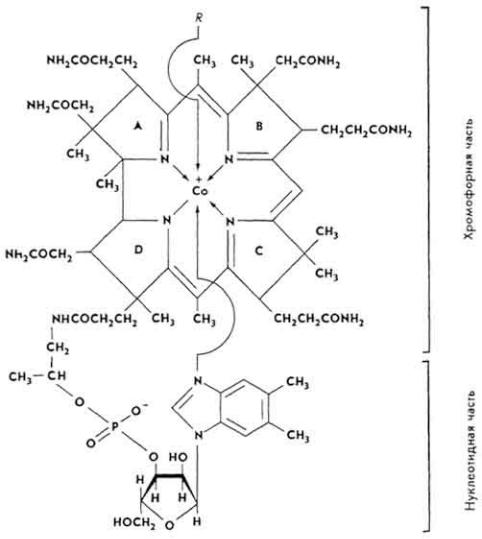
275
Хромофорная часть фактически является порфирином и напоминает гемин или хлорофилл. Различают несколько кобаламинов, которые отличаются между собой по остатку (R), связанному с кобальтом: циан- (собственно витамин B12), окси-, нитрит- и хлоркобаламины. Все они обладают витаминной активностью. Витамин B12 - кристаллическое вещество рубиново-красного цвета, хорошо растворяется в воде, этаноле, не растворяется в бензоле, хлороформе и эфире, без запаха и вкуса, разрушается под действием солнечного света и высоких температур, окислителей и восстановителей.
Природные источники и потребность животных. При наличии кобальта в рационе животных витамин синтезируется микробами (особенно пропионовокислыми бактериями и актиномицетами), обитающими в преджелудках жвачных и кишках. Много витамина содержат ил, стоячие и сточные воды.
Для поросят-сосунов средняя суточная потребность в витамине составляет 20 мкг/кг сухого корма, для телят-сосунов - 10-40, для взрослых свиней - 11, для месячных цыплят - 20, для кур - 2 мкг/кг.
Обмен в организме. Витамин всасывается в нижней части тощей и верхней

части подвздошной кишок. Перед этим он соединяется с внутренним фактором, образуя комплекс. Вследствие активного переноса этот комплекс поступает в эндоплазму эпителиальных клеток кишок. В дальнейшем он расщепляется на витамины B12 и внутренний фактор. Первый поступает в кровеносную систему ворсинки, второй возвращается в просвет кишок, где взаимодействует с новыми порциями витамина. В кровеносной системе витамин связывается транскобаламином I (относится к β-глобулинам) и транскобаламином II (имеет β-глобулиновую природу). В таком виде он транспортируется вначале в печень (часть его там депонируется), а затем в другие органы и ткани, где используется для биосинтеза многих ферментов как кофермент. В организме витамин мало изменяется, его избыток выделяется с мочой и калом.
Значение для обмена веществ. Витамин B12 влияет на биосинтез нуклеиновых кислот, белков, превращения углеводов, способствует накоплению жира, восстановлению SH-групп KoA, активирует каротиназу и
276
обеспечивает образование в организме витамина А из каротинов, стимулирует нормальный эритропоэз и образование макроэргов, способствует ресинтезу метионина, образованию адреналина и норадреналина, креатина и других соединений. Метилкобаламин участвует в биосинтезе метионина, уксусной кислоты и метана. 5'-Дезоксиаденозильное производное витамина служит коферментом ферментов, с помощью которых происходит превращение глутаминовой кислоты в аспарагиновую, и ферментов, катализирующих образование дезоксицитидин-5-дифосфата из цитидин-5-трифосфата и др.
Применение. Используют для повышения продуктивности животных и при лечении многих болезней. В частности, кормовой кобаламин в дозе 60 мкг на 1 кг кукурузного или ячменного рациона повышает привес цыплят на 7%. Применяют при лечении анемий, гепатитов, хирургических заболеваний, болезней нервной системы, в онкологической практике и т. д.
277
274 :: 275 :: 276 :: 277 :: Содержание

277 :: 278 :: Содержание
Витамин H
Витамин H (биотип) известен с конца прошлого века как фактор роста бактерий и дрожжей.
Гипо- и авитаминозы. При недостатке или отсутствии витамина возникают гипо- и авитаминозы, особенно у цыплят и индюшат, могут возникать у свиней и пушных зверей при кормлении их яичным белком. В состав яичного белка входит белок авидин, который инактивирует биотин. У животных уменьшается аппетит, падает масса, возникает общая слабость, появляются гиперемия кожи л чешуйчатый дерматит, сальные железы начинают обильно функционировать и появляется себорея (витамин иногда называют антисеборейным), вокруг глаз формируются отечные ободки ("очки"), отекают конечности, выпадает шерсть (у птицы - перья), а спина становится кенгурообразной. У птицы наблюдаются высокая эмбриональная смертность и деформация костей.
Химическое строение и свойства. Молекулу витамина следует рассматривать как производное тиофена, к которому присоединен остаток мочевины и валериановой кислоты.
277
Биотин - кристаллическое бесцветное вещество с температурой плавления 232-233 °C, хорошо растворяется в воде, хуже - в этаноле, устойчив к действию солнечных лучей, щелочей, кислот, нагреванию. Химически активен.
Природные источники и потребность животных. Биотином богаты пивные дрожжи (1000-1600 мкг/кг), арахисовый и соевый шроты, зерно ячменя, овса и кукурузы. Средняя суточная потребность у цыплят составляет 100 мкг/кг корма, индюшат - 250, кур - 150, поросят массой до 20 кг - 77 мкг/кг.
Обмен в организме. Кормовой биотин в основном находится в связанном с белками состоянии. Связанный биотин гидролизуется ферментом биотинидазой до биотина и белка. Всасывание кормового и синтезируемого микрофлорой биотина происходит в тонкой кишке. В крови биотин связывается с альбуминами и поступает в различные органы и ткани. Депонируется в тканях печени, почек и надпочечников. Избыток выводится из организма с мочой и частично с калом. Количество выделенного биотина в 3-6 раз превышает количество принятого с кормами и водой.

Значение для обмена веществ. Биотин является составной частью многих ферментов, участвующих в биосинтезе белков (например, сывороточного альбумина и амилазы), карбоксилировании и декарбоксилировании жирных кислот, образовании многих видов липидов и пуринов, превращениях пирувата в оксалоацетат, пропионата - в 2-метилмалонил-КоА (реакция особо важная для жвачных), в синтезе мочевины и др. Наиболее детально изучено участие биотина в биосинтезе высших жирных кислот.
Антивитамины. Основными антагонистами биотина являются белок авидин куриного белка и несколько структурных аналогов.
Применение. Препараты биотина применяются, при лечении дерматитов, экзем, некоторых видов анемий.
278
277 :: 278 :: Содержание
279 :: 280 :: 281 :: Содержание
Витамин С
Открытие витамина С (аскорбиновой кислоты) связано с выяснением природы цинги - заболевания, вызванного отсутствием в рационе свежих овощей и фруктов. Было установлено, что свежие овощи содержат водорастворимый фактор, предупреждающий развитие цинги. Этот фактор получил название витамина С. Теперь витамин получают синтетически из D-глюкозы.
Гипо- и авитаминозы. При авитаминозе животные заболевают цингой. Она проявляется в кровоточивости десен, слизистых оболочек и мышц. У телят наблюдаются явления некроза, быстрая утомляемость, анемия, учащение пульса и дыхания, замедляются рост и развитие, падают привесы. У поросят-сосунов возникает анемия, замедляется рост, появляются кровоизлияния в коже и слизистых оболочках, гиперкератоз, конъюнктивиты, иногда некроз хвоста, выпадает щетина. У взрослых свиней возникают геморрагии и пятнистая краснота на слизистой оболочке рта, особенно десен, некротический стоматит, опухают суставы, наступает резкое истощение и смерть. У пушных зверей возникают подкожные кровоизлияния, стоматиты, анемия, отеки лапок и хвоста (кончик хвоста иногда отпадает), парезы и параличи, приводящие к гибели. У лисят мех становится ватообразным, серовато-белым и мягким.
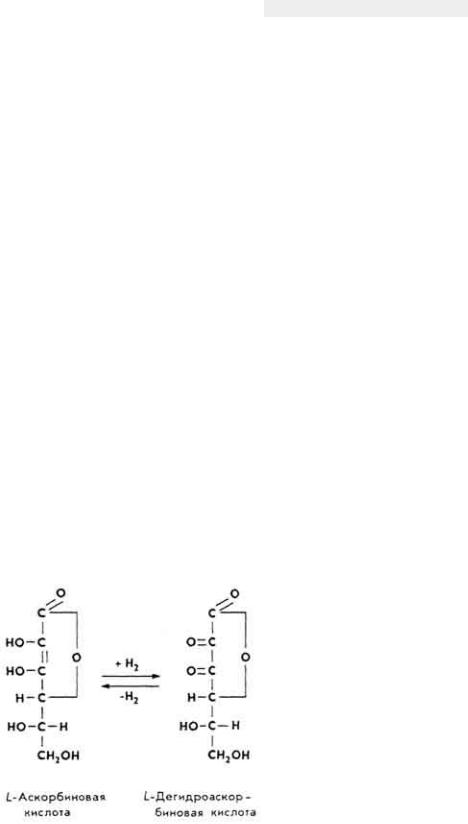
Химическое строение и свойства. Витамин С - производное L - гулоновой кислоты (2,3-эндиол-L-гулоно-1,4-лактон). Способен к окислительновосстановительным превращениям.
279
Витамин С - белое кристаллическое вещество с кислым вкусом, хорошо растворяется в воде, хуже - в этаноле, не растворяется в жирах и диэтиловом эфире, оптически активен, температура плавления 190-192°C. Витамин С имеет сильные восстановительные свойства. При нагревании быстро разлагается.
Природные источники и потребность животных. Главными источниками служат зеленые корма, овощи и фрукты. В плодах шиповника
содержится 2000-4500 мг витамина на 100 г, в черной смородине - 300, красном перце - 100-400, хвое ели и сосны (зимой) - 220-275, капусте - 30-70 мг. Суточная потребность в витамине С у телят в первые две недели жизни составляет 250 мг в сутки. При раннем отъеме поросят в их рацион следует добавлять витамина 100-200 мг/кг корма. Курам рекомендуется давать летом 4060 мг/кг корма, зимой - 100, петухам и индюкам - 100-200 мг/кг.
Обмен в организме. Витамин всасывается в основном в тонкой кишке. С током крови он поступает в печень, а затем в другие органы и ткани. Больше всего его содержится в тканях надпочечников. Усвоение нарушается при желудочно-кишечных заболеваниях, а биосинтез в организме уменьшается при болезнях надпочечников, гепатитах, нефритах. Аскорбиновая кислота поступает во многие клетки в виде дегидроаскорбиновой кислоты. В клетках (например, в эритроцитах) она быстро восстанавливается. Основная масса витамина связана в комплексе Гольджи и митохондриях преимущественно с белками. При окислении аскорбиновая кислота превращается в дегидроаскорбиновую, последняя - в дикетогулоновую кислоту, а при ее распаде образуется щавелевая кислота. Часть дикетогулоновой кислоты декарбоксилируется, что приводит к образованию ксилозы, которая используется для биосинтеза других пентоз (рибозы и дезоксирибозы) или глюкозы. Некоторое количество аскорбиновой кислоты выводится из организма с мочой.
Значение для обмена веществ. Витамин участвует во многих реакциях обмена. Он является донатором и акцептором протонов и электронов. Процесс протекает с участием ферментов или ионов металлов, хинонов, гомохромогенов.
Витамин С участвует в восстановлении
280
дисульфидных связей в молекулах белка и прежде всего ферментов. Является составной частью активного центра фермента, ускоряющего гидролиз отдельных тиогликозидов. При недостатке или отсутствии в кормах витамина С нарушается переход преколлагена в коллаген, что приводит к кровотечениям. Нарушается биосинтез коллагена и гиалуроновой кислоты в костной ткани. Возникают типичные цинготные изменения скелета. Замедляется регенерация всех тканей, так как задерживается превращение пролина в оксипролин. Задерживается биосинтез гормонов надпочечников, дентина, парных соединений, процессов свертывания крови, тормозится деятельность многих ферментов.
Антивитамины. Антагонистом витамина С является его структурный аналог - глюкоаскорбиновая кислота.

Применение. Препарат витамина С и корма, богатые им, применяют для повышения сопротивляемости организма к заболеваниям, при лечении цинги, геморрагических диатезов, анемий, для устранения интоксикаций различного происхождения и др.
281
279 :: 280 :: 281 :: Содержание
281 :: 282 :: 283 :: Содержание
Витамин P
Витамин P (биофлавоноиды) - группа веществ, укрепляющих стенки капилляров. К ним относятся соединения, которые обусловливают окраску растений, -флавононы. Витамин открыл А. Сент-Дьёрдьи как фактор устойчивости капилляров.
Гипо- и авитаминозы. При недостатке или отсутствии витамина в кормах у животных появляются кровоизлияния в коже, мышцах, суставах и внутренних органах в виде точек или петехий.
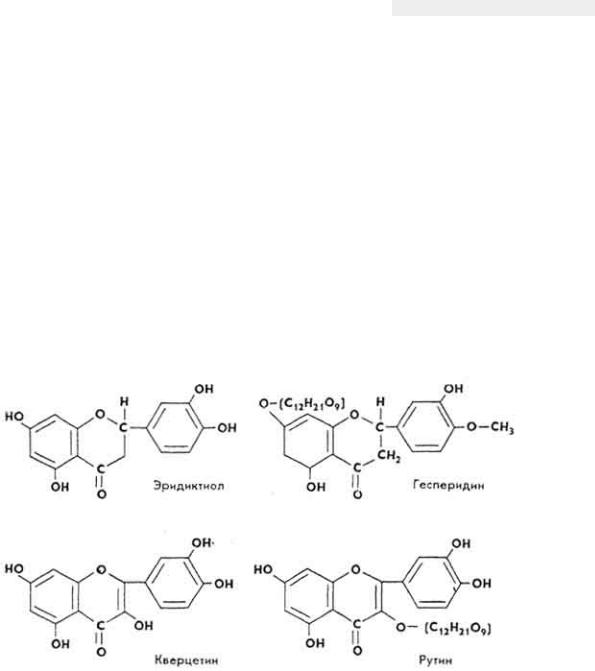
Химическое строение и свойства. Витамин P объединяет группу веществ - эридиктиол, гесперидин, кверцетин и рутин.
281
Эридиктиол представляет собой бесцветное кристаллическое вещество, кристаллы имеют форму листочков, хорошо растворяется в воде и этаноле, имеет температуру плавления 267 °C.
Гесперидин - желтое кристаллическое вещество, кристаллы имеют вид листочков, гигроскопичны, слабо растворяется в воде, лучше - в этаноле, имеет температуру плавления 224-226 0C.
Кверцетин - лимонно-желтое кристаллическое вещество, кристаллы иглоподобные, слабо растворяется в горячей воде и этаноле, имеет температуру плавления 316-317°C.
Рутин - светло-желтое кристаллическое вещество, кристаллы иглоподобные, плохо растворяется в воде, лучше - в этаноле, имеет температуру плавления 180-190 °C.

Природные источники и потребность животных. Витамином богаты плоды цитрусовых, особенно их кожура (до 0,5%). Высоким содержанием рутина отличаются листья гречихи. Много витамина P содержит кожица черной смородины (до 0,5%) и шиповника (0,24-0,68%).
Обмен в организме. Витамин поступает в организм с кормами. Расщепление и всасывание кормового витамина в основном происходит в тонкой кишке. После поступления в кровеносное русло витамин используется органами, тканями и клетками для различных процессов обмена веществ. В тканях биофлавоноиды после
282
выполнения своей роли расщепляются на составные части. Флороглюциновое ядро почти полностью окисляется до CO2 и H2О. Некоторое количество витамина выделяется с мочой. Меченый кверцетин есть в химусе толстой кишки и кале.
Значение для обмена веществ. Витамин участвует во многих окислительно-восстановительных реакциях. Одни авторы считают, что витамин действует на сосудистую систему через железы внутренней секреции, другие - через ферментные системы и клеточное дыхание. Витамин предохраняет адреналин от окисления, а адреналин стимулирует деятельность гипофиза по биосинтезу АКТГ, который влияет на биосинтез кортикостероидов, а они усиливают прочность капилляров. Витамин является ингибитором гиалуронидазы, что позволяет тканям сохранять нужное количество гиалуроновой кислоты, особенно в капиллярной стенке. При недостатке в тканях витамина повышается активность фермента, что и приводит к разрывам капилляров. Существует биохимическая корреляция действия витаминов P и С.
Применение. Препараты витамина применяют как средство профилактики и лечения кровотечений. Используют при лечении полиартритов и ревматизма, лучевой болезни и хирургических заболеваний. Корове, например, рекомендуется давать 0,4-0,6 г, овце - 0,05-0,1, свинье - 0,1 0,15 г в сутки витамина P.
283
281 :: 282 :: 283 :: Содержание
283 :: 284 :: Содержание
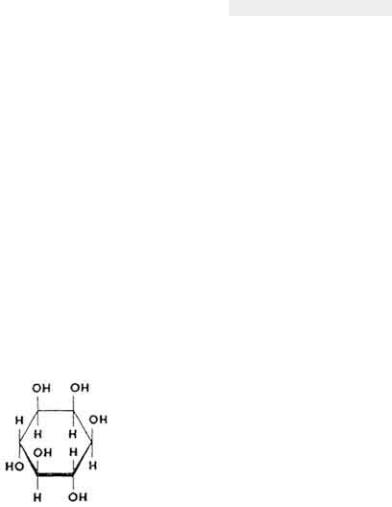
Витаминоподобные вещества
Ионозит
Инозит (мезоинозит) широка распространен в животном и растительном мире. Необходим человеку и многим животным.
Гипо- и авитаминозы. У животных при недостатке или отсутствии витамина приостанавливается рост, возникают дерматиты, наступает облысение, прекращается рост шерсти, у птицы - перьев.
Химическое строение и свойства. Витаминной активностью обладает мезоинозит (1,2,3,4,5,6-циклогексанол).
283
Инозит - кристаллическое вещество, сладкое на вкус, растворяется в воде и не растворяется в органических растворителях, температура плавления гидрата
218°C, ангидроида - 225-227 °C.
Природные источники и потребность животных. Больше всего инозита содержится в зародышах пшеницы (700-900 мг на 100 г), апельсинах, зеленом горошке, животные продукты - телятина, курятина, рыба, яйцо, молоко - содержат мало инозита (11-50 мг на 100 г).
Обмен в организме. Организм животных получает экзо- и эндогенный инозит. В продуктах животного происхождения он находится в связанной форме, в растительных кормах - в виде фитина. Всасывается в основном в тонкой кишке. С током крови поступает в органы ткани. В крови содержится 0,0003-0,0007% инозита. Инозитом богаты миокарод и мозг. Часть инозита находится в составе липидов (инозитфосфатиды). При обмене инозит превращается в глкюкуроновую кислоту с последующими ее изменениями или выделяется с мочой.
Значение для обмена веществ. Инозит является необходимой частью клеточных мембран. Он обладает липотропным действием, предотвращая ожирение печени. Снижает возбудимость центральной нервной системы, повышает перистальтику кишечника, поддерживает на постоянном уровне осмотическое давление в сперматозоидах, ускоряет β-окисление жирных кислот,

активирует амилазы, способствует превращению урацила в тимин, влияет на процессы роста шерсти и др.
Антивитамины. Антагонистом инозита является гексахлорциклогексан.
Применение. Препараты инозита применяют при лечении гепатитов, нервных болезней, жировой инфильтрации печени, для стимуляции кроветворения.
284
283 :: 284 :: Содержание
285 :: 286 :: Содержание
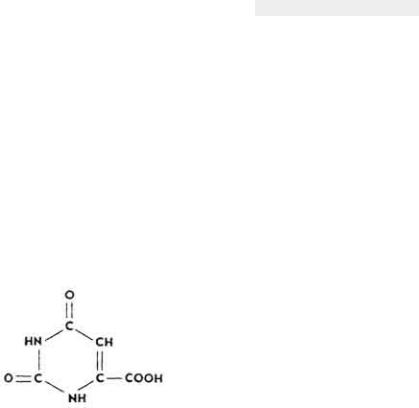
Витамин В13
Витамин B13 (оротовая кислота) был выделен из молозива. Позже его отнесли к витаминам, необходимым для животных и микробов.
Гипо- и авитаминозы. При недостатке или отсутствии витамина замедляются и прекращаются рост и развитие животных и микробов.
Химическое строение и свойства. Витамин B13 является производным пиримидина.
Это - бесцветное кристаллическое вещество, растворяется в горячей воде и щелочах, имеет температуру плавления 345-346 °C (с разложением), со щелочами образует соли.
Природные источники и потребность животных. Витамином богаты дрожжи (2,670 мкг/г), печень, коровье и овечье молоко.
Обмен в организме. В организм витамин Bu поступает вместе с кормами и синтезируется микрофлорой. Всасывание его происходит в тонкой кишке. Используется тканями для синтеза пиримидиновых нуклеотидов и др. Избыток витамина и продукты его превращения выделяются с мочой, калом, потом, выдыхаемым воздухом.
Значение для обмена веществ. У птиц и млекопитающих оротовая кислота синтезируется из аспарагиновой кислоты и карбамилфосфата, являясь источником пиримидиновых оснований:
Аспарагиновая кислота + Карбамилфосфат → Уреидоянтарная кислота → Дигидрооротовая кислота → Оротовая кислота → Оротидин-5-фосфат → Уридин-5-моно-, ди- и трифосфат → Цитидин
Оротовая кислота идет на синтез пиримидиновых нуклеотидов, они - нуклеиновых кислот. Способствует
285
образованию жира из глюкозы, синтезу лактозы, служит активитатором ксантинооксидазы, участвует в обмене одноуглеродных соединений. При недостатке витамина Bu восстанавливает активность глюкозо-6-фосфатазы и

бетаин-гомоцистеин-метилтрансферазы, витамина B3 и KoA в печени.
Примечание. Препараты оротовой кислоты используются для стимуляции эритропоэза после кровопотерь, при лечении заболеваний печени, миокарда, почек и др.
286
285 :: 286 :: Содержание

286 :: 287 :: Содержание
Витамин B15
Витамин B15(пангамовая кислота) первоначально был открыт в тканях печени. Позже его выявили во многих продуктах растительного и животного происхождения и назвали пангамовой кислотой.
Гипо- и авитаминозы. При недостатке или отсутствии в кормах витамина наступает кислородное голодание тканей и жировое перерождение печени.
Химическое строение и свойства. Пангамовая кислота является сложным э ф и р о м D-глюконовой и алкилированной аминоуксусной кислот-N, N- диметилглицил-6-глюконовая кислота.
Витамин B15 - белые, с желтоватым оттенком кристаллы, имеют характерный запах, гигроскопичны, хорошо растворимы в воде и не растворяются в органических растворителях.
Природные источники и потребность животных. Витамином богаты дрожжи, рис, ткань печени, кровь.
Обмен в организме. Вопросы обмена витамина в достаточной мере не изучены.
286
Рис. 34. Нарушение процессов роста у
поросенка (справа) при отсутствии в кормах холина (по Б. Л. Кудряшову)
Значение для обмена веществ. Пангамовая кислота участвует в процессах клеточного дыхания, активирует перенос кислорода, служит источником и переносчиком метальных групп, повышает активность пируватдегидрогеназы и СДГ, способствует образованию АТФ и креатинфосфата, оказывает влияние на функции надпочечников и активирует гексокиназную систему, улучшает

течение процессов биосинтеза белков, нуклеиновых кислот, гликогена.
Применение. Препараты витамина применяют при лечении хронических гепатитов, цирроза печени, эмфиземы легких, коронаросклероза, пневмосклероза, дерматитов.
287
286 :: 287 :: Содержание

287 :: 288 :: 289 :: Содержание
Холин
Холин (от греч. chole - желчь) выделен из желчи и из желтка куриного яйца как витаминоподобное вещество, предупреждающее ожирение печени.
Гипо- и авитаминозы. Недостаток или отсутствие в кормах холина приводит к жировому перерождению печени и отложению жира в клетках различных тканей, особенно почек. Развиваются парезы и параличи, падает уровень продуктивности (рис. 34), уменьшается синтез протромбина, у птицы развивается перозис, деформируются кости, особенно плюсны, снижается яйценоскость.
Недостаток холина в кормах приводит к возникновению жировой инфильтрации печени и почек. Внесение в корма холина устраняет эти явления.
Химическое строение и свойства. Холин представляет собой гидроокись триметил-β-оксиэтиламмония.
287
Холин - сиропообразная жидкость, хорошо растворяется в воде, обладает основными свойствами - образует соли с кислотами. В качестве кормовой добавки применяют холинхлорид.
Природные источники и потребность животных. Высоким содержанием холина отличаются рыбная мука (3,6 г/кг), семена бобовых, кормовые дрожжи, зерно овса. Суточная потребность в холине для свиней составляет 500-800 мг/кг корма, поросят - 1250, цыплят - 1300, бройлеров - 1200-1500 мг/кг.
Обмен в организме. Экзогенный холин поступает в пищевой канал в свободном и связанном состоянии. Связанный холин в организме подвергается обычным превращениям. Часть холина в организме синтезируется.
Основой молекулы может быть серин. Донаторами метальных групп являются метионин, фолиевая кислота и витамин B12. B большинстве случаев биосинтез не удовлетворяет потребностей телят, свиней и птицы. Избыток холина выводится из организма с мочой, калом, потом.
Значение для обмена веществ. Холин служит основой для биосинтеза мембранных липидов, лецитинов и медиатора нервного возбуждения - ацетилхолина. Холин является донатором метальных групп при биосинтезе

адреналина, креатина и метионина. Холинлипотропный фактор, участвует в обмене жиров между печенью и жировой тканью. Из жира и холина в печени образуются лецитины, при их наличии обеспечивается постоянный отток жировых веществ из печени в общее кровеносное русло и предотвращается чрезмерное отложение жира.
Антивитамины. Основным антагонистом холина является триэтилхолин. Он, соединяясь с ацетил-КоА, образует псевдомедиатор - ацетилтриэтилхолин.
Применение. Рекомендуется свиноматкам давать в виде холинхлорида добавку 0,7 г/кг корма,
288
поросятам -1250 мг/кг, откормочным свиньям - 500-800, птице - 800-1300 мг/кг корма.
289
287 :: 288 :: 289 :: Содержание

289 :: 290 :: Содержание
Витамин BE
Витамин BE (карнитин) обнаружен в мышечном экстракте как вещество, проявляющее витаминные свойства.
Гипо- и авитаминозы. Витамин необходим для развития многих насекомых, особенно для личинок печеночного червя. При отсутствии витамина насекомые и их личинки гибнут.
Химическое строение и свойства. |
Карнитин |
- β-окси-γ- |
триметиламиномасляная кислота |
|
|
Карнитин - бесцветное кристаллическое вещество, растворяется в воде и этаноле, температура плавления 195-197°C (с разложением), обладает основными свойствами, химически активен.
Природные источники и потребность животных. Карнитином богаты мышечная ткань (20-50%), дрожжи, ткани печени.
Обмен в организме.
кислоты: Под влиянием декарбоксилируется, затем обмена не изучены.
Карнитин образуется в тканях из глутаминовой определенных ферментных систем эта кислота метилируется и, наконец, гидроксилируется. Детали
Значение для обмена веществ. Карнитин участвует в липидном обмене, выполняя функции переносчика остатков жирных кислот через мембраны митохондрий. Карнитин (К) под влиянием одного из двух специфических ферментов взаимодействует с соответствующим ацил-КоА, образуя ацил-К. В таком виде ацилы поступают внутрь митохондрий, после чего К возвращается в гиалоплазму, а они подвергаются различным превращениям, и в первую очередь окислению с образованием химической энергии.
289
Участвуя в транспортировании жирных кислот через мембраны митохондрий в гиалоплазму, карнитин способствует синтезу жирных кислот. Скорость этой реакции зависит от содержания в клетке цитрата-активатора ацил-КоА: карнитин-ацилтрансферазы. Карнитин служит донатором метальных групп при биосинтезе холина.
Применение. Препараты карнитина используются при лечении болезней

печени и др.
290
289 :: 290 :: Содержание
290 :: 291 :: Содержание
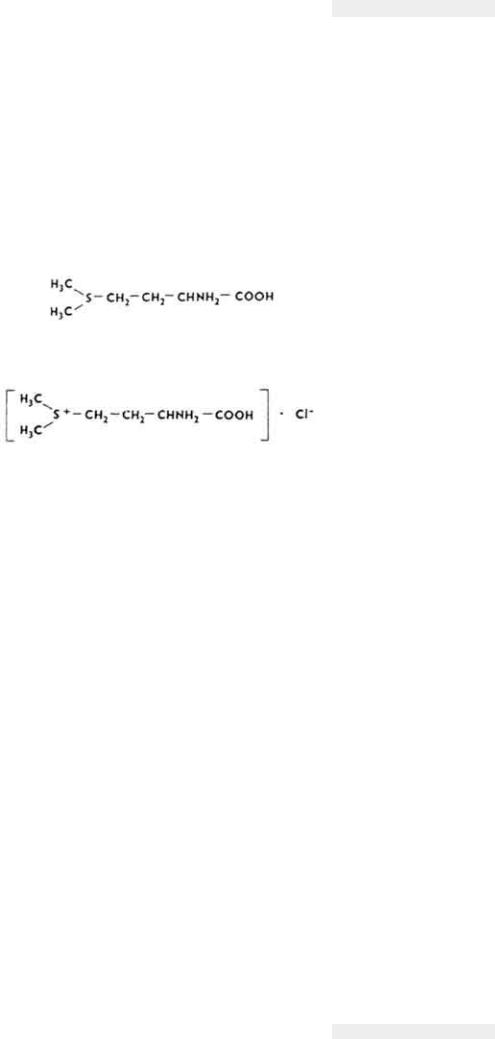
Витамин U
Витамин U (S-метилметионинсульфонийхлорид) открыт как дополнительный фактор питания, предохраняющий организм от язвенной болезни желудка и двенадцатиперстной кишки.
Гипо- и авитаминозы. При гипо- и авитаминозах у животных развивается язвенная болезнь.
Химическое строение и свойства. Витамин U - производное метионина.
В клинике применяют его соль - S-метилметионин-сульфонийхлорид.
Это - твердое вещество белого цвета, сладковато-солоноватое на вкус, с запахом капусты, растворяется в воде, оптически активно.
Природные источники и потребность животных. Больше всего витамина содержится в побегах спаржи (0,1%), листьях капусты и томатах. Им богаты репа, лук, морковь.
Обмен в организме. Витамин всасывается в тонкой кишке. Попадает с током крови в печень, частично используется ее тканями, а затем разносится по организму и включается в реакции обмена веществ. Избыток витамина выделяется с мочой, потом с калом.
290
Значение для обмена веществ. Витамин является донатором метальных групп для биосинтеза холина и креатина, метилирует гистамин, превращая его в неактивный метилгистамин (в этом заключается болеутоляющее действие витамина). Витамин задерживает отложение холестерина на стенках кровеносных сосудов и способствует удалению его избытка из организма, оказывает положительное действие на регенерацию эпителия слизистой оболочки желудка и двенадцатиперстной кишки, пораженных язвой.
Применение. Препарат витамина и корма, богатые им, применяют для лечения язвенной болезни, гастритов и др.
291
290 :: 291 :: Содержание
291 :: 292 :: Содержание
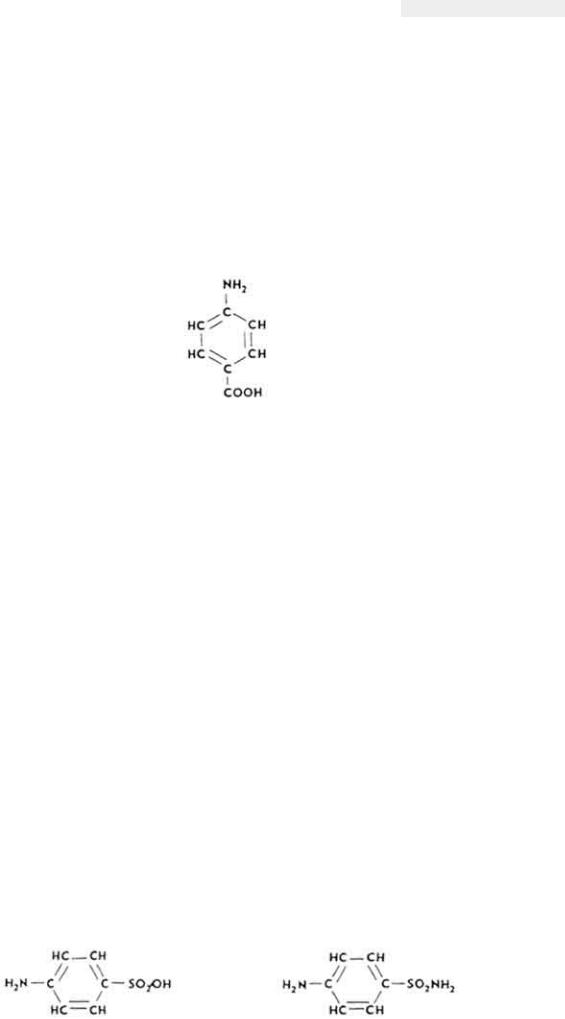
n-Аминобензойная кислота (ПАБК)
n-Аминобензойная кислота проявляет витаминные свойства для некоторых микроорганизмов.
Гипо- и авитаминозы. При отсутствии ПАБК в питательной среде микробы, нуждающиеся в ней, гибнут. У млекопитающих замедляется рост и наступает депигментация шерстного покрова.
Химическое строение и свойства. ПАБК является производным бензола.
По физическим свойствам ПАБК - белое или слегка желтоватое кристаллическое вещество без запаха, плохо растворяется в воде (1:170), хорошо - в этаноле, амфолит.
Природные источники и потребность животных. Содержится в растительных и животных тканях, микробах. Богаты им дрожжи (0,0004%), зародыши пшеницы, картофель.
Обмен в организме. ПАБК кормов всасывается в основном в тонкой кишке. Здесь же часть ее используется микрофлорой для синтеза фолиевой кислоты.
291
С током крови она попадает в печень, затем в другие органы и ткани. Избыток ПАБК выводится с мочой.
Значение для обмена веществ. Действие ПАБК на реакции обмена веществ многогранно. Прежде всего, она входит в состав фолиевой и фолиновой кислот, следовательно, участвует в биосинтезе ДНК и РНК, влияет на обмен биогенных аминов, на превращение тирозина в меланин.
Антивитамины. Конкурентами ПАБК являются n-аминосульфоновая кислота и сульфаниламид (белый стрептоцид).

Они вытесняют ПАБК из молекул ферментов, что приводит к угнетению реакции обмена и гибели соответствующих микроорганизмов.
Применение. ПАБК используется при лечении атеросклероза, для восстановления пигментации волос, для повышения тонуса организма.
Контрольные вопросы
1.Что такое витамины, авитаминозы, гиповитаминозы и гипервитаминозы? Что является источником витаминов?
2.Дайте краткую характеристику, расскажите о химическом строении и значении в обмене веществ всех жирорастворимых (А, D, E, К, F), водорастворимых (B1, В2, В3, PP, B6, Вс, B12, H, С, P) и витаминоподобных
веществ (инозита, витаминов B13, b15, BE, U, холина, ПАБК).
3. Какие мероприятия необходимы для профилактики известных вам гиповитаминозов и авитаминозов у животных?
292
291 :: 292 :: Содержание

292 :: 293 :: 294 :: Содержание
ГЛАВА 9
ФЕРМЕНТЫ
Краткая история учения о ферментах
Ферменты (энзимы) - это биологические катализаторы белковой природы, которые образуются в живых клетках и обладают способностью ускорять химические процессы в организме. И. П. Павлов назвал ферменты истинными двигателями всех жизненных процессов.
292
История биохимии в значительной степени является историей изучения ферментов. Развитие учения о ферментах можно условно разбить на несколько этапов. Первый этап охватывает период до XVII в. и характеризуется использованием ферментов в практической деятельности человека (выпечка хлеба, приготовление вин, сыров, выделка кож и др.).
Второй этап включает период с XVII в. до середины XIX в. и связан с именем Я. Б. ван Гельмонта, изучавшего брожение сахаристых веществ. Он и ввел в науку термин "ферменты" (от лат. fermentum - закваска). В 1814 г. русский ученый К. Кирхгоф в солоде открыл амилазу, под влиянием которой крахмал превращается в мальтозу. В 1836 г. T. Шванн в желудочном соке выявил пепсин. В 1862 г. А. Я. Данилевский из сока поджелудочной железы выделил амилазу, липазу и трипсин. Им и его ученикам установлена обратимость течения ферментативных реакций.
Третий этап начинается со второй половины XIX в. и продолжается до 30-х годов XX в. Во второй половине XIX в. ферменты стали интересовать технологов и клиницистов. Возник спор между Л. Пастером и Ю. Либихом в отношении природы ферментов. Л. Пастер все ферменты разделил на "организованные" и "неорганизованные". К первым он отнес ферменты, которые действуют на субстраты при наличии живых клеток (например, ферменты дрожжей, вызывающие спиртовое брожение). Ко вторым были отнесены ферменты, которые проявляли свое действие вне клеток, образовавших их (например, пепсин в полости желудка). Ю. Либих считал, что все ферменты могут проявлять свое каталитическое действие как вместе с клетками, так и вне их. Спор был решен русским врачом M. M. Ma-нассеиной в 1871 г. Она получила дрожжевой сок, который сбраживает углеводы так же, как и дрожжевые клетки. Опыты были подтверждены Э. Бухнером.
К концу XIX в. возникла необходимость в систематизации их названий. Э. Дюкло предложил при наименовании ферментов к корню слова, обозначающего субстрат, прибавлять суффикс-аза (например, субстрат сахароза - фермент сахараза). Г. Бертран в 1897 г. установил в молекулах многих ферментов

вещество, способное к диализу, кофермент, или коэнзим. С. Серенсен в 1909 г. пришел к выводу, что
293
активность любого фермента зависит от рН среды. В это время Э. Фишер создает первые представления о механизме действия ферментов и субстратов ("ключ к замку"). А. Броун в 1902 г. приходит к выводу, что во время катализа возникает фермент-субстратный комплекс. Л. Михаэлис и M. Ментен в 1913 г. создают основы современной кинетики ферментативного катализа. P. Вильштеттер устанавливает одно- и двухкомпонентные ферменты. В первом случае молекула фермента состоит только из белка, во втором - из белкового носителя - апофермента и небелковой группы - кофермента. Апоферменты и кофермент вместе составляют холофермент, или активный фермент. Дж. Самнер в 1926 г. выделяет первый фермент в кристаллическом виде - уреазу. Его работы успешно продолжает Д. X. Нортроп. С этого времени начинается четвертый этап в развитии ферментологии.
В эти годы изучаются структура молекул коферментов и их соединения с белковыми носителями, О. Варбург и его ученики изучают структуру молекул дыхательных ферментов, НАД и ФАД. В. А. Энгельгардт и M. H. Любимова в 1939 г. устанавливают, что многие структурные белки (например, миозин) могут выполнять ферментативные функции. Установлено участие в ферментативных реакциях в качестве коферментов многих витаминов. В 1955 г. С. Очоа с сотр. осуществил синтез РНК под влиянием фермента полинуклеотидфосфорилазы. В 1958 г. А. Корнберг выделил полимеразу, под влиянием которой синтезируется ДНК. В 1976 г. X. Г. Корана синтезирует ген из 196 нуклеотидов.
По образному выражению В. Л. Кретовича (1974), все эти открытия в области ферментологии приподняли завесу над самыми сокровенными тайнами живой материи и раскрывают блестящие перспективы для дальнейшего развития науки и применения ее достижений в практике.
294
292 :: 293 :: 294 :: Содержание
294 :: 295 :: 296 :: Содержание
Биосинтез и клеточная локализация ферментов
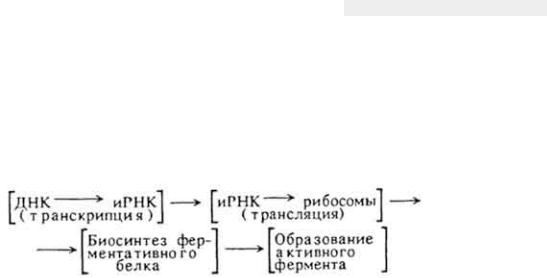
Биосинтез молекулы фермента происходит в каждой клетке, ткани, органе и состоит из тех же этапов, что и биосинтез обычного белка:
294
Первые два этапа представляют собой типичные матричные процессы, рассмотренные раньше. Третий этап - это типичный синтез белковой молекулы. На четвертом этапе формируется молекула активного фермента. Если фермент является сложным белком, то происходит соединение апофермента с коферментом. Молекула фермента приобретает типичную структуру (вторичную, третичную и четвертичную), энергетически выгодную для осуществления каталитических функций. Некоторые ферменты вначале пребывают в неактивном состоянии и только после воздействия активаторов становятся активными (например, пепсин).
Биосинтез ферментов в организме протекает непрерывно. Наиболее интенсивно образуются ферменты в период роста и развития животного. Отдельные органы синтезируют значительные количества ферментов. К ним следует отнести железы (слюнные, желудочные, кишечные, поджелудочную), ферменты которых участвуют в гидролитическом расщеплении кормовых веществ. Нарушение качественного и количественного состава ферментов приводит к патологии, так как для каждого органа, ткани и клетки характерен свой "набор" ферментов.
Для ферментов характерна определенная клеточная локализация. Так, в ядре в основном сосредоточены ферменты, участвующие в обмене нуклеиновых кислот (5'-нуклеотидаза, аденозиндезаминаза, НАД-пирофосфорилаза, оротидин-5'-фосфатпирофосфорилаза, глюкозо-1-фосфату ридилилтрансфераза и др.). В ядерной мембране содержатся ферменты, которые участвуют в транспортировании отдельных соединений и энергии (ацетилэстераза, АТФ-аза, цитохромоксидаза, глутаматдегидрогеназа, НАД · Н2-цитохром-с-редуктаза и др.). Ферменты клеточного дыхания размещены преимущественно в митохондриях (пируватдегидрогеназа, глутаматдегидрогеназа, ферменты окисления жирных кислот и др.). Лизосомы содержат ферменты, катализирующие в основном расщепление многих веществ (катепсин с, пептидгидролазы, эстеразы, сульфатазы,
295

кислые ДНК- и РНК-азы, гиалуронатлиазу и др.). Ферменты биосинтеза белка преимущественно концентрируются в рибосомах (аминоацил-тРНК-синтетазы, пептидсинтетазы и др.). В гиалоплазме выявляются ферменты различной функциональной направленности: гликолиза, синтеза жирных кислот, активации аминокислот и т. д.
296
294 :: 295 :: 296 :: Содержание

296 :: 297 :: Содержание
Методы выделения и очистки ферментов
Материалом для получения различных ферментов служат органы и ткани животных и растений, пищеварительные соки, клеточная масса микроорганизмов. Подбирая материал, следует учитывать вид животного. В частности, содержание β-глюкозидазы в тканях шести видов животных может резко отличаться. Пищеварительные ферменты от животных получают по фистульному методу И. П. Павлова. Часто для получения ферментов используют бактериальные массы. Так, при индуцированном синтезе содержание кислой фосфатазы в массе кишечной палочки можно увеличить до 6% и больше.
Молекулы ферментов обычно связаны со структурными белками, липидами и углеводами. Часть молекул ферментов находится в биологических жидкостях в свободном состоянии. Чтобы выделить ферменты, следует разрушить клетки, перевести ферменты в растворы и затем извлечь их из растворов специальными приемами.
Материал, предназначенный для получения ферментов, освобождают от примесей (органы - от соединительнотканной капсулы, жира, крови и др.). Свежий материал хранят при низких температурах (минус 20°C). Материал измельчают в гомогенизаторах, ультразвуком, с помощью автолиза, лизиса, растирания в ступке с песком и т. д. Иногда клеточные мембраны разрушают, обрабатывая материал ацетоном. Для получения ферментов из субклеточных структур материал гомогенизируют и дробно центрифугируют. К отдельным фракциям добавляют детергенты, например "твины". Под их влиянием разрушаются мембраны и ферменты переходят в раствор. Для получения экстрактов в качестве растворителей используют
296
дистиллированную воду, буферные растворы, физиологический раствор, смесь глицерина и дистиллированной воды, органические растворители.
Очистка ферментов обычно представляет собой чередование различных методов фракционирования. Ферменты проверяют на чистоту - определяют константу седиментации, электрофоретическую подвижность при нескольких значениях рН, чистоту ферментного препарата по кривой растворимости, исследуют иммунологические свойства препарата с помощью антисыворотки, а также электрофоретические и хроматографические свойства фермента после воздействия трипсина и других протеолитических ферментов.
297
296 :: 297 :: Содержание

297 :: 298 :: 299 :: 300 :: 301 :: 302 :: 303 :: Содержание
Общие свойства ферментов
Белковая природа ферментов. Все ферменты являются простыми или сложными белками. Например, к простым белкам относятся ферменты трипсин, уреаза и многие другие, к сложным - каталаза, ферменты,
Рис. 35. Кристаллы фермента
фосфоэнолпируваткиназы (препарат П. Д. Дворниковой)
297
катализирующие окислительно-восстановительные процессы, и др. Все ферменты хорошо растворяются в воде, в разбавленных растворах кислот, щелочей, солей и некоторых органических растворителях. Водные растворы проявляют типичные признаки лиофильных коллоидных систем. Для ферментов характерна высокая молекулярная масса: от десятков тысяч до нескольких миллионов. Свыше 500 ферментов получено в кристаллическом виде (рис. 35). Все они, амфотерны и обладают высокой химической активностью.
Термолабильность и температурный оптимум действия ферментов.
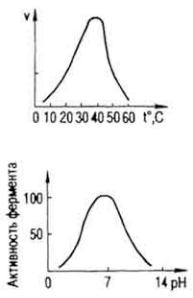
Ферменты - термолабильные соединения. При действии высоких температур они денатурируют, что приводит к прекращению каталитических функций. Температурный оптимум действия большинства ферментов находится в пределах температуры тела -37-40 °C. Исключением являются папаин, наибольшая активность каталитического действия которого проявляется при 80 °C, и каталаза, температурный оптимум действия которой лежит между 0 и 10 °C. При повышении температуры среды на 10 °C скорость реакции возрастает в 1,5-3 раза (правило Ле Шателье) примерно в пределах от 0 до 25 °C, затем медленно повышается и после 40 °C начинает уменьшаться (рис. 36). При температуре 80-100 °C ферменты теряют каталитическую способность, так как наступает денатурация белковой молекулы. Ферменты в растворенном состоянии более чувствительны к нагреванию, чем в сухом. Известны ферменты,
которые могут кратковременно переносить температуру 100 °C (аденилаткиназа).
С понижением температуры скорость ферментативных реакций постепенно уменьшается, достигая минимума при 0 °C. Некоторые ферменты в сухом состоянии выдерживают охлаждение до минус 120-190°C. При постепенном повышении температуры до 37 °C их активность восстанавливается. Это свойство используется при хранении спермы для искусственного осеменения животных.
Влияние реакции среды на активность ферментов. Каждый фермент проявляет максимальное для него каталитическое действие при определенном значении рН, которое называется рН-оптимумом. Так, для пепсина рН-оптимум разен 1,5-2,5; для катепсина 4,5-5,0;
298
Рис. 36. Зависимость скорости реакции, катализируемой ферментом, от температуры среды
Рис. 37. Зависимость активности фермента от рН среды
для карбоксилазы - 4,8; для уреазы - 7,2-8,0; для трипсина - 7,8-9,5 и т.д. Большинство ферментов организма животного проявляет максимальную каталитическую активность при рН ≈ 7 (рис. 37). Изменения рН замедляют или прекращают действие ферментов.
Влияние рН на активность ферментов объясняется структурой их молекул. Молекула фермента имеет один или несколько активных центров, в которых сконцентрированы функциональные группы белков. Степень их ионизации зависит от рН среды. Более того, рН среды влияет на степень ионизации субстратов, фермент-субстратного комплекса и продуктов реакции, структуру молекулы фермента. Все это вместе и определяет каталитическую способность фермента в той или иной реакции. Примером может быть фермент РНК-аза, расщепляющий молекулу РНК на мононуклеотиды. Молекула РНК-азы, особенно ее активный центр, содержит высокий процент лизина. Аминогруппа, размещенная в ε-положении, обычно свободна и определяет активность фермента. Ее ионизация возможна в кислой среде, поэтому и оптимальное
значение рН для РНК-азы будет равно 5,4-5,6. В щелочной среде фермент неактивен, так как ионизация аминогруппы в этих условиях невозможна.
Специфичность действия ферментов. Каждый фермент действует на определенный субстрат или группу веществ, сходных по своему строению. Специфичность действия ферментов объясняется совпадением пространственных конфигураций активного центра фермента и субстрата, их химическим сродством, что приводит к образованию фермент-субстратного комплекса и осуществлению каталитического процесса. Без
299
специфичности ферментов была бы невозможна упорядоченная цепь реакций обмена веществ.
Различают групповую (абсолютную и относительную) и индивидуальную (абсолютную и стереохимическую) специфичность ферментов. Примером абсолютной групповой специфичности может быть действие пепсина на белки различного происхождения. Относительную групповую специфичность проявляют щелочная и кислая фосфатазы, катализирующие гидролиз моноэфиров ортофосфорной кислоты. Абсолютной специфичностью обладает уреаза, расщепляющая мочевину на аммиак и углекислый газ. Примером стереохимической специфичности может быть фумаратгидратаза. Она катализирует присоединение воды к фумаровой кислоте, но не оказывает влияния на цис-изомер - малеиновую кислоту. Встречается двойственная специфичность, например ксантиноксидаза, которая специфически окисляет пуриновые основания и неспецифически -альдегиды.
Активаторы и ингибиторы ферментов. На активность ферментов оказывают влияние многие вещества: одни из них повышают активность ферментов, иные - угнетают. Первые вещества называют активаторами, вторые - ингибиторами, или парализаторами. Нередко одни и те же вещества для одних ферментов могут быть активаторами, для других - ингибиторами. Так, соляная кислота является активатором для пепсина и ингибитором для амилазы слюны. Активность фермента уменьшается по мере увеличения концентрации продуктов, образующихся в результате химических реакций, катализируемых данным ферментом.
Различают специфические и неспецифические активаторы и ингибиторы.
Примером специфического активатора для пепсина может быть соляная кислота, для трипсина - энтеропептидаза. Под их влиянием от молекулы предшественника (пепсиногена и трипсиногена) отщепляется пептид (см. рис. 21 и 23), открывается активный центр и формируется молекула фермента. Отщепившиеся пептиды можно рассматривать как специфические ингибиторы. К типичным специфическим активаторам следует отнести желчные кислоты, активирующие липазу. Типичные специфические ингибиторы - антиферменты антипепсин, антитрипсин и др. Многие лекарственные вещества относятся к
300
специфическим ингибиторам, так как они, соединяясь с ферментами микроорганизмов, блокируют их (белый стрептоцид и ферменты стрептококка).
К неспецифическим активаторам относятся различные неорганические катионы, реже - анионы: Na+, К+, Ca2+, Mg2+, Cl и др. Влияние катионов на ферменты более специфично, чем анионов. Некоторые ионы для одних ферментов являются активаторами, для других - ингибиторами (например, Ca2+- активатор для щелочной фосфатазы и ингибитор для глициллейциндипептидазы).
К неспецифическим ингибиторам относятся ферментные яды (HCN, KCN, NaCN), ионы тяжелых металлов, алкалоидные реактивы, азиды, флюориды, сульфиды и др.
Ингибиторы взаимодействуют с активными центрами молекулы фермента, инактивируя функциональные группы белков. Они могут взаимодействовать с металлами, входящими в состав молекул ферментов и фермент-субстратных комплексов, инактивируя их. Высокие концентрации ингибиторов разрушают четвертичную, третичную и вторичную структуры молекулы фермента, вызывая его денатурацию.
Разли чают обратимое и необратимое ингибирование. Примером обратимого ингибирования может быть действие антифермента на фермент. Так, антипепсин в полости желудка под влиянием соляной кислоты становится неактивным, так как комплекс фермент - ингибитор в этих условиях диссоциирует. Пример необратимого ингибирования - действие изопропилфторфосфата на АХЭ.
Различают два типа активирования и ингибирования ферментов:
аллостерическое, или пространственное, и субстратное, или конкурентное.
При отсутствии активатора между молекулой субстрата и молекулой фермента нет контакта и активность фермента сведена к минимуму (рис. 38,I). При наличии активатора он присоединяется к молекуле фермента, меняя ее конфигурацию так, что каталитический центр сближается с субстратом и активность фермента достигает максимальной величины (рис. 38,II). При аллостерическом ингибировании активный центр деформируется и субстрат не может присоединиться к ферменту (рис. 38,III). При конкурентном
301
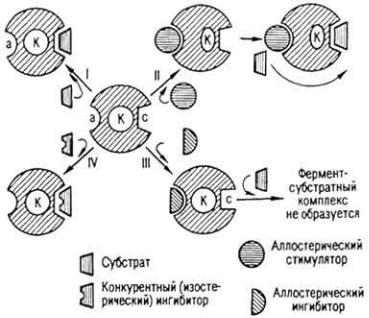
Рис. 38. Схема активирования и ингибирования действия фермента (по Ю. Б. Филипповичу): а - аллостерический центр фермента; К - каталитический центр; с - субстратный центр
ингибировании место субстрата в активном центре занимает аналог и ферментсубстратный комплекс не может возникнуть (рис. 38, IV).
Примером конкурентного ингибирования является взаимодействие СДГ с малоновой кислотой вместо янтарной. Для вытеснения конкурента следует увеличить концентрацию субстрата.
Высокая каталитическая способность. Ферменты обладают высокой каталитической способностью. Так, амилаза слюны проявляет активность при разбавлении 1:1000000, пероксидаза - при разбавлении 1:5 000 000, пепсин - при разбавлении 1:10 000 000; 1 часть реннина способна свернуть 10 000 000 частей казеиногена. Молекула каталазы за 1 с расщепляет 550 000 молекул H2O2.
Единицы измерения активности ферментов
За единицу (E) любого фермента принимается такое его количество, которое катализирует превращение одного микромоля субстрата в минуту при заданных условиях.
302
Активность фермента лучше всего определять по измерению начальной скорости ферментативной реакции во избежание осложнений, зависящих, например, от обратимости реакций или от образования тормозящих продуктов. Чтобы облегчить измерение начальной скорости, добиваются такой концентрации субстрата, которая была бы достаточной для насыщения фермента.
Концентрация фермента в растворах выражается в единицах активности на
1 мл.

Удельная активность выражается в единицах фермента на 1 мл белка. Эта величина связана со степенью чистоты препарата. Если известна удельная активность чистого фермента в единицах на 1 мг фермента, то частное от деления удельной активности исследуемого препарата на величину указывает степень чистоты.
Молекулярная активность соответствует числу молекул субстрата, превращаемых за 1 мин одной молекулой фермента при оптимальной концентрации субстрата, или числу единиц в одном микромоле фермента (что одно и то же, так как единица фермента выражена в микромолях субстрата).
Если фермент имеет простетическую группу или каталитический центр, концентрация которых доступна измерению, то его каталитическое действие можно выразить в величинах активности каталитического центра, т.е. числом молекул субстрата, превращаемых за 1 мин одним каталитическим центром.
Обратимость действия ферментов. Ферменты способны влиять на синтез субстрата и на его распад. Так, пепсин при рН 0,5-2 расщепляет белки до полипептидов, пептидов и аминокислот. При рН 5-6 из этих же аминокислот под влиянием пепсина синтезируются белки. Значение обратимости действия ферментов велико. Оно дает возможность организму экономно расходовать пластические и энергетические материалы. Так, в анаэробной фазе расщепления углеводов гликоген или глюкоза распадается до молочной или пировиноградной кислот. Около 2/3 этих кислот регенерируется до глюкозы и гликогена под влиянием тех же ферментов, которые осуществляли распад.
303
297 :: 298 :: 299 :: 300 :: 301 :: 302 :: 303 :: Содержание
304 :: 305 :: 306 :: 307 :: 308 :: 309 :: 310 :: 311 :: 312 :: 313 :: 314 :: Содержание
Химическая природа ферментов
Для ферментов-белков характерно строение, типичное для этого класса соединений. Для многих из них определены первичная, вторичная, третичная и четвертичная структуры молекул. Так, установлена последовательность аминокислотных остатков в молекуле панкреатической РНК-азы (рис. 39), лизоцима, химо-трипсина, аспартатаминотрансферазы и др. У большинства ферментов молекула состоит из одной полипептидной цепи, имеющей вид α- и β-спиралей. Третичная и четвертичная структуры фермента определяют характер его функций. Так, если молекула имеет 12 субъединиц, то фермент осуществляет реакцию декарбоксилирования (пируватдекарбоксилаза), шесть субъединиц - фермент катализирует окислительно-восстановительные превращения пирувата и др.
Многие ферменты в клетках, где они синтезируются, находятся в неактивном состоянии, как проферменты или зимогены. Они превращаются в ферменты в результате ограниченного протеолиза - расщепления обычно одной пептидной связи и отщепления пептида. Примерами проферментов могут быть пепсиноген и трипсиноген (см. рис. 21 и 23).
Простые ферменты. Молекулы простых ферментов при гидролизе расщепляются до аминокислот. По химическим свойствам простые ферменты относятся к альбуминам (эстераза печени), глобулинам (трипсин и уреаза) и к другим группам простых белков. Простыми
Рис. 39. Первичная
структура молекулы панкреатической РНК-азы
304
ферментами являются многие гидролазы пищевого канала (трипсин, уреаза, РНК-аза, ДНК-аза, химотрипсин), лизоцим яйца и др. У простых ферментов активный центр обычно формируется из остатков гистидина, серина, аргинина, триптофана, цистеина, аспарагиновой и глутаминовой кислот, тирозина. Так, в активном центре РНК-азы размещены два остатка гистидина (в положениях 12 и 119), остаток аспарагина (в положении 121) и лизина (в положении 41). При формировании третичной структуры фермента в его молекуле образуется своеобразный "карман" полипептидной цепи, в котором и происходят
каталитические превращения субстрата.
Сложные ферменты. Большинство ферментов - сложные белки. При диализе белковый компонент (апофермент) остается в диализаторе, небелковый проходит через полупроницаемую перегородку. В присутствии небелковых компонентов (кофакторов) проявляется каталитическое действие многих ферментов. M. Диксон и Э. Уэбб (1982) все кофакторы ферментов делят на три вида: коферменты, простетические группы и активаторы. Ни кофактор, ни апофермент не могут самостоятельно полноценно осуществлять каталитический акт. Так, при соединении железа с молекулой порфирина образуется гем, его каталитическая активность относительно разложения пероксида водорода возрастает в 1000 раз, а после присоединения гема к специфическому белковому компоненту образуется каталаза, каталитическая активность ее в 100 000 000 раз превышает активность кофактора. Кофактор в среднем составляет около 1% общей массы фермента. Часто он непрочно связан с апоферментом и соединяется с ним во время каталитического акта. В этом случае кофактор является типичным коферментом (см. выше). Примером таких ферментов могут быть дегидрогеназы. Во многих ферментах кофактор прочно и постоянно связан с апоферментом, являясь простетической группой, например каталаза и пероксидаза, содержащие гем. К активаторам ферментов относят такие кофакторы, которые переводят фермент в активное состояние, а сами не участвуют в каталитическом акте. К ним относятся многие неорганические ионы. К ферментам такого рода можно отнести карбоксипептидазу, карбоангидразу и др. Их часто называют металлоферментами.
305
Деление кофакторов на три вида условно, так как очень часто трудно провести четкую грань между коферментом и простетической группой, между ионами металлов, входящими в состав молекулы, и ионами, активирующими каталитический процесс.
Функции кофакторов разнообразны. Прежде всего, многие из них служат основой для формирования активного центра и осуществляют контакт молекулы фермента с молекулами субстрата. Они участвуют в переносе атомных групп, атомов, протонов и электронов в ходе процесса. Некоторые из них выполняют связующие функции между разнородными ферментами, обеспечивая согласованность их действия. Катализ осуществляет вся молекула фермента. Ее белковая часть обусловливает скорость реакции и специфичность действия. Один и тот же кофактор может быть составной частью многих ферментов, различных по строению и значению. Так, фосфопиридоксаль - кофактор свыше 30 ферментов, осуществляющих карбоксилирование, транс- и переаминирование.
Коферменты. Коферменты - низкомолекулярные органические соединения небелковой природы, обладающие способностью обратимо связываться с ферментным белком. Их можно отделить от апофермента диализом, действием кислот или щелочей, пропусканием через колонку с сефадексом. Образование
молекулы фермента из апо- и коферментов происходит за счет слабых электростатических или вандерваальсовых сил. При этом затрагиваются вторичная и третичная структуры молекулы, фермент-белок становится более стойким к денатурирующим факторам, чем апофермент. Коферменты в активном центре выполняют роль переносчика различных функциональных групп, протонов и электронов. Отдельные коферменты участвуют в активировании молекул субстратов. Коферменты, отщепляясь от фермента, осуществляют транспортирование этих веществ между отдельными ферментами каталитической цепи, перераспределение их между органоидами и гиалоплазмой. В ходе каталитического акта коферменты не претерпевают глубоких химических изменений и могут многократно (в составе одного или нескольких ферментов) участвовать в ферментативных реакциях.
Большинство коферментов - производные витаминов. Химическая природа кофермента определяет тип и
306
механизмы катализируемых реакций. Недостаток витамина в рационе вызывает угнетение тех реакций обмена веществ, в которых участвует фермент.
Наиболее распространены следующие коферменты.
Н и к о т и н а м и д а д е н и н д и н у к л е о т и д (НАД). Этот кофермент относится к универсальным по распространению и биологической роли. Содержит каталитически активную группировку - амид никотиновой кислоты. Является составной частью свыше 40 дегидрогеназ. Строение и значение НАД рассмотрено на с. 268. Сырьем для получения НАД обычно служат дрожжи.
Н и к о т и н а м и д а д е н и н д и н у к л е о т и д ф о с ф а т (НАДФ). Входит в состав меньшего числа ферментов, чем НАД; НАД в тканях в 5-10 раз больше, чем НАДФ. НАД и НАДФ - первое звено в цепи промежуточных переносчиков водорода при биологическом окислении.
Л и п о е в а я к и с л о т а. Кофермент многих оксидоредуктаз. Связывается с апоферментом через карбоксильную группу и аминогруппу остатка лизина.
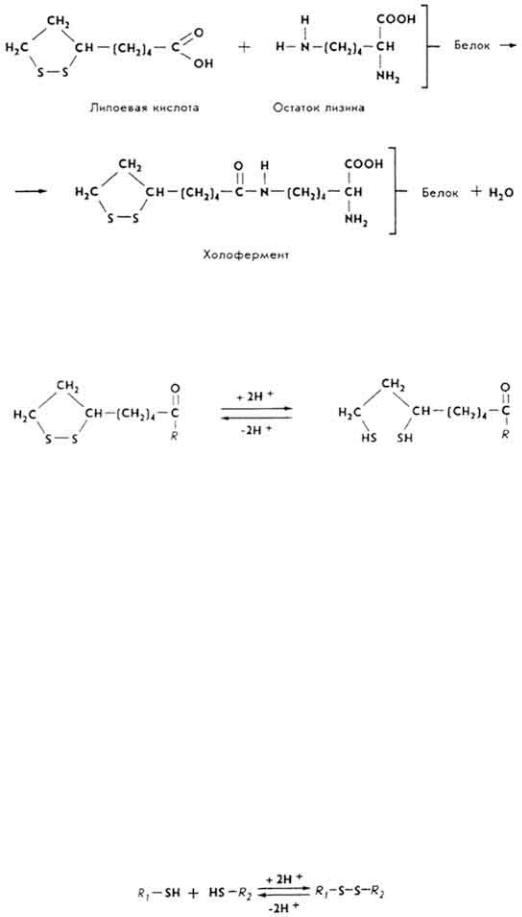
Коферментная функция липоевой кислоты в активном центре фермента обусловлена способностью легко окисляться и восстанавливаться с образованием дисульфидных связей или сульфгидрильных групп.
307
Это дает возможность ферментам, содержащим в молекуле липоевую кислоту, участвовать в переносе ацильных групп и в реакциях биологического окисления.
К о ф е р м е н т A (KoA). Наличие SH-группы в составе молекулы кофермента дает ему возможность легко взаимодействовать с жирными кислотами, образуя ацилпроизводные. KoA иногда называют коферментом ацилирования или ацетилирования. Известно свыше 70 ферментов, в молекуле которых есть KoA. Ацетил-KoA участвует в реакциях переноса, оксидоредукции, изомеризации, конденсации и расщепления ацильных групп.
Г л у т а т и о н . Им богаты печень, надпочечники и эритроциты (0,07- 0,12%). Значение глутатиона в активном центре ферментов обусловлено наличием SH-групп, которые легко вступают в реакцию окисления с аналогичными группами субстрата или соседнего участка фермента, образуя дисульфидные связи (см. с. 187).
В одних случаях это дает возможность ферменту фиксировать субстрат, в других - получать протоны и электроны и т. д. Восстановленный глутатион - кофермент некоторых изомераз, осуществляющих превращение кетоформ кислот в енольные, цис-изомеров кислот в транс-изомеры и др. Некоторые
ферменты (фосфоглицеринальдегиддегидрогеназа) содержат глутатион в виде простетической группы. Известно свыше 100 ферментов, содержащих тиоловые группы. Считают, что глутатион удерживает молекулы ферментов в восстановленной форме.
У б и х и н о н ы . Коферменты - производные 5-метил-2,3- диметоксихинона, к молекуле которого присоединена изопреновая цепь (см. с. 256).
Биологическое значение убихинонов основано на их способности к обратимым окислительно-восстановительным превращениям в качестве промежуточных соединений между флавопротеидами и цитохромами. В липидном слое биологических мембран их в 6-10 раз больше, чем цитохромов.
308
2-O к с о г л у т а р а т . Этот метаболит может выполнять коферментные функции. Составляет единую систему с глутаминовой кислотой в переносе аминогруппы трансам и назами.
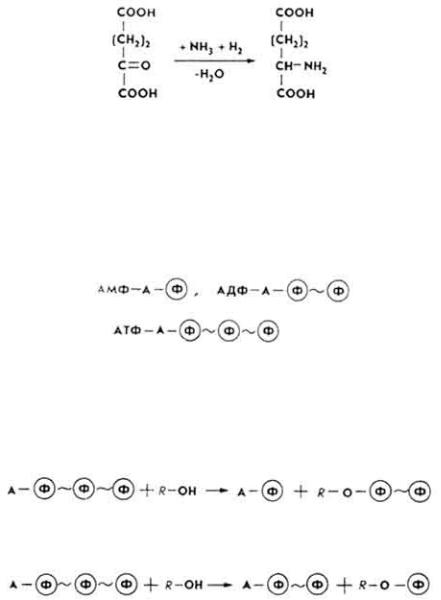
Н у к л е о з и д ф о с ф а т ы . Эти коферменты участвуют в реакциях трансфосфорилирования и передачи энергии от одного процесса к другому. Коферментами являются многие нуклеозидфосфаты: АМФ, АДФ, АТФ, ГМФ, ГДФ, ГТФ, ЦТФ и другие, прежде всего АДФ и АТФ.
Упрощенно структуру аденозинфосфатов можно изобразить так.
Они являются, с одной стороны, источниками химической энергии, с другой - составными частями многих ферментов и коферментов. В частности, АТФ является коферментом ряда киназ, переносящих остаток фосфорной кислоты на монозы.
АТФ может быть источником пирофосфата для углеродов.
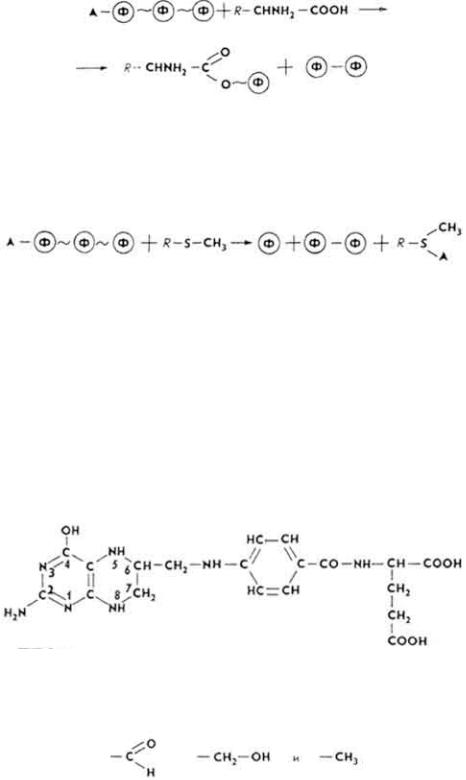
АТФ часто выступает в роли кофермента при переносе аденозинмонофосфорного остатка на аминокислоту.
309
АТФисточник аденозильного остатка при активировании и переносе метильных групп.
В качестве коферментов часто выступают уридинфосфаты и их производные (например, УДФГ) при активировании, переносе и превращении Сахаров: изомеризации галактозы в глюкозу, синтезе сахарозы, лактозы, глюкозидов, хитина и т. д. Коферментные функции выполняют и другие нуклеозидфосфаты. В частности, с участием цитидинфосфатов протекают реакции синтеза отдельных видов фосфатидов, особенно лецитина.
Т е т р а г и д р о ф о л и е в а я к и с л о т а (ТГФК). Это гомолог фолиевой кислоты, у которой восстановлены атомы водорода и азота в положениях 5, 6, 7
и 8.
ТГФК - кофермент большой группы трансфераз, катализирующих реакции, связанные с переносом или активированием одноуглеродных остатков.
С участием его синтезируются и расщепляются пуриновые основания и некоторые аминокислоты: гистидин, глицин и особенно серин.
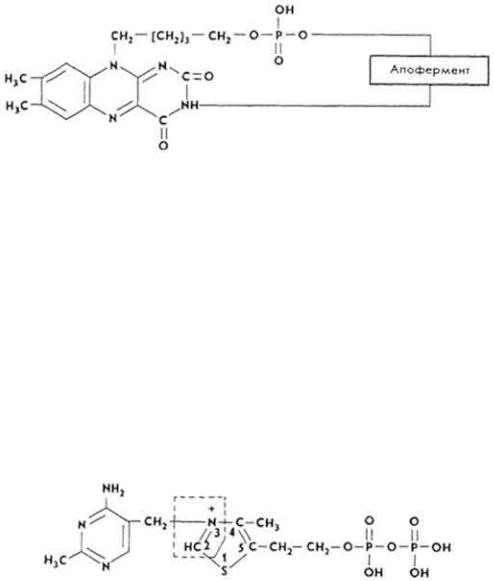
B12-З а в и с и м ы е |
к о ф е р м е н т ы. Кофермент |
B12 - производное |
витамина B12 (см.. с. |
275), где цианистая группа |
замещена на 5'- |
дезоксиаденозин. Кофермент B12 вместе с тетрагидрофолиевой кислотой участвует в переносе метильных групп. Под влиянием соответствующей

метилтрансферазы от 5-метилтетрагидрофолиевой кислоты метальная группа переносится на кофермент B12 и присоединяется к его
310
молекуле вместо 5'-дезоксиаденозина. Затем под влиянием другой трансферазы эта метальная группа переносится на вещество, которое необходимо для синтеза метилсодержащего соединения. Им может быть гомоцистеин, из которого образуется аминокислота метионин. После метилирования витамин B12 снова превращается в кофермент B12 и вступает в реакцию с новыми порциями 5- метилтетрагидрофолиевой кислоты. Кроме того, кофермент B12 участвует в важнейшей для биосинтеза жирных кислот реакции - изомеризации сукцинилКоА в метилмалонил-КоА.
Кофермент B12 участвует в изомеризации глутаминовой кислоты, превращении диолов в альдегиды.
Простатические группы - кофакторы ферментов. Многие ферменты в составе молекул содержат кофакторы, которые прочно соединены ковалентными связями с апоферментами, являясь простетическими группами. Молекулы ферментов слабо или совсем не диссоциируют. При образовании молекулы фермента из апофермента и кофактора образуются стойкие вторичная и третичная структуры. Из кофакторов наибольший интерес представляют следующие.
Ф л а в и н н у к л е о т и д ы . Флавиннуклеотиды - это производные витамина В2, или рибофлавина. В животных клетках встречаются в основном флавинмононуклеотиды (ФМН) и флавинадениндинуклеотиды
311
(ФАД), структурные формулы которых рассмотрены раньше. ФМН и ФАД -
простетические группы флавиновых ферментов, или флавопротеидов. В частности, ФМН, как простетическая группа, соединяясь с апоферментом, образует холофермент - "желтый дыхательный фермент" (ЖДФ)"
Изоаллоксазиновая группировка простетической группы дает возможность ЖДФ выполнять важнейшие каталитические функции, в частности участвовать в реакциях биологического окисления. ЖДФ является переносчиком протонов и электронов в двух направлениях: в сторону цитохромов или от цитохромов к пиридиннуклеотидам дыхательной цепи и к окисленным субстратам. Кроме того, флавиннуклеотиды участвуют в ряде других реакций обмена веществ.
Т и а м и н ф о с ф а т ы . Тиаминфосфаты - производные витамина B1, или тиамина. Простетической группой чаще всего служит тиаминпирофосфат (ТПФ). Соединение его с апоферментами, по-видимому, такое же, как и флавиннуклеотидов. Каталитическая активность фермента связана с ионизацией углеродного атома в положении 2 тиазолового кольца, к которому и присоединяется молекула субстрата.
Под влиянием положительного заряда атома азота от углеродного атома в положении 2 отщепляется протон, возникает отрицательно заряженный карбанион. Карбанион - нуклеофильный центр, который легко вступает в реакцию с субстратом, например с
312
пировиноградной кислотой, образуя пируват-ТПФ-комплекс. Этот комплекс легко декарбоксилируется, образуя альдегидоили кето-ТПФ-комплекс, карбонильная группа которого передается на подходящий акцептор, например на липоевую кислоту.
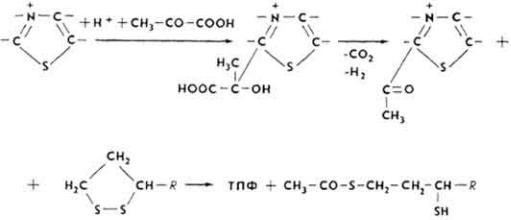
ТПФ после этого вступает в реакцию с новыми порциями субстрата. ТПФ является простетической группой ферментов, участвующих в обмене α- кетокислот, образовании и расщеплении кетосахаров, α-оксикетонов и дикетонов.
П и р и д о к с а л ь ф о с ф а т |
и п и р и д о к с а м и н ф о с ф а т |
- |
производные витамина B6. Являются |
составной частью пиридоксалевых |
|
ферментов. С их деятельностью связано большинство превращений α- аминокислот: переаминирование, декарбоксилирование, рацемация, конденсация β- и γ-замещенных α-аминокислот и т. д. Теория каталитического действия этих ферментов впервые разработана советскими биохимиками A. E. Браунштейном и M. M. Шемякиным на примере реакций переаминирования (см. с. 271). Они позволяют организму получить нужные заменимые аминокислоты для клеток и тканей.
Б и о т и н . Присоединение биотина к апоферменту осуществляется с помощью пептидной связи, которая образуется за счет карбоксильной группы биотина и ε-аминогруппы остатка лизина (протеина). Биотин входит в молекулы многих ферментов, катализирующих реакции карбоксилирования и переноса карбоксильных групп.
Ж е л е з о п о р ф и р и н о в ы е к о м п л е к с ы
313
являются простатической группой каталазы, пероксидазы и цитохромов. В каталазе и пероксидазе простатическая группа представляет собой гем. Цитохромы делят на четыре группы:
1)цитохромы А - содержат железо-формилпорфирин;
2)цитохромы В - содержат железо-протопорфирин;
3)цитохромы С - содержат замещенный железомезопорфирин с ковалентными связями между белком и порфирином;
4)цитохромы D - содержат железо-дигидропорфирин.
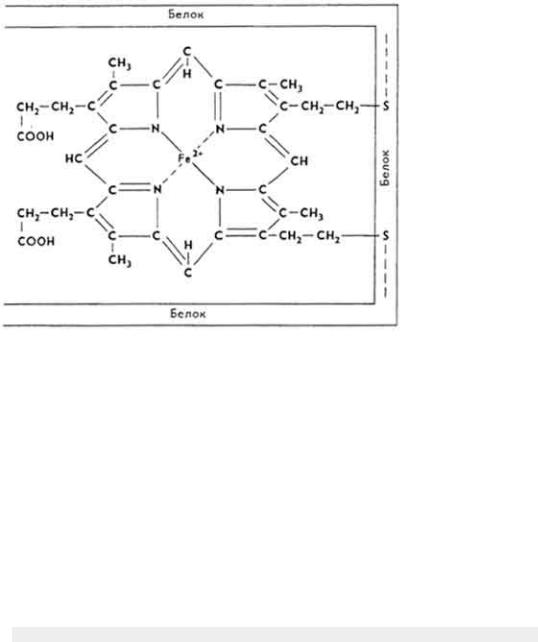
Апоферменты представляют собой низкомолекулярные белки. Связь между апоферментом и простетической группой чаще всего ковалентная и дополнительная. Примером может быть цитохром с.
Каждая группа цитохромов состоит из индивидуальных представителей. Они обозначаются малыми латинскими буквами и цифровыми подстрочными индексами: а, а1, a2, b, b1, b2 и т. д.
Цитохромы являются составной частью дыхательной цепи. В ходе ее функционирования электроны последовательно переносятся от "желтого дыхательного фермента" на цитохромы b, c1, с, а и а3. Под влиянием фермента цитохромоксидазы цитохром а окисляется, отнятый электрон переносится на атом кислорода, который ионизируется и реагирует с ионом водорода. Образуется вода. Энергия аккумулируется в виде АТФ.
314
304 :: 305 :: 306 :: 307 :: 308 :: 309 :: 310 :: 311 :: 312 :: 313 :: 314 :: Содержание

315 :: 316 :: Содержание
Изоферменты
Изоферменты - это разновидности фермента, обладающие одной и той же субстратной специфичностью, но отличающиеся между собой некоторыми физическими, химическими, каталитическими и иммунологическими свойствами. Молекула изофермента состоит из нескольких субъединиц, которые формируют ее четвертичную структуру. В настоящее время известны изоферменты ряда ферментов: лактатдегидрогеназы (ЛДГ), фосфоглюкомутазы, альдолазы, креатинкиназы, малатдегидрогеназы, изоцитратдегидрогеназы, глюкозо-6-фосфатдегидрогеназы, фосфоглюконатдегидрогеназы, а также другие.
Наиболее подробно изучены изоферменты ЛДГ, осуществляющей превращения молочной и пировиноградной кислот.
Молекулярная масса ЛДГ составляет 140 тыс. Ее молекула состоит из четырех субъединиц, которые делятся на два вида: H (преобладают в миокарде) и M (им наиболее богата скелетная мышца). Для ЛДГ цыпленка и других животных характерны пять изоферментов, состоящих из следующих субъединиц: I-HHHH, II-НННМ, III-HHMM, IV-HMMM и V-MMMM.
Изоферменты имеют нумерацию: I-ЛДГ1, II-ЛДГ2, III-ЛДГ3, IV-ЛДГ4 и V- ЛДГ5. Первые два изофермента при электрофорезе движутся к аноду - анодные фракции, последние два движутся к катоду - катодные фракции, и средний изофермент занимает промежуточное положение.
Фракции отличаются между собой биологической ролью. Так, анодные фракции осуществляют процесс превращения пировиноградной кислоты в аэробных условиях, катодные - в анаэробных; а промежуточная фракция - в аэробных и анаэробных. Для каждой ткани и каждого органа характерен свой изоферментный спектр.
Так, в миокарде, мозгу, почках и эритроцитах преобладают изоферменты ЛДП и ЛДП. Именно под их влиянием из молочной кислоты образуется пировиноградная кислота, которая служит источником ацетил-KoA. ЛДГ 4 и ЛДГ5 типичны для скелетных мышц, тканей легких и печени. Под влиянием изоферментов пировиноградная кислота восстанавливается до молочной
315
кислоты. ЛДГ3 преобладает в тканях эндокринных желез и селезенки.
Спектр изоферментов может изменяться в различные периоды онтогенеза и при патологии. Его определение дает возможность диагностировать болезнь и контролировать лечение. Так, при нефритах в составе - крови и мочи появляются дополнительные фракции ЛДГ4 и ЛДГ5, нетипичные для здоровых животных. При заболеваниях легких в крови и в моче возрастает содержание

ЛДГ3.
316
315 :: 316 :: Содержание

324 :: 325 :: 326 :: 327 :: 328 :: 329 :: 330 :: 331 :: 332 :: 333 :: Содержание
Номенклатура и классификация ферментов
В настоящее время известно свыше 2000 ферментов. По мере развития биохимии возникала необходимость в совершенствовании номенклатуры и классификации ферментов. К первым ферментам, открытым биохимиками, относятся гидролазы. Затем открыты ферменты, осуществляющие негидролитический распад сложных веществ, - десмолазы, или лиазы, и др. Ферменты стали называть по характеру каталитического действия, природе субстрата и другим признакам, добавляя к корню слова суффикс -аза. Так возникли тривиальные названия ряда классов (например, гидролазы), групп (пептидазы) и отдельных представителей (амилаза) ферментов.
На V Международном биохимическом конгрессе, проходившем в 1961 г. в Москве, приняты новые классификация и номенклатура ферментов. За основу взят принцип классификации ферментов по типу химических реакций, которые они катализируют. Все известные ферменты делятся на шесть классов: 1 - оксидоредуктазы; 2 - трансферазы; 3 - гидролазы; 4 - лиазы; 5 - изомеразы; 6 - лигазы (синтетазы).
Каждый класс ферментов подразделяется на подклассы, которые делятся на подподклассы, состоящие из отдельных представителей. Единая система классификации ферментов основана на четырехзначном десятичном коде, согласно которому классам, подклассам, подподклассам и индивидуальным ферментам присваиваются номера (шифры). Первая цифра шифра показывает, к какому из шести классов относится данный фермент, вторая обозначает подкласс в классе, третья - подподкласс, четвертая - порядковый номер фермента в данном подподклассе. Ферменты, для которых каталитические реакции изучены пока недостаточно, временно отнесены в подподкласс с номером 99.
В настоящее время пользуются двумя номенклатурами-тривиальной (рабочей) и систематической. Тривиальные названия ферментов краткие, например: пепсин, трипсин, уреаза, мальтаза, лактаза.
324
Систематические названия точно идентифицируют фермент и по возможности точно определяют его действие. Оно состоит из двух частей: первая часть названия отражает наименование главного субстрата, вторая - характер катализируемой реакции и имеет суффикс -аза. В начале шифра ставится две буквы-КΦ (классификация ферментов) - и четыре числа, разделенных между собой точками, - четырехзначный десятичный код фермента. Так, фермент, расщепляющий гидролитически пептидную связь между двумя остатками глицина (глицилглицина), называется глицилглицингидролаза, его шифр - КФ 3.4.3.1. Если фермент катализирует реакцию между двумя субстратами (в частности, перенос отдельных групп атомов), то в первой
части названия фермента указывается наименование этих субстратов, ставится двоеточие без интервала, а во второй части указывается характер химической реакции и добавляется суффикс-аза. Так, фермент, переносящий атомы водорода от молочной кислоты на кофермент НАД, называется L-лактат: НАД - оксидоредуктаза, его шифр - КФ 1.1.1.27. В ряде случаев дается подробное указание об отдельных сторонах химизма действия фермента (с помощью скобок) за систематическим названием. Так, фермент, дезаминирующии L- глутаминовую кислоту путем переноса водорода на НАД, называется L- глутамат: НАД - оксидоредуктаза (дезаминирующая), его шифр - КФ 1.4.1.2.
По новой классификации можно быстро найти в Списке ферментов нужный фермент, узнать его тривиальное и систематическое название, номер (шифр), активные группы и кофакторы, характер химической реакции, катализируемой им, узнать об источниках сырья для его получения и др.
Ниже приводятся сведения по новой классификации и номенклатуре ферментов. Классы представлены полностью, подклассы, подподклассы и индивидуальные ферменты - выборочно, в зависимости от их значения в обмене веществ в организме животных.
1 . О к с и д о р е д у к т а з ы . Ферменты, катализирующие окислительновосстановительные процессы. Оксидоредуктазы - двухкомпонентные ферменты. Функции кофакторов здесь могут выполнять пиридин- (НАД и НАДФ) и флавиннуклеотиды (ФМН и ФАД),
325
железопорфириновые комплексы (гем) и многие катионы (Fe3+, Fe2+, Co2+, Mo2+, Cu2+, Zn2+ и др.). Химические реакции, в которых участвуют оксидоредуктазы, позволяют клеткам получать химическую энергию в виде макроэргических соединений.
Известно свыше 200 оксидоредуктаз. Они объединены в 14 подклассов. По тривиальной номенклатуре ферменты разделяются в соответствии с характером каталитического действия на дегидразы (отщепляют от субстрата атомы водорода или электроны и переносят их на другой субстрат), оксидазы (акцептором является кислород), гидроксилазы (включают в восстановленный субстрат один атом кислорода) и оксигеназы (вводят в окисляющийся субстрат два атома кислорода).
При систематической номенклатуре в названии фермента указываются субстрат-донатор, субстрат-акцептор, слово "оксидоредуктаза" и шифр.
1.1. Оксидоредуктазы, действующие на CH-OH-группу доноров. Подкласс делится на четыре подподкласса. Примером, когда акцептором является НАД или НАДФ, может быть фермент спиртового брожения -алкогольдегидрогеназа (алкоголь: НАД - оксидоредуктаза, КФ 1.1.1.1), осуществляющая окисление спиртов с участием НАД и ионов Zn2+:
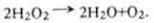
Алкоголь+НАДФ=Альдегид или кетон+НАД∙H2.
Ко второму подклассу относятся ферменты, у которых акцептором служит цитохром. В частности, лактатдегидрогеназа (L-лактат: цитохром с - оксидоредуктаза, КФ 1.1.2.3), катализирующая окисление лактата с участием цитохрома с и при наличии ионов Zn2+:
L-Лактат+Феррицитохром с = Пируват+Ферроцитохром с.
Для ряда ферментов акцептором является кислород, в частности для гексооксидазы (D-гексоза: O2-оксидоредуктаза, КФ 1.1.3.5):
β-D-Глюкоза+O2=D-Глюконо-δ-лактон+Н2O2.
1.2. Оксидоредуктазы, действующие на альдегидную или кетонную группу доноров. В зависимости от
326
природы акцептора подкласс делится на пять подподклассов (акцепторы - НАД или НАДО, цитохромы, O2, липоевая кислота и др.). Примером может быть глицеральдегадфосфатдегидрогеназа [D-глицеральдегид-3-фосфат: НАД - оксидоредуктаза (фосфорилирующая), КФ 1.2.1.12]. Реакция:
1.9. Оксидоредуктазы, действующие на группы тема доноров. Подкласс состоит из шести подподклассов. В организме животных широко распространена цитохромоксидаза (цитохром с: O2 - оксидоредуктаза, КФ 1.9.3.1), окисляющая цитохром с при переносе электронов на кислород:
4Ферроцитохром c+O2 = 4Феррицитохром с+2Н2O.
1.11. Оксидоредуктазы, использующие в качестве акцептора H2O2.
Наиболее распространены два фермента - пероксидаза и каталаза. Их простетическая группа представлена гемом. Пероксидаза (донор : H2O2 - оксидоредуктаза, КФ 1.11.1.7) катализирует реакцию
Донор+Н2O2 = Окисленный донор+2Н2О.
Каталаза (H2O2 : H2O2 - оксидоредуктаза, КФ 1.11.1.6) разрушает пероксид водорода:
2Н2O2 → 2Н2O + O2.
2 . Т р а н с ф е р а з ы . Это класс ферментов, катализирующих перенос
химических групп от одного соединения (донора) к другому (акцептору). Каталитический процесс состоит из нескольких стадий. Главной из них является образование промежуточного продукта - фермент-транспортированной группы. Если донатор обозначить А, транспортированную группу - T, фермент - Ф, акцептор - Д, то эти реакции можно изобразить так: А + Ф  В + ФТ; ФТ + Д
В + ФТ; ФТ + Д  ДТ + Ф. Класс трансфераз объединяет около 1000 ферментов.
ДТ + Ф. Класс трансфераз объединяет около 1000 ферментов.
327
Он состоит из восьми подклассов. Систематическое название фермента создается по схеме: донор: акцептор - группа-трансфераза. В тканях животного наиболее распространены следующие подклассы трансфераз.
2.1. Трансферазы, переносящие одноуглеродные остатки. В зависимости от природы остатка в подклассе различают три подкласса" Особого внимания заслуживают метилтрансферазы, осуществляющие реакции переметилирования. К ним относится никотинамид-метилтрансфераза (S-аденозилметионин: никотинамид - метилтрансфераза, КФ 2.1.1), катализирующая образование N- метилникотинамида за счет переноса метильной группы с "активного" метионина на никотинамид:
S-Аденозилметионин+Никотинамид = S-Аденозилгомоцистеин+N- Метилникотинамид.
Широко распространены в тканях карбоксил- и карбамоилтрансферазы, катализирующие перенос COOH- и COO-NH2-групп. Так, в тканях печени содержится орнитин-карбамоилтрансфераза (карбамоилфосфат: L-opнитин - карбамоилтрансфераза, КФ 2.1.3.3), катализирующая реакцию
Карбамоилфосфат+L-Орнитин = Ортофосфат+L-Цитруллин.
2.3. Трансферазы, переносящие ацильные остатки. Это ферменты,
осуществляющие перенос остатков жирных кислот с помощью KoA на различные акцепторы (глицин, карнитин, холин и др.). Примером может быть холин-ацетилтрансфераза (ацетил-КоА: холин -0-ацетилтрансфераза, КФ 2.3.1.6), синтезирующая в нервной ткани ацетилхолин:
Ацетил-КоА+Холин=КоА+О-Ацетилхолин.
2.4. Трансферазы, переносящие гликозильные остатки. Это ферменты,
катализирующие перенос остатков углеводов от различных гликозильных соединений. Примером может быть УДФ-галактоза-глюкоза - галактозилтрансфераза (УДФ-галактоза: D-глюкоза - 1-галактозилтрансфераза, КФ 2.4.1.22), катализирующая образование молочного сахара (лактозы):
328
УДФ-Галактоза+D-Глюкоза=УДФ+Лактоза.

2.6. Трансферазы, переносящие азотистые группы. Подкласс состоит из трех подподклассов (аминотрас-феразы, амидинотрансферазы, оксиминотрансферазы). Большое значение имеет аланин-аминотрансфераза (L- аланин: 2-оксоглутарат - аминотрансфераза, КФ 2.6.1.2), катализирующая двустороннее перенесение аминогруппы:
L-Аланин+2-Оксоглутарат=Пируват+L-Глутамат.
2.7. Трансферазы, переносящие фосфатные группы. Подкласс делится на семь подподклассов. Примером фермента, катализирующего присоединение фосфатной группы к спиртовому гидроксилу, может быть гексокиназа (АТФ: D- гексоза - 6-фосфотрансфераза, КФ 2.7.1.1). Реакция:
АТФ+D-Гексоза=АДФ+D-Гексозо-6-фосфат.
3. Г и д р о л а з ы . Это ферменты, катализирующие реакции расщепления (иногда и синтеза) органических веществ при участии воды:
Они участвуют в обмене нуклеиновых кислот, белков, липидов, углеводов и других соединений. Большинство гидролаз - простые белки. Каталитическая активность зависит от наличия в их каталитических центрах SH-групп. Известно свыше 200 гидролаз. Их делят на девять подклассов.
3.1. Гидролазы, действующие на сложноэфирные связи. По тривиальной номенклатуре их называют эстеразами. Подкласс состоит из шести подподклассов: гидролазы эфиров карбоновых кислот, тиоловых эфиров, фосфомоноэфиров, фосфодиэфиров, трифосфомоноэфиров и сульфоэфиров. В организме широко распространена липаза (гидролаза эфиров глицерина, КФ 3.1.1.3), особенно в тканях поджелудочной железы. Под ее влиянием, в том числе и в тонкой кишке, происходит расщепление нейтральных жиров:
Триглицерид+Н2О=Диглицерид+Жирная кислота.
329
Гидролазы тиоловых эфиров расщепляют сложные эфиры, образованные SH-группами и карбоновыми кислотами. Так, ацетил-КоА-гидролаза (ацетилKoA - гидролаза, КФ 3.1.2.1) катализирует разложение ацетил-КоА:
Ацетил-КоА+Н2О=КоА+СН3-СООН.
Под влиянием гидролаз фосфомоноэфиров (фосфатаз) фосфорные эфиры расщепляются на спирты и фосфорную кислоту. Так, щелочная фосфатаза (фосфогидролаза моноэфиров ортофосфата, КФ 3.1.3.1) катализирует реакцию
Моноэфир ортофосфата+Н2О=Спирт+Н3РO4.

3.2. Гидролазы, действующие на гликозильные соединения. По тривиальной номенклатуре этот подкласс называют гликозидазами. Подкласс состоит из трех подподклассов: гидролазы гликозидов, N-гликозильных и S- тликозильных соединений. Сюда входят α- и β-амилазы, целлюлаза, инулаза, α- и β-глюкозидазы, нуклеозидаза и др. Типичным представителем первого подподкласса является α-амилаза (α-1,4-глюкан - 4-глюканогидролаза, КФ 3.2.1.1), осуществляющая в присутствии ионов Ca2+ гидролитическое расщепление α-1,4-глюкановых связей в полисахаридах.
Механизм действия ферментов второго подподкласса отражает HАД(Ф) - нуклеозидаза [НАД(Ф) - гликогидролаза, КФ 3.2.2.6]:
НАД (Ф)+Н2О=Никотинамид+R(Ф).
3.4.Пептид-гидролазы. Они катализируют расщепление пептидных связей
вбелках:
Подкласс состоит из четырех подподклассов: α-аминопептид- а м и н о а ц и д о г и д р о л а з ы , α-карбоксипептид-аминоацидогидролазы, дипептидгидролазы и пептид-пептидогидролазы. В подкласс входят многие
330
известные ферменты. Так, аминотрипептидаза (КФ 3.4.2.1) гидролизует пептиды, содержащие нейтральные аминокислоты, с отщеплением N-концевого остатка молекулы; карбоксипептидаза А (КФ 3.4.2.1) гидролизует пептиды с отщеплением С-концевого остатка молекулы; пепсин (КФ 3.4.4.1) гидролизует пептиды по связям, прилегающим к остаткам ароматических или дикарбоновых L-аминокислот; катепсин С (КФ 3.4.4.1) гидролизует пептиды, особенно по связям, содержащим остаток ароматической аминокислоты, смежной со свободной α-аминогруппой, и т. д.
4 . Л и а з ы . Катализируют реакции негидролитического отщепления определенных групп от субстратов с образованием двойных связей или реакции присоединения этих групп по двойным связям. Некоторые лиазы в отличие от лигаз осуществляют реакции синтеза отдельных веществ без участия макроэргических соединений. Большинство лиаз - сложные белки, содержащие в молекулах фосфорные эфиры водорастворимых витаминов. Класс состоит из пяти подклассов: углерод - углерод-лиазы, углерод - кислород-лиазы, углерод - азот-лиазы, углерод - сера-лиазы и углерод - галоид-лиазы.
4.1. Углерод - углерод-лиазы . Ферменты, осуществляющие в основном разрыв С-С-связей. В подкласс входят три подподкласса: карбокси-лиазы, альдегидлиазы и лиазы кетокислот. Типичный представитель - пируватдекарбоксилаза (карбокси-лиазы 2-оксокислот, КФ 4.1.1.1), осуществляющая декарбоксилирование:
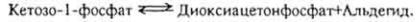
2-Оксокислота=Альдегид+СО2.
Животные ткани, особенно печени, богаты альдолазой (кетозо-1-фосфат- альдегидлиаза, КФ 4.1.2.7), катализирующей реакцию
4.2. Углерод - кислород-лиазы. Их часто называют гидролиазами или дегидратазами (гидратазами). Наиболее изученным ферментом подкласса является карбонат-дегидратаза, или карбоангидраза (карбонат -
331
гидролиаза, КФ 4.2.1.1), катализирующая в тканях реакцию
H2CO3=CO2 + H2O.
5 . И з о м е р а з ы . Эти ферменты катализируют реакции внутримолекулярного перемещения различных групп органических веществ. Состоят из пяти подклассов.
5.1. Рацемазы и эпимеразы. Катализируют реакции инверсии асимметрических, групп в молекулах различных веществ. Различают четыре подподкласса: рацемазы и эпимеразы аминокислот и их производных, оксикислот и их производных, углеводов и их производных и других соединений. Ферменты, осуществляющие реакцию изомеризации в субстратах с одним асимметрическим атомом, называют рацемазами. К ним относятся ферменты, превращающие L-аминокислоты в D-аминокислоты, в частности аланинрацемазу (аланинрацемаза, КФ 5.1.1.1):
L=Аланин-D-Аланин.
Ферменты, осуществляющие превращение субстратов с несколькими асимметрическими атомами углерода, называются эпимеразами. Так, УДФ- глюкозо-эпимераза (УДФ-глюкозо-4-эпимераза, КФ 5.1.3.2) в тканях молочной железы изомеризует УДФ-глюкозу в УДФ-галактозу, необходимую для биосинтеза лактозы (при участии НАД и ионов Mg2+):
УДФ-Глюкоза=-УДФ-Галактоза.
5.3. Внутримолекулярные оксидоредуктазы. Эти ферменты катализируют взаимопревращения альдоз и кетоз. С их участием окисляются - СН-ОН-группы, одновременно восстанавливается соседняя СО-группа, Так, триозофосфат-изомераза (D-глицеральдегид-3-фосфат - кетол-изомераза, КФ 5.3.1.1) катализирует в тканях реакцию
D-Глицеральдегид-3-фосфат=Диоксиацетонфосфат.
6 . Л и г а з ы |
( с и н т е т а з ы ). Эти ферменты катализируют |

присоединение друг к другу двух молекул, сопряженное с отщеплением остатков фосфорной кислоты от АТФ или ее аналогов. Термин "лигазы"
332
применяют также к ферментам, катализирующим реакции синтеза без нуклеозидтрифосфатов. Они способствуют образованию химических связей, что и явилось причиной их названия (от лат. ligare - связывать) . Механизм реакций представляет собой или трехстадийный перенос, или образование тройных комплексов. Кофактором многих лигаз является биотин и его производные. Число лигаз, известных сейчас, достигает 100.
6.1. Лигазы, образующие С-О-связи. В подкласс входят ферменты,
катализирующие присоединение аминокислот к соответствующим тРНК, Число лигаз соответствует количеству аминокислот, используемых для биосинтеза молекул белков. Возникают аминоацил-тРНК. Так, тирозил-тРНК - синтетаза [L- тирозин; тРНК-лигаза (АМФ), КФ 6.1.1.1], при наличии ионов Mg2+ и K+ катализирует реакцию
АТФ+L-Тирозин+тРНК=АМФ+Пирофосфат+L-Тирозил-тРНК.
6.3. Лигазы, образующие C-N-связи. Подкласс состоит из пяти подподклассов: амидсинтетазы, пептидсинтетазы, циклолигазы, прочие C-N- лигазы и C-N-лигазы с глутамином в роли N-донора. Особое значение имеют пептидсинтетазы, под влиянием которых из аминокислот синтезируются пептиды. Например, γ-глутамилцистеинсинтетаза [L-глутамат: L-цистеин -γ- лигаза (АДФ), КФ 6.3.2.2] в тканях печени при наличии ионов Mg2+ катализирует реакцию образования дипептида:
АТФ+L-Глутамат+L-Цистеин=АДФ+Ортофосфат+γ-L-глутамил-L-цистеин.
Классификация и номенклатура ферментов в ходе развития биохимии и в результате открытия новых ферментов постоянно совершенствуется, а их число с каждым годом увеличивается.
333
324 :: 325 :: 326 :: 327 :: 328 :: 329 :: 330 :: 331 :: 332 :: 333 :: Содержание

333 :: 334 :: 335 :: Содержание
Взаимосвязь между ферментами
Обмен веществ в организме катализируется полиферментными системами, в которые входят ферменты, принадлежащие ко всем шести классам. Между ферментами существуют взаимосвязь, преемственность и последовательность. Для нормального протекания
333
обменных процессов необходимы оптимальные условия ферментативного катализа. Отсутствие одного из ферментов системы влечет за собой нарушение обмена веществ организма в целом.
Связь между ферментами может носить различный характер. Например, в полости желудка под влиянием пепсина начинается расщепление белков корма, в дальнейшем эти процессы продолжаются, завершаясь в тонкой кишке вследствие действия ферментов трипсина, химотрипсина, аминополипептидаз, карбоксиполи-пептидаз, три- и дипептидаз. Часто система связи между ферментами создается посредством промежуточных продуктов реакции, причем продукт, возникший в результате деятельности одного фермента, является субстратом для следующего фермента. Примерами могут быть анаэробная фаза расщепления углеводов, цикл трикарбоновых кислот, β-окисление жирных кислот, орнитиновый цикл образования мочевины и др. Продукты реакции одного фермента в избытке могут тормозить его активность или активность другого фермента.
Так, избыток молочной кислоты в среде угнетает активность ЛДГ. Такой вид торможения деятельности ферментов называется субстратным, так как фермент, способствующий образованию субстрата, сам оказался заблокированным. Если субстрат тормозит активность ключевого фермента, которым начинается метаболический цикл, такое торможение называется ретроградным. Так, избыток молочной кислоты тормозит деятельность гексокиназы, которой начинается распад гликогена или глюкозы. Возникает торможение деятельности фермента по принципу обратной связи.
Существует преемственность в деятельности ферментов различных классов. Так, питательные вещества корма под влиянием гидролаз пищеварительных соков расщепляются на простые вещества (монозы, глицерин, жирные кислоты, аминокислоты и т. д.). Они поступают в кровеносную систему, затем - в органы, ткани и клетки. В клетках под влиянием различных лигаз из них образуются вещества, необходимые для пластических, защитных, регуляторных, энергетических и других потребностей. Такие ферменты принято называть регуляторными. Они обычно размещены в начале мультиферментной системы. Продукт ферментативной
334

реакции в данном случае действует как аллостерический ингибитор.
В ряде случаев взаимосвязь ферментов между собой осуществляется генетически, т. е. кодируется генетической информацией, заложенной в молекуле ДНК, и передается через синтез ферментативных белков. Отдельные ферменты могут синтезироваться в клетках под влиянием определенного субстрата. В отличие от конституционных ферментов, которые всегда присутствуют в клетке, эти ферменты называют адаптивными или индуцибельными. Они синтезируются в клетке в результате депрессии генов, не допускающих образования этих ферментов, как ответ на появление в среде индуктора-субстрата. Иногда наступает дерепрессия синтеза группы ферментов, так как дерепрессируется группа генов, размещенных в части молекулы ДНК, ответственной за их синтез, опероне.
335
333 :: 334 :: 335 :: Содержание

335 :: 336 :: Содержание
Ферменты в народном хозяйстве, медицине, ветеринарии и зоотехнии
Вкожевенном и меховом производстве применяют препараты пептидогидролаз, ускоряющих удаление шерсти из шкур и размягчение кожи в несколько раз, а также повышающих сортность и качество кожи и меха. Лизоцим используют в качестве консерванта коровьего молока и икры осетровых рыб; глюкозооксидаза - как антиокислитель при хранении мяса, фруктовых соков.
Вмедицине и ветеринарии широко применяется энзимодиагностика. Так, многие заболевания печени (желтухи, гепатиты, циррозы) диагностируют по увеличению в крови содержания щелочной фосфатазы. При различных заболеваниях печени в крови увеличивается содержание альдолазы, трансаминазы и резко уменьшается содержание амилазы. Появление в моче и крови изоферментов ЛДГ4 и ЛДГ5 может быть признаком некоторых болезней
почек, изофермента ЛДП - легких. При инфаркте миокарда в крови возрастает содержание аминотрансфераз и альдолазы. Уменьшение активности пероксидазы в слизи влагалища коров свидетельствует об их охоте.
Многие ферменты применяют с терапевтической целью. Так, препарат трипсина в сочетании с
335
антибиотиками используют при лечении хронических язв конечностей, карбункулов, фурункулов, панарициев и пиодермии. Панкреатическую ДНК-азу применяют при лечении некоторых респираторных заболеваний. Гиалуронидазу в небольших дозах используют для ускорения всасывания различных лекарств, вводимых подкожно. Препараты гиалуронидазы применяют в хирургии, в офтальмологии, животноводстве, гинекологии. Они используются для рассасывания гематом, экссудатов и транссудатов. Для разрушения тромбов часто используют фибринолизин. Аспарагиназу, расщепляющую аспарагин, необходимый для синтеза белков раковыми клетками, назначают при лечении злокачественных образований.
Контрольные вопросы
1.Что такое ферменты, проферменты, антиферменты и изоферменты? Каковы их химическая природа, свойства, химическое строение и значение?
2.Что лежит в основе механизма действия ферментов? Какова кинетика ферментативного катализа?
3.Приведите примеры ферментов всех шести классов, наиболее распространенных в организме животных, и назовите их по тривиальной и

систематической номенклатурам.
4. Что вам известно о применении ферментов в народном хозяйстве, медицине, ветеринарии и животноводстве?
336
335 :: 336 :: Содержание

336 :: 337 :: 338 :: Содержание
ГЛАВА 10
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Развитие учения о биологическом окислении
Основы учения об окислении заложили M. В. Ломоносов (1757) и А.-Л. Лавуазье (1777). Эти ученые установили, что при взаимодействии многих простых веществ с кислородом возникают ангидриды угольной, серной и фосфорной кислот. Присоединение кислорода к тому или иному химическому элементу было названо окислением, а отнятие - восстановлением. Вскоре было выявлено, что и в живых организмах происходят такие же реакции. Они и были названы реакциями биологического окисления. Со временем устанавливается аналогия между горением в неорганической природе и
336
дыханием в живом организме. А.-Л. Лавуазье высказал предположение, что при дыхании кислород в тканях соединяется с углеродом и водородом, что приводит к образованию CO2, H2O и энергии. Энергетический эффект при окислении органических веществ (например, глюкозы) в организме и вне его оказался один и тот же: C6H12O6 + 6O2  6CO2 + 6H2O + 2881 кДж/моль.
6CO2 + 6H2O + 2881 кДж/моль.
Действительно, химическая энергия в организме образуется в результате тканевого или клеточного дыхания. Этот процесс назван дыханием потому, что ткани и клетки поглощают O2 и выделяют CO2. Живые ткани, взятые биопсией или от только что убитого животного, некоторое время обладают такой способностью.
Была установлена разница между одинаковыми по энергетическому эффекту и различными по типу протекания реакциями окисления - горением и дыханием. Так, горение происходит при высоких температурах, тканевое дыхание - при температуре 36,5-37°C. При горении освобождаемая энергия выделяется в виде теплоты, а при тканевом дыхании главным образом в виде макроэргических и других фосфорсодержащих соединений. При горении энергия освобождается сразу, а при тканевом дыхании - малыми порциями в результате длинной цепи последовательных реакций. Горение невозможно в водной среде, а тканевое дыхание возможно.
Выявляются особенности дыхания в зависимости от состояния организма, природы органа, ткани и других факторов. Так, при интенсивной мышечной нагрузке потребление кислорода мышечной тканью возрастает в 10 раз по сравнению с состоянием покоя. Организм трехлетнего ребенка на 1 кг массы вдвое больше потребляет кислорода, чем у взрослого человека. Определяется интенсивность дыхания в зависимости от природы субстрата. Вводится понятие

дыхательный коэффициент - соотношение между объемами выделившегося углекислого газа и поглощенного кислорода (CO 2:O2). Для углеводов он равен 1, для белков -0,8, для жиров - 0,7.
В конце прошлого и в начале нынешнего столетия возникает ряд теорий, объясняющих механизм тканевого дыхания: перекисная теория A. H. Баха и
теория активации водорода.
337
Постепенно появляются предпосылки для создания современной теории тканевого дыхания. В 1925-1926 гг. Д. Кейлин открывает цитохромы. В 1931 г. О. Варбург устанавливает природу и функции дыхательных ферментов. А. СентДьердьи приходит к выводу, что тканевое дыхание представляет собой одновременно и дегидрирование субстратов, и активацию кислорода. В 1930 г. В. А. Энгельгардт открывает окислительное фосфорилирование. Создаются представления о существовании в тканях дыхательной цепи, состоящей из субстратов окисления, ферментов и кофакторов. В 1939 г. В. А. Белицер и E. T. Цыбакова устанавливают, что процессы накопления тканями макроэргических соединений сопряжены с переносом электронов в дыхательной цепи. Выявляется связь клеточного дыхания с функционированием основных метаболических циклов превращений углеводов, липидов, белков. Определяется локализация процессов клеточного дыхания в микроструктурах митохондрий. Создается схема клеточного дыхания (рис. 43).
338
336 :: 337 :: 338 :: Содержание
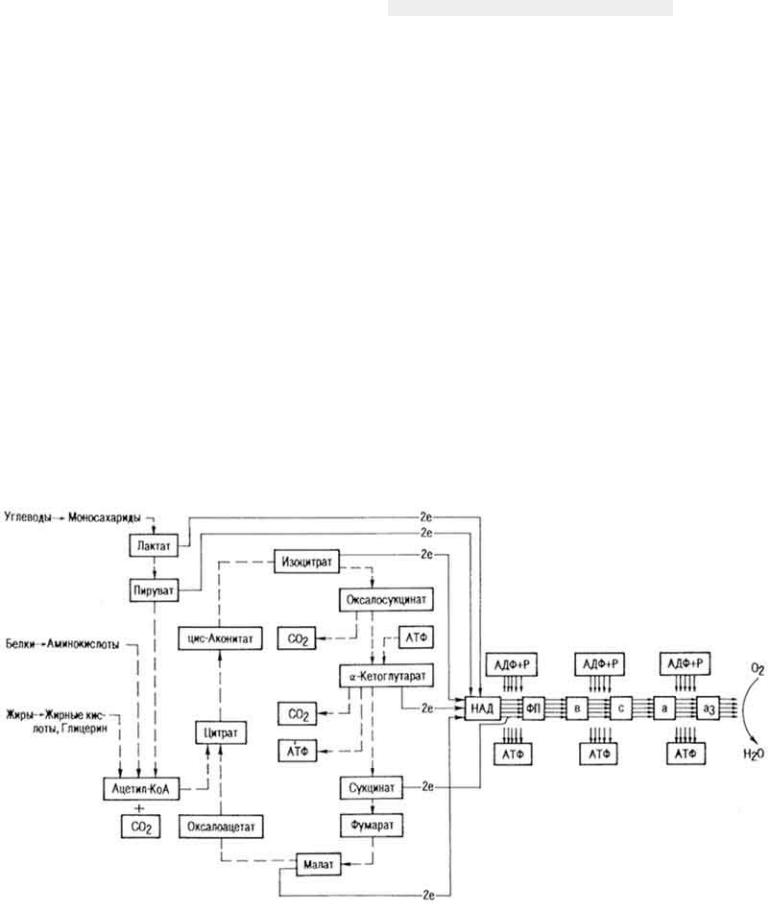
338 :: 339 :: 340 :: 341 :: 342 :: Содержание
Современная теория тканевого дыхания
Тканевое дыхание - основа биологического окисления и представляет собой совокупность окислительно-восстановительных реакций, связанных с потреблением организмом кислорода, освобождением химической энергии, выделением углекислого газа и воды. Часть окислительных реакций в организме не сопровождается накоплением энергии и не входит в комплекс тканевого дыхания. Эти реакции осуществляют превращения некоторых веществ (например, окисление при образовании стероидных гормонов, желчных кислот и т. д.).
При тканевом дыхании одно из веществ окисляется, другое - восстанавливается. Окисляемым веществом, или субстратом, считают то вещество, которое в ходе химических реакций теряет протоны и электроны или присоединяет кислород. Вещество, которое присоединяет протоны и электроны или теряет кислород, считается восстановленным. Протоны и электроны называют восстанавливающими эквивалентами. Они переносятся от одного соединения - донора - к другому - акцептору. У аэробов конечным акцептором восстанавливающих эквивалентов является кислород.
338
Рис. 43. Схема клеточного дыхания (по А. Ленинджеру)
339
Субстратами клеточного дыхания служат продукты расщепления основных питательных веществ и кислород.
Биологические субстраты в тканях окисляются двумя путями: анаэробным и аэробным. Так, анаэробный гликогенолиз или гликолиз приводит к образованию пировиноградной и молочной кислот, которые в дальнейшем подвергаются аэробным превращениям. Молочная кислота окисляется до пировиноградной, которая взаимодействует с KoA, образуя ацетил-КоА. Ацетил-КоА включается в аэробный путь получения клеткой энергии, причем источником ацетил-КоА могут быть и другие вещества.
При анаэробном и аэробном окислении свободная энергия окислительновосстановительных реакций аккумулируется в виде АТФ. Протоны и электроны в ходе этих реакций переносятся специальными ферментами на отдельные звенья дыхательной цепи, где и аккумулируется энергия. Гиалоплазма клетки содержит ферменты гликолиза и гликогенолиза, здесь и происходит анаэробное окисление субстратов. В матриксе митохондрий сконцентрированы ферменты цикла трикарбоновых кислот и окисления жирных кислот.
Тканевое дыхание осуществляется дыхательной цепью поэтапно. Прежде всего, под влиянием соответствующих дегидрогеназ дегидрируются отдельные субстраты. В частности, молочная кислота дегидрируется ЛДГ и превращается в пировиноградную, яблочная - дегидрируется МДГ и превращается в щавелевоуксусную и т. д. Молекула дегидрогеназы состоит из простого белка и кофермента - НАД и НАДФ. Кофермент способен взаимодействовать с отщепленным атомом водорода, восстанавливаться и передавать его на другие акцепторы.
После этой реакции специфичность субстрата теряет свое значение, так как отщепленные атомы водорода (протон и электрон) для всех веществ одинаковы. Затем атомы водорода переносятся на молекулу
340
флавинового фермента (ФФ), содержащую ФМН или ФАД. Они окисляют восстановленные формы НАД и НАДФ и переносят атомы водорода на следующее звено. Некоторые ФФ (например, СДГ) могут отщеплять атомы водорода прямо от субстрата и переносить его на убихинон. Атомы водорода, отщепленные от восстановленных НАД и НАДФ или прямо от субстрата, присоединяются к изоаллоксазиновому кольцу простетической группы ФФ.
Следующим звеном дыхательной цепи является убихинон, который, присоединяя отщепленный атом водорода, восстанавливается и окисляет флавиновые ферменты:

ФФ∙Н2+Убихинон→Убихинон∙Η2+ΦΦ.
Далее протоны переходят в окружающую среду, а электроны поступают в цитохромную систему.
Цитохромная система (см. с. 339) принимает электроны последовательно на цитохромы b, с, a и а3 (ЦХО). Во время переноса электронов поочередно
происходит восстановление (Fe3+ → Fe2+) и окисление (Fe2+ → Fe3+) цитохромов вплоть до ЦХО. ЦХО передает электроны молекулярному кислороду, активируя его. Кислород взаимодействует с ионами водорода, которые находятся в среде, образуя воду. В процессе клеточного дыхания кроме воды образуется углекислый газ и выделяется химическая энергия. Углекислый газ может расходоваться на карбоксилирование, в частности на образование щавелевоуксусной кислоты. Химическая энергия аккумулируется в виде АТФ.
В дыхательной цепи создается своеобразный электронный каскад. Его образно можно представить в виде ряда водопадов. Каждый водопад в этом каскаде "вращает турбину ферментативной реакции". При этом в разных участках каскада образуется неодинаковое количество энергии. Оно выражается редокс-потенциалом. Величина редокс-потенциала показывает направление переноса электронов в дыхательной цепи. В дыхательной цепи происходит постепенное увеличение редокс-потенциала от начального звена до конечного (табл. 7). Существуют и другие пути клеточного дыхания. Примером краткого пути может быть окисление янтарной кислоты в фумаровую. Еще пример. L- и
341
7. Величина нормальных редокс-потенциалов E0 в дыхательной цепи, В (рН 7, Т=38° С)
|
|
|
|
|
|
|
|
|
|
|
|
Биологическая система |
|
E0 |
|
|
|
|
|
|
|
||
|
Субстраты |
|
2Н+ + 2е |
|
От 0 до -0,62 |
|
|
|
|
|
|
|
|
|
|
|
НАД ∙ H2 |
|
|
НАД + 2H+ 2е |
|
-0,32 |
|
|
|
|
|
|
|
|
|
|
ФФ ∙ H |
|
|
ФФ + 2H+ + 2е |
|
От -0,06 до -0,1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Цитохром b |
|
Цитохром b+е |
|
-0,04 |
|
|
|
|
|
|
|
|
||
|
Цитохром с |
|
Цитохром с+е |
|
+0,26 |
|
|
|
|
|
|
|
|
||
|
Цитохром а |
|
Цитохром a+е |
|
+0,29 |
|
|
|
|
|
|
|
|||
|
ЦХО |
ЦХО |
|
+0,50 |
|
||
|
|
|
|
|
|
|
|
|
H O |
1/ |
2 |
O + 2H+ + 2e |
|
+0,815 |
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
П р и м е ч а н и е . Величина редокс-потенциала выражена через э.д.с.Е0.
D-Аминокислоты, ксантин и гипоксантин дегидрируются ФФ, после чего водород прямо переносится на молекулярный кислород, минуя систему

цитохромов. Эти пути составляют 5-7% общего баланса клеточного дыхания. При этом образуется пероксид водорода, который обезвреживается каталазой: 2H2O2 → 2H2O + O2.
Примером длинного пути клеточного дыхания может быть окислительное декарбоксилирование α-кетокислот (см. с. 196). При этом отщепленные от каждой молекулы кетокислоты два атома водорода вначале переносятся на липоевую кислоту, затем на НАД и HАДΦ дегидрогеназ. Дальше окисление идет обычным путем.
342
338 :: 339 :: 340 :: 341 :: 342 :: Содержание

342 :: 343 :: 344 :: 345 :: 346 :: 347 :: 348 :: 349 :: Содержание
Окислительное фосфорилирование
Свыше 50% освобожденной при биологическом окислении энергии резервируется тканями в виде макроэргических соединений, главным образом АТФ. Около 50% энергии рассеивается в виде тепла. Биосинтез АТФ осуществляется из АДФ и активированного неорганического фосфата. Источником энергии для активирования в основном является энергия биологического окисления. Различные звенья дыхательной цепи обладают неодинаковым запасом энергии. Образование АТФ за счет энергии биологического окисления называется окислительным фосфорилированием. Оно сопряжено с функционированием отдельных звеньев дыхательной цепи.
342
Окислительное фосфорилирование открыто В. А. Энгельгардтом в 1930 г. Из нескольких сот окислительных реакций, протекающих в организме, лишь около десятка сопряжено с активированием неорганического фосфата. При фосфорилировании возникает макроэргическая связь, богатая энергией. По предложению Ф. Липмана (1946) эта связь обозначается символом тильда ~.
В. А. Энгельгардт (1894-1984)
П р и субстратном фосфорилировании субстрат соединяется непосредственно с активированным фосфатом, что приводит к образованию между ними макроэргической связи. Примером могут быть промежуточные продукты анаэробного расщепления углеводов - 1,3-дифосфоглицериновая и 2- фосфопировиноградная кислоты и многие другие соединения. В дальнейшем под влиянием фосфофераз макроэргический фосфат переносится на АДФ, образуется АТФ и субстрат восстанавливается. Доля субстратного фосфорилирования в получении организмом АТФ невелика.
Митохондрии - "силовые станции" клетки. Ферменты клеточного дыхания и сопряженного с ним окислительного фосфорилирования сосредоточены в основном в митохондриях (рис. 44 и 45). Митохондрии - важнейшие органоиды клетки, вырабатывающие энергию в результате окисления различных веществ: белков, углеводов, липидов и их производных. Размеры митохондрий составляют 0,5-7 мкм. Количество их в клетке колеблется от 50 до 5000. Они локализированы в цитоплазме и находятся в постоянном движении.
Митохондрия имеет наружную и внутреннюю мембраны толщиной около 6 нм, расстояние между ними 3-6 нм.
343
Рис. 44. Строение митохондрии
От внутренней мембраны в полость митохондрии отходят отростки - кристы, или гребни. Полость заполнена плотным материалом, или матриксом. Белки составляют 65-70% сухого вещества митохондрий, липиды - 25-30, РНК - 0,5%. Около половины этих белков - ферменты дыхательной цепи, окислительного фосфорилирования и др. Они концентрируются в виде
Рис. 45. Митохондрии нервного волокна курицы: а - наружная мембрана; б - внутренняя мембрана; в - кристы (электронная микроскопия, x 10000)
344
компактных агрегатов с молекулярной массой около 1 млн. Каждый такой агрегат содержит набор ферментов. В состав каждой частицы ферментов, размещенных на внутренней мембране, входит набор ферментов дыхательной цепи, молекулы которых расположены в определенном порядке, обеспечивающем передачу электронов от одного фермента к другому и, наконец, к кислороду.
Теории окислительного фосфорилирования. Существует несколько теорий, объясняющих сущность окислительного фосфорилирования. Согласно химической теории (Ю. Ф. Липман, 1946), сопряжение окисления и фосфорилирования обеспечивается посредством специальных переносчиков. Роль переносчиков выполняют НАД, убихиноны, витамины E и К, карнозин, адениловая часть молекулы АДФ, имидазольные радикалы аминокислот и др. Вначале переносчик А восстанавливается:
A+H2=AH2.
В дальнейшем восстановленный переносчик взаимодействует с другими переносчиками - В и X, что приводит к окислению первого переносчика и возникновению макроэргической связи между вторым и третьим переносчиками:
AH2+B+X=A+BH2~X.
Последнее соединение вступает в реакцию с посредником У:
BH22X+Y=BH2+X~Y.
Макроэргическое соединение X~У взаимодействует с неорганическим фосфатом:
Х~У+ФН=У~ФН+Х.
Активированный фосфат переносится в виде макроэргической связи на АДФ:
У~ФН+АДФ=У+АТФ.
345
Сторонники хемиосмотической теории (П. Митчелл, 1961) считают, что процессы клеточного дыхания и фосфорилирования сопрягаются на внешних мембранах митохондрий. Здесь химическая энергия окисления превращается в энергию электрохимических потенциалов. При окислении донора AH2 возникают протоны и электроны. Протоны остаются на поверхности мембраны, а электроны перемещаются к внутренней мембране, к акцептору (например, к O2). Внешняя мембрана заряжается положительно, внутренняя - отрицательно, и
акцептор восстанавливается. Если акцептором является кислород, то он взаимодействует с ионами водорода внутренней среды, образуя воду. Между внешней и внутренней мембранами возникает электрическое поле, которое обусловливает возникновение макроэргического посредника X~У. Его макроэргическая связь передается на АДФ (см. выше).
Энергетический эффект биологического окисления. Источниками образования макроэргических соединений являются продукты углеводного, липидного и белкового происхождения (см. рис. 43). Пути их превращения энергетически неравноценны. Так, в расчете на одну молекулу глюкозы гликолиз дает две молекулы АТФ, а фосфорилирование в дыхательной цепи после прохождения в цикле трикарбоновых кислот - до 36 молекул АТФ. Окисление жирных кислот поставляет свыше половины энергии для тканей печени, почек, миокарда, скелетных мышц. Образование энергии за счет пентозного пути в значительной степени происходит в печени, несколько меньше - в тканях миокарда и скелетных мышцах.
Высвобождаемая энергия концентрируется в пунктах энергетического сопряжения. Первая молекула АТФ синтезируется при переносе электронов от НАД · H + H+ к флавопротеиду, а вторая - при переносе электронов от восстановленной формы цитохрома b к цитохрому с. Третья молекула АТФ образуется при переносе пары электронов от цитохрома а к кислороду. Именно здесь между каждыми двумя звеньями дыхательной цепи существует наибольшая разница величин редокс-потенциалов.
Эффективность окислительного фосфорилирования оценивается по коэффициенту Р/O, который представляет собой отношение количества фосфата, связанного
346
при фосфорилировании АДΦ, к поглощенному количеству кислорода. Так, при окислении молекулы субстрата через восстановление НАД образуются три молекулы АТФ, Р/O = 3. При окислениях молекулы янтарной кислоты (СДГ переносит электроны прямо на систему цитохромов) Р/O = 2, а при окислении α- кетоглутаровой кислоты Р/O = 4 и т. д.
Интенсивность окислительного фосфорилирования зависит от соотношения в клетках АТФ, АД Φ и Фр. Последние два вещества активируют окислительное фосфорилирование, первое - подавляет. На течение этих реакций влияют и другие факторы. В частности, окислительное фосфорилирование разобщается с клеточным дыханием при низких температурах, что способствует выживаемости организма за счет повышенной выработки тепла. Окислительное фосфорилирование подавляется многими реагентами - динитрофенолом, грамицидином и др. (В. И. Тертышник, 1979).
В тканях кроме окисления, сопряженного с фосфорилированием, происходит дыхание без фосфорилирования. Его называют свободным или
нефосфорилирующим, тканевым дыханием. В данном случае функционирует только дыхательная цепь. Возникает тепловая энергия, необходимая для поддержания нормальной температуры и полноценного протекания многих реакций обмена веществ. С. E. Северин (1969) установил, что при охлаждении животного дыхание тканей, сопряженное с фосфорилированием, угнетается, а свободное дыхание возрастает. При нормализации внешней температуры происходит обратное явление. Гормон инсулин процессы сопряжения стимулирует, тироксин - ослабляет.
Питательные вещества (углеводы, липиды, белки) представляют собой форму долговременного хранения поглощенной в результате фотосинтеза растениями энергии Солнца. Так, при образовании 1 моля глюкозы (6CO2 + 6H2O → C6H12O6 + 6O2) аккумулируется 2881 кДж. В ходе расщепления в тканях до CO2 и H2O из одной молекулы глюкозы образуется 38 молекул АТФ. Две молекулы АТФ возникают в процессе анаэробного распада глюкозы до двух молекул молочной кислоты. Каждая молекула молочной кислоты при окислении передает в дыхательную цепь 6 пар электронов. Каждая пара электронов, прошедшая через звенья дыхательной
347
цепи, вызывает превращение трех молекул АДФ и АТФ. Таким образом, в ходе собственно тканевого дыхания из одной молекулы глюкозы образуется 36 молекул АТФ. При образовании 1 моля АТФ связывается около 42 кДж, при синтезе 38 - 1590 кДж. Эффективность сопряжения процессов гликолиза и дыхания с окислительным фосфорилированием в среднем составляет 55%.
Значение бурой жировой ткани в биоэнергетике организма. Бурая жировая ткань играет важную роль в адаптации организма, особенно новорожденного, к пониженным температурам внешней среды. В период акклиматизации организма к холоду митохондрии адипоцитов часто окружены капельками жира. Понижение температуры тела сопровождается интенсивным выделением симпатическими нервными окончаниями медиаторов (адреналина и норадреналина), которые воздействуют на рецепторы наружной плазматической мембраны адипоцитов; активируется аденилатциклаза и образуется цАМФ. цАМФ активирует триглицеридлипазу, под влиянием которой триглицериды расщепляются до глицерина и высших жирных кислот. Образуется ацетил-КоА. Он соединяется с карнитином, после чего под влиянием карнитинацетилтрансферазы мигрирует внутрь митохондрий, где и включается в реакции клеточного дыхания (см. рис. 43). В адипоцитах сопряжение клеточного дыхания и окислительного фосфорилирования происходит лишь в первом звене дыхательной цепи. Во втором и третьем звеньях эта связь разобщена и функционирует только дыхательная цепь. Энергия образовавшихся электронов рассеивается в виде тепла. Тепло, возникающее в результате метаболизма бурой жировой ткани, имеет для млекопитающих большое значение, являясь важнейшим приспособлением организма животного для поддержания и восстановления постоянной температуры тела (В. Г. Янович, 1983).

Основные макроэргические соединения. К макроэргическим соединениям относятся нуклеозидтри- и нуклеозиддифосфаты, пиро- и полифосфорная кислоты, креатинфосфат, фосфопировиноградная и дифосфоглицериновая кислоты, ацетил- и сукцинил-КоА, аминоацильные производные адениловой и рибонуклеиновых кислот и др. Эти соединения характеризуются большой отрицательной величиной свободной энергии гидролиза. Так, стандартная свободная энергия
348
гидролиза фосфоенолпирувата составляет (-51,9) кДж, 1,3-дифосфоглицерата - (-49,4), креатинфосфата - (-43,1), ацилфосфата - (-42,4), аргининфосфата -(32,2), АТФ - (-30,6), ацетил-КоА - (-32,6), глюкозо-1-фосфата- (-20,9). Богатые энергией соединения, в которых ∆G° выше -30,6 кДж, в ферментативных реакциях могут передавать фосфатные группы АДФ с образованием АТФ. Следовательно, эти вещества являются своеобразными аккумуляторами энергии.
Контрольные вопросы
1.Объясните образование химической энергии в отдельных звеньях дыхательной цепи на основе современной теории клеточного дыхания.
2.Что такое окислительное фосфорилирование и свободное дыхание? Каково их значение для животного организма?
3.Сколько молекул АТФ образуется в дыхательной цепи при окислении одной молекулы глюкозы? Приведите химизм реакций и расчеты.
4.Приведите формулы отдельных макроэргических соединений.
349
342 :: 343 :: 344 :: 345 :: 346 :: 347 :: 348 :: 349 :: Содержание

349 :: 350 :: 351 :: 352 :: Содержание
ГЛАВА 11
ГОРМОНЫ
Общая характеристика гормонов
Гормоны (от греч. hormao - привожу в движение, побуждаю) - биологически активные вещества, которые вырабатываются железами внутренней секреции и выделяются непосредственно в кровь, лимфу или ликвор. Наука о железах внутренней секреции - эндокринология.
По химической природе гормоны являются белками (инсулин), пептидами (окситоцин), стероидами (андростерон), производными аминокислот (тироксин), фенолами (адреналин). Гормоны обладают высокой биологической активностью в дозах 10-3 и даже 10-6 мг. В организме животного за сутки синтезируется несколько миллиграммов или долей миллиграммов отдельных гормонов. Концентрация их измеряется долями грамма (10-6-10-9 на 100 мл крови. Гормоны оказывают кратковременное действие и быстро разрушаются. Обычно они не обладают видовой специфичностью. Так,
349
гормон, полученный из железы внутренней секреции любого позвоночного, оказывает сходное физиологическое действие.
Для большинства гормонов расшифровано строение их молекул. Многие получены в чистом виде (например, инсулин, фолликулин). Часть синтезирована (например, адреналин, инсулин, кортизон и др.). Для некоторых получены синтетические аналоги (например, синэстрол). В тканях выделены гормоноиды, или парагормоны, - вещества, обладающие гормональной активностью, такие как секретин, панкреозин, гепарин, гастрин и др.
Деятельность желез внутренней секреции контролируется нервной системой (схема H. А. Юдаева).
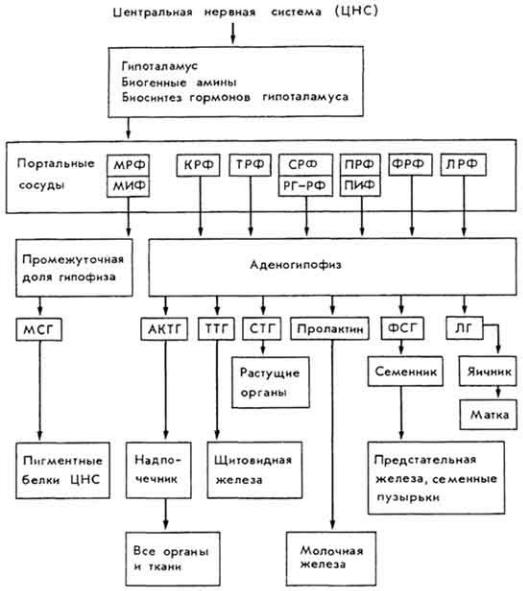
350
В свою очередь, железы внутренней секреции влияют на деятельность нервной системы, в том числе и коры больших полушарий.
Гормоны оказывают разностороннее действие на многие реакции обмена веществ - нуклеиновых кислот, белков, углеводов, липидов, минеральных соединений.
По характеру действия гормоны делятся на пусковые и гормоныисполнители. К пусковым относятся нейрогормоны гипоталамуса. Именно они стимулируют деятельность соответствующих желез внутренней секреции. Гормоны-исполнители оказывают действие на основные реакции обмена веществ организма, обеспечивающие его рост, развитие, продуктивность, адаптацию, размножение, разнообразную функциональную деятельность и др.
По механизму действия гормоны делят на два основные типа. Первый - это белковые и пептидные гормоны (рис. 46), катехоламины и гормоноиды. Их молекула, подойдя к клетке-мишени, соединяется с молекулами белковых рецепторов наружной плазматической мембраны, затем с помощью медиаторов
(цАМФ, цГМФ, простагландинов, Ca2+) оказывает влияние на ферментные системы клетки-мишени и на обмен веществ в ней (цвет. табл. V). К гормонам второго типа относят стероидные и часть тиреоидных гормонов. Их молекула легко проникает в глубь клетки-мишени через поры мембран, взаимодействует с молекулами гликопротеидных рецепторов, локализированных в цитозоле, митохондриях и на ядерной мембране, оказывая воздействие на весь клеточный метаболизм, и в первую очередь процессы транскрипции (см. рис. 47).
В клинике часто встречаются гормональные нарушения -гипо- и гиперфункции желез внутренней секреции.
Гормоны в организме находятся в связанном и свободном состояниях. Между действием различных гормонов существует взаимосвязь. Так, отдельные гормоны по действию могут быть синергистами (соматотропин и тироксин) или антагонистами (инсулин и глюкагон). Известно около 100 гормонов и гормоноидов, которые классифицируют по строению, функциям и месту образования. В учебнике принята классификация по месту образования как наиболее распространенная.
351
Рис. 46. Механизм действия
гормонов пептидной природы на клетку-мишень (по Ю. Б. Филипповичу, 1985): Р - рецептор гормонов; Б - регуляторный белок; А - аденилатциклаза; Г - гормон
352
349 :: 350 :: 351 :: 352 :: Содержание
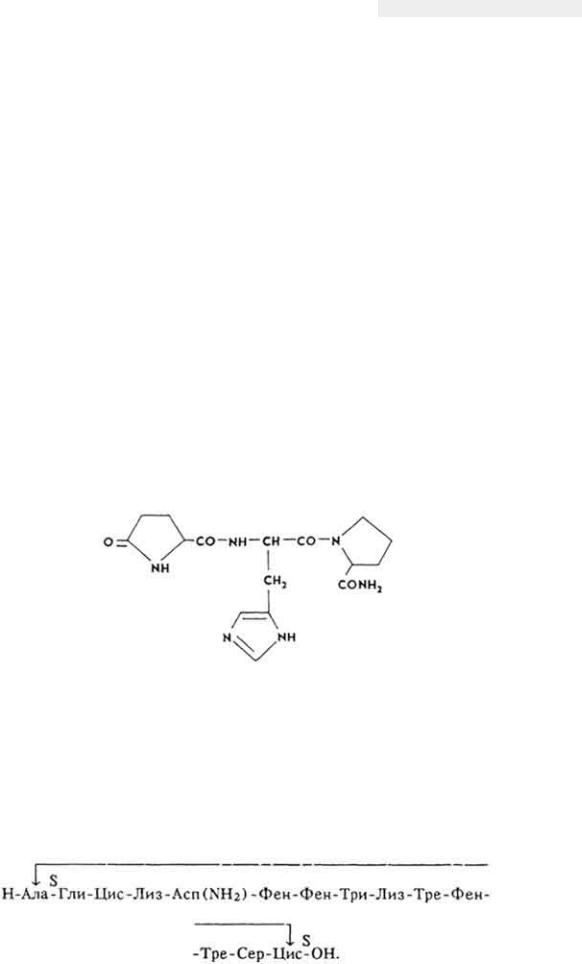
352 :: 353 :: 354 :: Содержание
Гормоны гипоталамуса
Гипоталамус осуществляет связь между центральной нервной системой и железами внутренней секреции. 32 пары ядер гипоталамуса участвуют в регуляции функций и обмена веществ организма. Регуляция осуществляется нейрогуморальным путем. От нервных центров в соответствующие отделы центральной нервной системы идут пучки нервных волокон. В клетках многих нервных центров синтезируются гормоны, которые через кровеносное русло, лимфу и ликвор направляются к клеткам-мишеням соответствующих желез внутренней секреции, и в первую очередь гипофиза (см. схему).
Химическая природа. В ядрах гипоталамуса синтезируется восемь либеринов (рилизинг-факторов) и три
352
статина (рилизинг-ингибирующих факторов). Для пяти из них изучена структура и осуществлен синтез.
Т и р о л и б е р и н (тиротропин-рилизинг-фактор, ТРФ) имеет строение Пироглу-Гис-Про-КН2.
Л ю л и б е р и н (рилизинг-фактор лютеинизирующего гормона, ЛРФ) имеет более сложную структуру:
Пироглу-Гис-Три-Сер-Три-Гли-Лей-Арг-Про-Гли-NН2.
С о м а т о с т а т и н (соматотропин-рилизинг-ингибирующий фактор, РГРФ) имеет следующее строение:
М е л а н о - р и л и з и н г - ф а к т о р (МРФ) является пентапептидом: NН2-Цис-Тир-Иле-Гли-Асп-СООН.

М е л а н о ц и т и н г и б и р у ю щ и й ф а к т о р (МИФ) оказался трипептидом: NН2-Прол-Лей-Гли-NН2.
Биосинтез. Гормоны синтезируют рибосомальным и нерибосомальным путем. Биосинтез регулируется центральной нервной системой и гуморально. Гуморальная регуляция осуществляется гормонами периферических эндокринных желез по принципу обратной связи. Молекулы гормонов накапливаются в синаптосомах, затем поступают в капилляры портальной системы, после чего воздействуют на клетки-мишени.
353
Метаболизм. Для гормонов характерна высокая степень метаболизма. Так, период биологической полужизни молекулы тиролиберина составляет около 4 мин. Инактивируется пептид-гидролазами до аминокислот.
Биологические действия. Мишенью гормонов являются клетки передней и средней долей гипофиза. Предполагают, что молекула соответствующего гормона первоначально в наружной мембране клетки-мишени активирует фермент аденилатциклазу (см. рис. 46). Образуется цДМФ, которая участвует в передаче гормонального сигнала. Затем активируется деятельность цАМФзависимой протеинкиназы, синтезируются молекулы гормона-исполнителя. Активность ферментных систем сопровождается диссоциацией комплекса Са2+- АТФ или Mg2+-АТФ: освобождаются катионы и АТФ. Изменяется порозность мембран. Синтезированные гормоны поступают в кровеносное русло, а из него - в различные органы и ткани.
Патология. Биосинтез гормонов нарушается при многих болезнях, особенно центральной нервной и эндокринной систем.
Применение в животноводстве и ветеринарии. Гона-дотропин-
рилизинг-гормон и его аналоги используют как стимуляторы охоты при разведении и искусственном осеменении животных.
354
352 :: 353 :: 354 :: Содержание

354 :: 355 :: 356 :: 357 :: 358 :: 359 :: 360 :: 361 :: 362 :: 363 :: 364 :: Содержание
Гормоны гипофиза
Гипофиз - важнейшая железа внутренней секреции. Вместе с гипоталамусом образует единую морфофизиологическую систему, регулирующую различные стороны обмена веществ. Состоит из трех долей: передней, средней и задней. В них синтезируется ряд жизненно важных гормонов.
А. Гормоны передней доли гипофиза (аденогипофиза)
Здесь образуется большая группа гормонов.
С о м а т о т р о п и н ( г о р м о н р о с т а , с о м а т о т р о п н ы й г о р м о н , C T Г ) . Открыт в экстракте гипофиза Г. Эвансом и Дж. Лонгом в
1921 г.
354
Химическая природа. Принадлежит к белкам с невысокой молекулярной массой - 21 500-46 000. Молекула состоит из одной полипептидной цепи и содержит два дисульфидных мостика. Активность гормона в значительной мере связана с ε-аминогруппой лизина и остатками тирозина. Концевыми группами соматотропина являются остатки фенилаланина. Гормон обладает свойствами глобулинов, термолабилен, изоэлектрическая точка находится около 6,8, содержит 15,6% азота.
Биосинтез. Синтезируется в ацидофильных клетках из аминокислот, поступающих с током крови.
Биологическое действие. Соматотропин активирует деятельность ДНКполимераз. В клетках возрастает биосинтез иРНК и рРНК. Повышается проницаемость для аминокислот и интенсивность биосинтеза белков, возрастает митотическое деление клеток, усиливаются хондрио- и остеогенез, биосинтез гликогена и мобилизация жиров из жировых депо, отложение кальция и фосфора в костях. В некоторых условиях он стимулирует усвоение тканями моноз, в других - проявляет диабетогенное действие.
Патология. Чрезмерная продукция гормона в раннем возрасте приводит к гигантизму. У людей гигантами называют мужчин, рост которых превышает 200 см, женщин - выше 190 см. Чрезмерное выделение соматотропина у взрослых приводит к заболеванию - акромегалии, когда у больных непропорционально увеличиваются отдельные части тела (стопа, кисть, челюсть, губы, нос). Недостаточная продукция гормона в раннем возрасте приводит к нанизму - низкому росту и малым размерам тела (у человека - рост ниже 120-130 см).
Применение в животноводстве и ветеринарии. Используют как
диабетогенное средство. |
|
Π р о л а к т и н ( л а к т о т р о п н ы й |
г о р м о н , м а м м а т р о п и н , |
л а к т о т р о п и н , П Р Л ). Выделен из |
экстракта гипофиза. Регулирует |
материнский инстинкт, развитие и функционирование молочной железы.
Химическая природа. Относится к белкам с молекулярной массой 23 00024 000, термолабилен, изоэлектрическая точка равна 5,73. В 1969 г. установлена первичная структура пролактина:
355
последовательность аминокислотных остатков в молекуле пролактина овец, а позже - в гормоне крупного рогатого скота.
Биосинтез. Синтезируется из аминокислот в ацидофильных клетках. Образование его регулируется гормоном гипоталамуса пролактолиберином. Гормон выделяется в кровеносную систему и ликвор, затем доставляется к клеткам-мишеням.
Метаболизм. После проявления биологического действия пролактин подвергается обычным превращениям, типичным для промежуточного и конечного обменов белков.
Биологическое действие. Образование пролактина стимулируется актом сосания. Нервные импульсы поступают в центральную нервную систему и гипоталамус. Активируется биосинтез пролактолиберина, под влиянием которого возрастает образование пролактина. С током крови гормон поступает в молочную железу, где его молекулы связываются со специальными рецепторами мембран альвеол. Активируются PHK-синтетазы, протеинкиназы и другие ферменты. Индуцируется синтез казеиногена и других белков, лактозы и липидов. Пролактин участвует в регуляции водно-солевого обмена. Его действие сопряжено с деятельностью эстрогенов и гестагенов. Стимулирует развитие желтого тела.
Патология. При разрушении ацидофильных клеток ослабевает и прекращается выделение гормона.
Применение в животноводстве и ветеринарии. Применяют при пониженной секреции молочной железы в послеродовой период.
Ф о л л и т р о п и н ( ф о л л и к у л о - с т и м у л и р у ю щ и й г о р м о н , Ф С Г ) . Гонадотропный гормон. У самок стимулирует рост и созревание фолликулов яичника, у самцов - развитие сперматогенного эпителия в семенниках и сперматогенез.
Химическая природа. Принадлежит к сложным белкам - гликопротеидам с молекулярной массой до 67 000, изоэлектрическая точка находится около 4,5. Молекула фоллитропина содержит азот, серу, глюкозу и глюкозамин.
Биосинтез. Синтезируется в базофильных клетках из аминокислот, глюкозы и глюкозамина. Образование его регулируется гипоталамическим фактором - фоллиберином.
356
Метаболизм. Синтезированный гормон поступает в ликвор и кровеносную систему, доставляется к клеткам-мишеням; после проявления биологического действия разрушается.
Биологическое действие. Основные клетки, на которые действует фоллитропин, - клетки фолликулов и сперматогенного эпителия. Интенсивность выделения гормона зависит от фаз полового цикла. Совместно с лютропином стимулирует биосинтез эстрогенов и частично андрогенов. Обладает биохимической и иммунологической специфичностью.
Патология. При разрушении базофильных клеток в результате поражения гипофиза опухолями или различными интоксикациями образование гормона прекращается.
Применение в животноводстве и ветеринарии. Применяют аналог фоллитропина - сывороточный гонадотропин крови жеребых кобыл для стимуляции овуляции, как средство лечения нимфомании у коров и др.
Л ю т р о п и н ( л ю т е и н и з и р у ю щ и й г о р м о н , Л Г.)
Гонадотропный гормон, стимулирует у самок рост фолликулов, их созревание, овуляцию и образование желтого тела.
Химическая природа. Глюкопротеид с молекулярной массой от 40 000 до 100 000. Молекула лютропина содержит тирозин, триптофан и глюкозамин.
Биосинтез. Синтезируется в базофильных клетках из аминокислот и глюкозамина. Образование гормона регулируется гипоталамическим фактором - люлиберином.
Метаболизм. Синтезированный гормон поступает в ликвор и кровеносную систему, доставляется в яичник; после проявления биологического действия разрушается.
Биологическое действие. Проявляется после предварительного влияния на клетки фолликула ФСГ. У кролика наибольший эффект достигается при соотношении ЛГ: ФСГ = 1:100. ЛГ у самок вызывает интенсивный рост фолликулов, стимулирует овуляцию и образование желтого тела; у самцов - развитие интерстициальной ткани семенников и синтез тестостерона.
Патология. При недостаточной секреции гормона возникает непрерывная течка. Происходит патологическое увеличение размеров фолликулов, которые не могут овулировать.

357
Применение в животноводстве и ветеринарии. ЛГ и ФСГ получают из сыворотки жеребых кобыл. Препараты применяют для стимуляции половых функций у инфантильных самок и самцов.
К о р т и к о т р о п и н ( а д р е н о к о р т и к о - т р о п н ы й г о р м о н , А К Т Г ) . Стимулирует деятельность коры надпочечников.
Химическая природа. АКТГ - неразветвленный полипептид, состоящий из 39 аминокислотных остатков с молекулярной массой 4500. Биологическая активность гормона обусловлена 24 аминокислотными остатками с N-концевого участка молекулы. Остальные 15 аминокислотных остатков определяют видовые и иммунологические особенности гормона. Изучено строение АКТГ у быка,
позже - человека, овцы и свиньи.
Биосинтез. Выделяется базофильными клетками передней доли гипофиза в ответ на раздражения, приводящие организм в состояние напряжения. Биосинтез находится под контролем гормона гипоталамуса кортиколиберина.
Метаболизм. Гормон поступает в ликвор и кровеносное русло, затем достигает клеток-мишеней, на которые и оказывает свое влияние. Концентрация АКТГ в крови определяется уровнем в ней гормонов коры надпочечников. При увеличении их содержания выделение АКТГ уменьшается, а при уменьшении - возрастает. После проявления биологического действия АКТГ расщепляется.
Биологическое действие. Стимулирует ранние этапы биосинтеза гормонов коры надпочечников, снижает содержание холестерина в организме и увеличивает его концентрацию в коре. Активирует лиазы, осуществляющие отщепление от молекулы холестерина боковой цепи между 20-м и 22-м атомами углерода, образуя основу ядра для молекул кортикостероидов, а также
358
гидроксилазы, способствуя внедрению кислорода в 17-е положение углерода. Усиливает проникновение глюкозы в клетки коры и реакции пентозного пути, стимулирует ассимиляцию витамина С тканями надпочечников. Пентозный путь дает возможность клеткам получить достаточное количество НАД · H 2 и НАДО ∙ H2, необходимых для биосинтеза молекул гормонов из ядра холестерина и ацетатов. АКТГстимулятор липаз, фосфорилаз и других ферментов. Проявляет жиромобилизирующую и меланоцитактивирующую способность. С
деятельностью АКТГ связана мобилизация защитных сил организма при стрессах, травмах, инфекциях, токсикозах, АКТГ - антагонист соматотропина и пролактина.
Патология. Биосинтез АКТГ нарушается при многих болезнях, связанных с поражением передней доли гипофиза. При этом уменьшается выделение АКТГ и нарушаются реакции обмена веществ, в которых он участвует.
Применение в животноводстве и ветеринарии. Применяют при недостатке коры надпочечников, лечении ревматизма, полиартритов, подагры, экзем, астмы, аллергий и т. д.
Т и р о т р о п и н ( т и р о т р о п н ы й г о р м о н , T T Г.)
Стимулирует развитие и деятельность щитовидной железы. Открыт как вещество экстракта гипофиза, устраняющее атрофическое перерождение щитовидной железы.
Химическая природа. Принадлежит к сложным белкам - гликопротеидам с молекулярной массой 23 000-32 000, хорошо растворяется в воде, изоэлектрическая точка равна 8, инактивируется под влиянием пепсина, трипсина и химотрипсина. Молекула состоит из α- и β-субъединицы. α- Субъединица имеет одинаковое строение не только у разных гормонов (ЛГ и ТТГ), но и у гормонов разных видов животных. Они отличаются лишь структурой углеводных частей молекулы. Специфическая биологическая активность гормона определяется свойствами β-субъединицы. Однако эта активность проявляется только после соединения α- и β-субъединиц.
Биосинтез. При увеличении в крови концентрации тиреоидных гормонов синтез тиротропина тормозится по принципу отрицательной обратной связи: в
359
гипоталамусе уменьшается синтез тиролиберина, в гипофизе - тиротропина, в щитовидной железе - тироксина.
Биологическое действие. Стимулирует рост и развитие эпителия фолликул щитовидной железы, активирует деятельность органоидов, участвующих в биосинтезе ее гормонов. Механизм его влияния состоит из нескольких этапов: вначале гормон активирует образование цАМФ, она, в свою очередь, биосинтез тиреоглобулинов. Тиротропин способствует "захвату" йода клетками фолликул и расщеплению тиреоглобулинов на отдельные гормоны и белковый остаток.
Гормон стимулирует поглощение кислорода клетками щитовидной железы и повышает их проницаемость для моносахаридов, аминокислот и других веществ.
Патология. При заболеваниях передней доли гипофиза замедляется и

прекращается синтез гормона. Наступает торможение и прекращение биосинтеза тиреоидных гормонов. Это приводит к патологическим нарушениям типа микседемы и зоба.
Применение в животноводстве и ветеринарии. Применяют при лечении заболеваний щитовидной железы.
Б. Гормоны средней доли гипофиза
Из гормонов средней доли гипофиза изучен один-меланотропин.
М е л а н о т р о п и н ( м е л а н о ц и т с т и м у л и р у ю щ и й г о р м о н , M C Г ) . Вещество, регулирующее пигментацию кожи у животных.
Химическая природа. Полипептид, состоящий из 13-22 аминокислотных остатков, молекулярная масса около 2 тыс. Получают из щелочных экстрактов гипофизов крупного рогатого скота и свиней. Различают два меланотропина: α и β.
α-Меланотропин обычно состоит из 13 аминокислотных остатков, β- меланотропин - из
360
18. α-Меланотропин имеет одинаковое строение у различных видов животных, а β-меланотропин обладает видовой специфичностью. Так, β-меланотропин лошади и крупного рогатого скота отличается двумя, а свиньи - одной аминокислотой от β-меланотропина обезьян. Гормон свиней более активен, чем крупного рогатого скота.
Молекулы всех меланотропинов имеют общий гептапептид, ответственный за активность гормона: -Мет-Глу-Гис-Фен-Арг-Три-Гли-.
Биосинтез. Биосинтез гормона регулируется меланолиберином и меланостатином. Гормон синтезируется как типичный полипептид.
Метаболизм. Гормон поступает в ликвор и кровеносную систему, разносится по всему организму и оказывает влияние на биосинтез кожного пигмента меланина. После этого молекула гормона разрушается клеточными пептид-гидролазами.
Биологическое действие. Стимулирует деятельность меланофоров: они увеличиваются в размерах, усложняется структура их отростков и ветвление,
под влиянием гормона тирозин превращается в меланин. Меланотропин активирует биосинтез родопсина, способствует адаптации глаза к темноте и повышает остроту зрения.
Патология. Причинами нарушений могут быть различные травмы гипофиза, опухоли, инфекционные болезни, токсикозы.
Применение в животноводстве и ветеринарии. Препарат в виде 5%-ного раствора применяют при лечении гемералопии, пигментной дегенерации сетчатки глаза и миотического хориоретинита.
В. Гормоны задней доли гипофиза (нейрогипофиза)
В задней доле гипофиза синтезируются два гормона - вазопрессин и оцитоцин, подробно изученные и синтезированные Дю Виньо (1932, 1953).
В а з о п р е с с и н |
( а д и у р е т и н , |
а н т и д и у р е т и ч е с к и й |
|
г о р м о н , В П , |
А Д Г ) . Открыт в 1895 |
г. как вещество, повышающее |
|
кровяное давление. |
|
|
|
361
Химическая природа. Относится к циклическим пептидам, состоит из девяти аминокислотных остатков.
Молекулярная масса вазопрессина свиньи - 1056, крупного рогатого скота - около 1 тыс. Хорошо растворяется в воде, дает цветные реакции на тирозин и лизин, изоэлектрическая точка равна 10,85-10,9.
Биосинтез. Синтезируется в нейронах супраоптического ядра гипоталамуса из аминокислот, потом он по аксонам и дендритам перемещается в заднюю долю гипофиза, где и накапливается в питуицитах. Затем гормон поступает непосредственно в кровь. По типу отрицательной обратной связи при избытке вазопрессина его дальнейший синтез тормозится.
Метаболизм. Через кровеносную систему гормон разносится по всему организму. После выполнения своих функций инактивируется пептидгидролазами с образованием аминокислот.
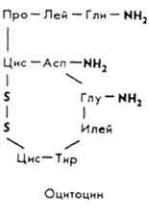
Биологическое действие. Действует на рецепторы кровеносных сосудов: наступает их сужение, повышается кровяное давление, происходит обратное всасывание воды в почечных канальцах, из-за чего его еще называют антидиуретическим. Считают, что гормон активирует гиалуронидазу, которая расщепляет в клетках избыток гиалуроновой кислоты и тем самым повышает проницаемость клеточных мембран. Участвует в поддержании относительного постоянства водно-солевого обмена в организме.
Патология. Нарушения гормональной деятельности связаны с поражением задней доли гипофиза (опухоли, травмы, инфекции, отравления). У больных возникает несахарный диабет. Количество мочи, выделяемой за сутки, возрастает в 5 раз и даже больше.
362
Применение в животноводстве и ветеринарии. Применяют для нормализации кровяного давления и при лечении несахарного диабета.
О ц и т о ц и н ( о к с и т о ц и н , O K C T ). Гормон открыт в 1895 г. в
экстракте гипофиза.
Химическая природа. Представляет собой циклический пептид, состоящий из девяти аминокислотных остатков.
Молекулярная масса гормона 1 тыс. Хорошо растворяется в воде, изоэлектрическая точка равна 7,7. По аминокислотному составу оцитоцин сходен с вазопрессином.
Оцитоцин крупного рогатого скота и свиньи идентичен по аминокислотному составу. Замена в оцитоцине остатка тирозина остатком фенилаланина приводит к потере активности гормона на 95%, изолейцина валином - на 65, изолейцина лейцином - на 100%.
Биосинтез. Синтезируется в клетках паравентрикулярного ядра гипоталамуса, затем перемещается в заднюю долю гипофиза и накапливается в питуицитах, которые подходят близко к капиллярам, и через них гормон поступает в кровь.

Метаболизм. Аналогичен обмену вазопрессина.
Биологическое действие. Повышает тонус гладких мышц, особенно матки. Эти процессы связаны с влиянием гормона на проницаемость мембран мышечных волокон для ионов К+, понижением их мембранного потенциала и увеличением возбудимости. Во время беременности активность гормона ослабляется в результате ферментативного его расщепления. В предродовой период и во время родов она подавляется, возрастают
363
возбудимость мышц матки и их сократимость. После родов чувствительность мышц матки к гормону резко падает. Кроме того, гормон стимулирует активность миоэпителия молочной железы и биосинтез пролактина. Инактивируется прогестероном.
Патология. Причиной пониженной инкреции гормона бывают травмы, опухоли, гибель клеток задней доли гипофиза при некоторых инфекционных, инвазионных и незаразных болезнях.
Применение в животноводстве и ветеринарии. Препарат гормона применяют при гипотонии мышц матки, слабых потугах во время родов, задержании последа, эндометритах и др.
364
354 :: 355 :: 356 :: 357 :: 358 :: 359 :: 360 :: 361 :: 362 :: 363 :: 364 :: Содержание
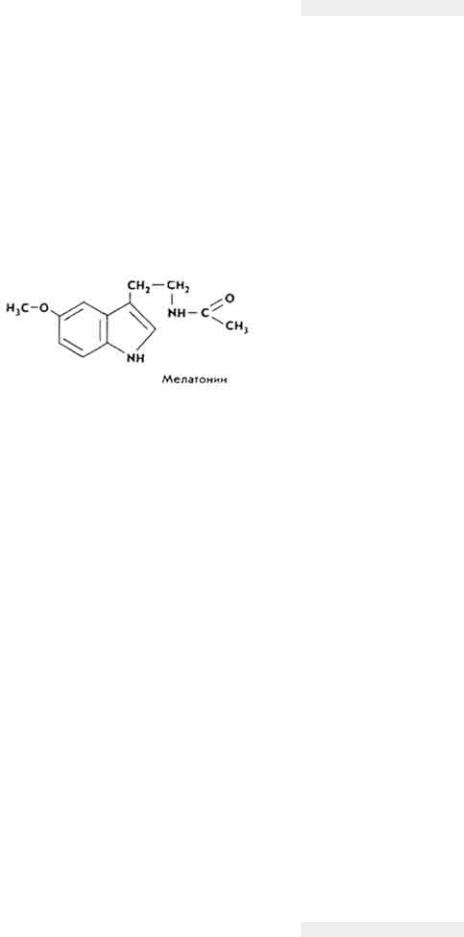
364 :: 365 :: Содержание
Гормоны эпифиза
Основу эпифиза составляют пинеальные и глиальные клетки. Здесь синтезируется несколько гормонов: мелатонин, 8-аргининвазотоцин, гонадотропин-ингибирующие субстанции и некоторые и др.
Мелатонин. Относится к наиболее изученным гормонам эпифиза. Открыт как вещество, влияющее на пигментацию кожи.
Химическая природа. Мелатонин - O-метилпроизводное индола.
Биосинтез. Место образования - пинеальные клетки. Синтезируется из триптофана.
Метаболизм. Гормон поступает в кровеносную систему и разносится по организму. После биологического действия инактивируется ферментами. Продукты распада выделяются с мочой (в виде индикана и др.), потом, калом, выдыхаемым воздухом.
Биологическое действие. Осветляет кожу, влияя на меланофоры. Снижает половую возбудимость, угнетая
364
соответствующие гипоталамические центры, тормозит действие соматотропина, тиротропина и АКТГ.
Патология. Гиперфункция эпифиза угнетает проявление половых признаков. Разрушение эпифиза вызывает преждевременное половое созревание.
Применение в животноводстве и ветеринарии. Применяют при лечении нарушений полового аппарата.
365
364 :: 365 :: Содержание
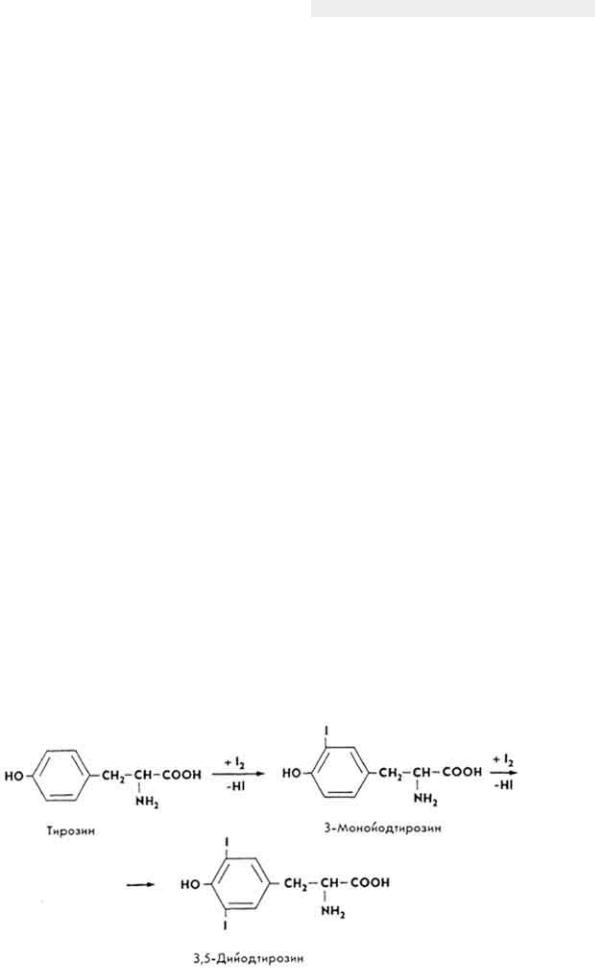
365 :: 366 :: 367 :: 368 :: 369 :: Содержание
Гормоны щитовидной железы
Щитовидная железа - важнейший орган внутренней секреции. Здесь синтеризуются тиреоидные гормоны и кальцитонин.
Т и р е о и д н ы е г о р м о н ы
Химическая природа. Гормоны существуют в трех формах: тиреоглобулин (основная форма), тироксин (циркулирует в биологических жидкостях) и 3,5,3'- трийодтиронин (находится в комплексе с белками плазмы).
Тиреоглобулин представляет собой гликопротеид. Его молекула состоит из четырех субъединиц одинаковой молекулярной массы 650-700 тыс. В молекуле тиреоглобулина содержится 0,5-1% йода и 8-10% углеводов.
В одних случаях полисахаридный фрагмент представлен остатками галактозы, маннозы и N-ацетилглюкозамина, в других - маннозы и N- ацетилглюкозамина. Полисахаридные фрагменты присоединяются к белковой части по амидной группе аспарагина. Связанный тироксин находится в состоянии динамического равновесия со свободным.
Биосинтез. Синтез гормонов регулируется тиролиберином и тиротропином по принципу обратной отрицательной связи, так как повышение в крови концентрации тироксина тормозит биосинтез этих гормонов, а уменьшение - стимулирует. Белковая и углеводная части тиреоглобулина образуются в рибосомальной фракции эпителия фолликул. Затем происходит йодирование аминокислотных остатков тирозина (иногда и фенилаланина). Источником йода служат йодиды. Йодирование происходит в несколько стадий (для простоты изложения взята аминокислота тирозин).
365
Молекула тироксина образуется в результате окислительного конденсирования двух молекул 3,5-дийодтирозина.
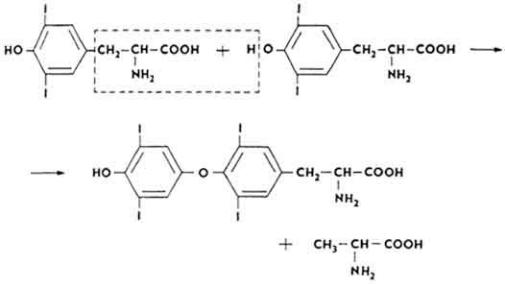
При неполном йодировании образуется 3,5',3'-трийодтиронин.
Метаболизм. Гормоны поступают в кровь. Этот процесс контролируется тиротропином. В крови йодсодержащие гормоны связываются с белками плазмы и циркулируют в организме. В крови содержится тироксина в 7 раз больше, чем 3,5',3'-трийодтиронина. При контакте с клетками-мишенями белки, с которыми связаны гормоны, расщепляются и гормоны выделяются в межклеточную жидкость. В клетках основная масса гормонов сконцентрирована в гиалоплазме, меньше их в митохондриях и рибосомах. Во время миграции гормонов в клетки происходит их дезаминирование и
366
декарбоксилирование с образованием йодированных тиреоуксусной и тиреопировиноградной кислот. Часть гормонов инактивируется отщеплением йода, разрывом бициклов и образованием эфиров с глюкуроновой кислотой. Инактивация гормонов происходит главным образом в тканях печени. Эфиры тироксина выделяются с калом и мочой. Часть йода вновь вовлекается в синтез щитовидной железой, избыток его выделяется с мочой, желчью, иногда с потом, слюной и выдыхаемым воздухом.
Биологическое действие. Чрезвычайно сильно влияют на общий обмен веществ в организме, усиливают реакции биологического окисления, активируют обмен нуклеиновых кислот, белков, липидов, углеводов, минеральных соединений, ускоряют процессы роста и развития организма. Усиливают моторику рубца, образование и всасывание летучих жирных кислот. Тироксин способствует восстановлению дисульфидных групп тиоловых ферментов в сульфгидрильные. Под его влиянием возрастает активность гексокиназы, СДГ, катепсинов, ферментов, участвующих в окислительном фосфорилировании, что обеспечивает адаптацию организма к низким температурам путем разобщения реакций клеточного дыхания и окислительного фосфорилирования.
Патология. В клинике встречаются симптомы гипо- и гипертиреоза.
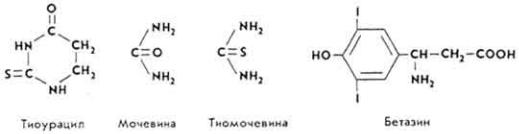
Гипофункция щитовидной железы или ее атрофия у молодых животных приводит к кретинизму и нарушению пропорциональности тела. У взрослых животных возникает микседема. При этом развивается отечность кожи, происходит задержка воды в тканях, уменьшается основной обмен, наступает общая вялость, патологическое ожирение и преждевременное старение. Если гипофункция возникает при недостатке йода в кормах и воде, то развивается эндемический зоб; щитовидная железа увеличивается в размерах, у молодых животных задерживаются рост и развитие, у взрослых - резко падает уровень основного обмена, нарушается половой цикл, уменьшается продуктивность, изменяется экстерьер, плохо формируются вторичные половые признаки, наступают аборты.
Гиперфункция проявляется в виде базедовой болезни - диффузного токсического зоба. Причины могут быть разные: хронические интоксикации, инфекционные болезни, сильные перегревания и др. Под влиянием
367
гормонов увеличивается проницаемость мембран клеток, особенно митохондрий. Часть субстратов цикла Кребса выходит в гиалоплазму, где происходит усиленное образование тепла и тормозится синтез АТФ. У животных наступает быстрая утомляемость, ухудшается аппетит, снижается уровень продуктивности, появляется понос, пучеглазие и др. Нарушаются все виды обмена веществ. Развиваются явления токсикоза.
Применение в животноводстве и ветеринарии. Для профилактики и лечения эндемического зоба в рацион животных вводится йодированная поваренная соль (25 г KI на 1 т соли). Для лечения зоба применяют препарат железы боенского происхождения - тиреоидин. При гипертиреозе применяют антагонисты гормонов. В некоторых случаях для лечения гиперфункциональных нарушений применяют 131I. Для увеличения привесов при откорме крупного рогатого скота животным внутримышечно вводят естественные и синтетические аналоги тиреоидных гормонов - 3,5-дийодтирозин, бетазин и др. (A. M. Журбенко, 1985).
К а л ь ц и т о н и н ( т и р е о к а л ь ц и т о н и н ). Гормон |
открыт |
в |
|
1963 г. в тканях щитовидной железы, обладает |
способностью |
понижать |
|
содержание кальция в крови, что отражено во |
втором его названии |
- |
|
тиреокальцитонин. |
|
|
|
Химическая природа. Относится к полипептидам, состоит из 32 остатков

аминокислот:
368
Биосинтез. У рыб, амфибий, рептилий и птиц гормон синтезируется не в щитовидной железе, а в клетках ультимобранхиальных телец, развивающихся из последних бранхиальных дуг; у млекопитающих - в С-клетках интерфолликулярных островков щитовидной железы обычным для пептидов путем.
Метаболизм. Синтезированный гормон поступает в кровеносное русло, вступает в контакт с α-глобулинами и с током крови доставляется в костную ткань. Может проникать в ликвор. После проявления биологического действия инактивируется ферментами.
Биологическое действие. Гормон способствует переходу кальция из крови в костную ткань, поддерживает постоянный уровень в крови кальция и фосфора, активирует деятельность щелочной фосфатазы, усиливает выделение фосфатов с мочой. Является антагонистом паратгормона.
Патология. При опухолях и других заболеваниях, связанных с атрофией щитовидной железы, синтез гормона замедляется и прекращается. Развиваются патологические явления, связанные с нарушением его функций.
Применение в животноводстве и ветеринарии. Гормональный препарат применяют при лечении заболеваний костной системы и зубов (парадонтоза).
369
365 :: 366 :: 367 :: 368 :: 369 :: Содержание

369 :: 370 :: Содержание
Гормон паращитовидной железы
Здесь синтезируется паратгормон (паратин) - один из основных регуляторов обмена кальция и фосфора в организме животных.
Химическая природа. Паратгормон - полипептид, состоит из 75-80 аминокислотных остатков с молекулярной массой 8500, растворяется в воде, изоэлектрическая точка равна 4,8-6.
Биосинтез. Гормон синтезируется в главных клетках паращитовидной железы, функционирующих циклично. В неактивном состоянии они имеют крупные размеры, богаты гликогеном, содержат мало гранул гормона. В активном состоянии уменьшаются в размерах, у них увеличиваются канальцы комплекса Гольджи,
369
исчезают запасы гликогена, возрастает число гранул гормона.
Метаболизм. Синтезированные гормоны поступают в кровеносное русло, разносятся по всему организму и таким образом оказывают свое биологическое действие на реакции обмена веществ. После этого гормон инактивируется пептид-гидролазами.
Биологическое действие. Паратгормон повышает содержание кальция и понижает количество фосфора в крови, обеспечивает всасывание кальция в кишках, влияет на концентрацию кальция во внеклеточной жидкости, свертывание крови, процесс возбудимости клеток, проницаемость клеточных мембран, мышечную, нервную и сосудистую системы. Между паратгормоном и витамином D существует связь: с увеличением содержания витамина в кормах повышается всасывание кальция и фосфора, а также восстанавливается равновесие содержания их ионов в организме. Паратгормон - антагонист кальцитонина по отношению к кальцию и синергист по отношению к фосфору.
Патология. В клинике встречаются два вида нарушений, связанные с гипер- и гипофункцией железы: гипер- и гипопаратиреоз. В первом случае происходит деминерализация костной ткани и возникают спонтанные переломы, тормозится деятельность изоцитратдегидрогеназы, в костях повышается содержание лимонной кислоты, ингибируется щелочная фосфатаза, возрастает образование цитрата кальция, который легко диффундирует в кровь. Наблюдаются фосфатная гиперкальциурия, атония пищевого канала, запоры. При гипофункции железы уменьшается содержание кальция в крови и увеличивается содержание фосфора. Появляются тетанические судороги, гипокальциурия, рвота, спазмы пищевого канала, задержка развития зубов у молодняка.

Применение в животноводстве и ветеринарии. При гипопаратиреозе применяют паратгормон, получаемый из экстракта паращитовидных желез крупного рогатого скота. При гиперпаратиреозе животным вводят кальцитонин, тормозящий выделение кальция из костной ткани.
370
369 :: 370 :: Содержание

371 :: Содержание
Гормон околоушной железы
Околоушная железа - самая крупная или вторая после поджелудочной железы по величине железа. У жвачных секретирует непрерывно. Так, у коровы за сутки образуется 60-80 л секрета.
Околоушная железа вырабатывает гормон паротин.
Химическая природа. Паротин - это полипептид, состоит из 16-17 аминокислотных остатков.
Биосинтез. Гормон синтезируется в клетках железы из аминокислот.
Метаболизм. Гормон поступает в кровеносную систему и с током крови разносится по всему организму. После проявления биологического действия инактивируется пептид-гидролазами.
Биологическое действие. Стимулирует биосинтез белков в хрящевой ткани, участвует в биосинтезе дентина, оссеина и других белков. Гормон вместе с кальцитонином и паратгормоном участвует в регуляции кальциевого и фосфорного обменов.
Патология. При гипофункции железы дегенерируют эластические волокна, уменьшается отложение кальция в костной ткани, замедляется рост резцов.
Применение в животноводстве и ветеринарии. Пока не применяют.
371
371 :: Содержание

371 :: 372 :: 373 :: Содержание
Гормоны вилочковой железы
Вилочковая железа (зобная железа, тимус) - лимфоэпителиальный орган позвоночных животных и человека, расположенный справа и слева от трахеи. Хорошо развита у молодых животных. Участвует в кроветворной функции, продукции лимфоцитов (особенно Т-лимфоцитов), регуляции роста и развития организма, в формировании и проявлении иммунитета. Важнейший орган внутренней секреции.
Химическая природа. В вилочковой железе образуется ряд гормонов, разнообразных по строению и биологическому действию.
Т и м о з и н α1 - термостабильный полипептид, молекулярная масса 3108, изоэлектрическая точка 4,2. Состоит из 28 аминокислотных остатков:
371
Т и м о п о э т и н II-термостабильный полипептид, молекулярная масса 5562, изоэлектрическая точка 5,5. Состоит из 49 аминокислотных остатков.
Биологическая активность тимопоэтина связана с пентапеотидом, размещенным в положении 32-36 (-Арг-Лиз-Лиз-Асп-Тир-).
С ы в о р о т о ч н ы й т и м у с н ы й ф а к т о р (СТФ) - термолабильный нонапептид, молекулярная масса 859, изоэлектрическая точка 7,5. Имеет следующее строение:
Л и м ф о ц и т с т и м у л и р у ю щ и й г о р м о н (ЛСГ) - термостабильный белок, молекулярная масса 80000.
Кроме этих гормонов, из тканей тимуса выделено несколько других гормональных веществ (в частности, тимостерин). Их строение и значение в обмене веществ в настоящее время изучают.
Биосинтез. Почти все гормоны синтезируются из аминокислот. Основой

для образования молекулы тимостерина служат стероиды и аминокислоты.
Метаболизм. Гормоны поступают в кровеносное русло, затем в органы и ткани. После проявления биологического действия инактивируются ферментами. Время биологической полужизни молекул большинства гормонов тимуса - 10-15 мин. В крови они находятся в свободном и связанном (с альбуминами) состояниях.
Биологическое действие. Стимулируют образование лимфоцитов, активируют синтез антител, участвуют в биосинтезе ДНК и РНК, повышают иммунологическую реактивность организма, тормозят выделение
372
тиреотропина и тироксина, задерживают половое созревание, увеличивают число циркулирующих в крови и тканях лимфоцитов. Мишенью гормонов тимуса являются стволовая лимфоидная клетка, претимические предшественники Т-лимфоцитов, собственно лимфоциты вил очковой железы и посттимические предшественники T-лимфоцитов. Специфическое действие гормонов происходит за счет присоединения их молекул к рецепторам на клеточной мембране и активации аденилатциклазной или гуанилатциклазной систем, что, в свою очередь, влияет на деятельность различных ферментных систем, функционирующих в клетках-мишенях. Каждый из выделенных гормонов обладает специфичностью действия. Так, под влиянием ЛСГ увеличивается биосинтез антител у новорожденных. Тимозин стимулирует пролиферацию лимфоидных клеток и синтез в них ДНК.
Патология. При недостатке или отсутствии в организме гормонов возникает иммунодефицитное состояние, при котором резко снижается противоинфекционная защита организма и увеличивается частота злокачественных новообразований. Причинами нарушений могут быть травмы и опухоли, инфекции и хронические интоксикации, хронические стрессы и хроническое недоедание, врожденное отсутствие железы.
Применение в животноводстве и ветеринарии. Введение телятам препаратов тимуса повышает их резистентность к различным болезням (A. M. Никитенко и др., 1980; О. H. Клименко, 1984) за счет образования Т- лимфоцитов, стимулирования развития гуморальных и клеточных реакций иммунитета, а также увеличивает их привесы.
373
371 :: 372 :: 373 :: Содержание

373 :: 374 :: 375 :: 376 :: 377 :: Содержание
Гормоны поджелудочной железы
Поджелудочная железа выполняет секреторные и инкреторные функции. Ее гормонами являются: инсулин, глюкагон, липокаин и ваготонин. Гормоны вырабатываются в основном в клетках островков Лангерганса, которые составляют около 1% всей массы железы.
И н с у л и н . Открытие инсулина связано с выяснением причин сахарного диабета. Гормон открыл Л. В. Соболев в 1902 г. Позже была установлена
373
структура инсулина (Φ. Сенгер, 1954) и осуществлен его синтез (В. Ингрем, 1961).
Химическая природа. Молекула инсулина состоит из мономеров, которые могут между собой ассоциировать, образуя частицы с молекулярной массой 12000-48 000. Каждый мономер состоит из двух цепей, соединенных между собой дисульфидными связями. Цепь А с N-конца заканчивается аминокислотой глицином и содержит 21 аминокислоту. Цепь В с N-концевой аминокислотой фенилаланином состоит из 30 аминокислот.
Инсулины различных животных отличаются между собой остатками аминокислот в положениях 8, 9 и 10 Α-цепи (табл. 8).
8. Отличия в структуре молекул инсулинов
|
|
|
|
|
|
|
|
|
|
Вид животного |
|
Остатки аминокислот Α-цепи в положениях |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
9 |
|
10 |
|
|
|
|
|
|
|
|
|
|
|
Крупный рогатый скот |
|
-Цис-S-Цис-S-Ала |
|
-Сер- |
|
-Вал-Цис-S- |
|
|
|
|
|
|
|
|
|
|
|
Овца |
|
-Цис-S-Цис-S-Ала |
|
-Гли- |
|
-Вал-Цис-S- |
|
|
|
|
|
|
|
|
|
|
|
Свинья |
|
-Цис-S-Цис-S-Тре |
|
-Сер- |
|
-Илей-Цис-S- |
|
|
|
|
|
|
|
|
|
|
|
Лошадь |
|
-Цис-S -Цис-S-Тре |
|
-Гли- |
|
-Илей-Цис-S- |
|
|
|
|
|
|
|
|
|
|
Мономеры инсулина соединяются между собой в ди-, тетра-, гекса- и октамеры атомом цинка через имидазольные остатки гистидина. В молекуле инсулина в среднем содержится 0,3-0,6% цинка.
Препарат инсулина (его получают из железы крупного рогатого скота) - это бесцветное вещество с температурой плавления 233 °C, хорошо растворяется в воде.
Биосинтез. Инсулин синтезируется в β-клетках островков Лангерганса из аминокислот. Вначале образуется проинсулин, состоящий из 73 или 84 остатков аминокислот. Затем под влиянием нейрогуморальных факторов в двух участках
цепи молекулы проинсулина происходит разрыв и отщепляется соединяющий пептид. В результате этого образуется молекула инсулина (цвет. табл. VI). Пептид содержит 22 и 33 остатка аминокислот. Образованию инсулина из проинсулина способствует повышение концентрации глюкозы в крови.
Метаболизм. Гормон из β-клеток через синусоидные капилляры поступает в кровеносное русло. Здесь он
374
взаимодействует с α- и β-глобулинами и в виде комплексов с ними направляется в органы и ткани. Гормон действует непродолжительное время, до 3-4 ч. Затем инсулин инактивируется инсулиназой. При однократном прохождении крови через печень инактивируется около половины содержащегося в ней инсулина.
Биологическое действие. Гормон влияет на углеводный, липидный, белковый и нуклеиновый обмены. Основная функция инсулина заключается в регуляции обмена углеводов. При недостатке гормона возникают гипергликемия и глюкозурия, что связано с уменьшением проницаемости клеточных мембран к глюкозе, ингибированием глюкокиназы и гликогенсинтетазы. Деятельность пентозного пути нарушается, а это отрицательно отражается на биосинтезе жирных кислот, так как нет должного количества НАД · H2. Наличие нужной концентрации инсулина обеспечивает преобладание синтеза белков и липидов над их распадом, отложение в тканях гликогена. Инсулин участвует в биосинтезе клеточных мембран и стимулирует связывание иРНК с рибосомами. Повышение проницаемости мембран связано со способностью дисульфидных групп гормона взаимодействовать с сульфгидрильными группами мембран. Инсулин стимулирует процессы клеточного дыхания и его сопряжение с фосфорилированием.
Патология. При недостатке или отсутствии в организме инсулина возникает сахарный диабет. Причиной могут быть инфекции, токсикозы, панкреатиты, опухоли гипофиза и др. Наступает общая слабость, исхудание, гипергликемия, глюкозурия, полиурия (суточное количество мочи возрастает в 3-5 раз), возникает диабетическая катаракта, помутнение и изъязвление роговицы, кома и гибель.
Применение в животноводстве и ветеринарии. Препараты инсулина
(естественные и синтетические) применяют при лечении сахарного диабета, гепатитов, панкреатитов, отравлений и др. Инъекция откормочным свиньям инсулина в дозе 1 ИЕ (0,04082 мг препарата) на 1 кг живой массы повышает суточный привес на 26%.
Г л ю к а г о н . ( г и п е р г л и к е м и ч е с к и и ф а к т о р , Г Г Ф.)
Глюкагон выделен из поджелудочной железы как примесь к инсулину.
375
Химическая природа. Это полипептид, состоящий из 29 остатков 16 аминокислот, молекулярная масса - 3470, плохо растворяется в воде, изоэлектрическая точка находится в области рН 7,5-8,5. Глюкагон имеет следующую первичную структуру:
Биосинтез. Гормон синтезируется из аминокислот в α-клетках островков Лангерганса, а также слизистой двенадцатиперстной кишки.
Метаболизм. Гормон поступает в кровеносную систему и разносится по всему организму, оказывая влияние на обмен веществ.
Биологическое действие. Гормон активирует фосфорилазу печени, липазы тканей, вместе с инсулином образует единую систему регуляции содержания глюкозы в организме. В этом процессе участвует функциональный аналог гормона - адреналин.
Патология. В клинике встречаются гипо- и гиперпродукция глюкагона. Гипопродукция вызывается инфекционными, а также токсическими поражениями α-клеток.
Применение в животноводстве и ветеринарии. Применяют при лечении болезней, вызывающих дегенерацию α-клеток.
Доза 0,7 мкг/кг живой массы увеличивает содержание сахара крови на 50%. При повышенной продукции глюкагона для его инактивации применяют препараты бутамида и надизана.
Л и п о к а и н . Гормон - вещество, предупреждающее ожирение печени. Получают после извлечения из поджелудочной железы инсулина.
Химическая природа. По химической структуре липокаин является полипептидом. Аморфный порошок, желтого цвета, растворимый в воде, с характерным запахом.
376
Биосинтез. Гормон синтезируется из аминокислот в клетках эпителия мелких выводных протоков поджелудочной железы.
Метаболизм. Гормон поступает в кровеносное русло, затем в органы и ткани. Оказывает биологическое действие, после чего инактивируется ферментами.

Биологическое действие. Липокаин стимулирует окисление жиров, жирных кислот и выход их из печени в ткани, предохраняет и устраняет жировую инфильтрацию печени, при наличии в кормах липотропных факторов (холина, метионина, казеина) способствует биосинтезу фосфатидов.
Патология. Выработка гормона нарушается при панкреатитах, различных инфекционных болезнях, интоксикациях, опухолях.
Применение в животноводстве и ветеринарии. Препараты гормона применяют при лечении сахарного диабета, гепатитов, жировой дистрофии печени и цирроза, атеросклероза и др.
В а г о т о н и н . Гормон имеет белковую природу. Стимулирует деятельность парасимпатической нервной системы, и прежде всего вагуса. Воздействуя на этот нерв, ваготонин задерживает распад гликогена до глюкозы, чем и вызывает уменьшение содержания сахара в крови. Стимулирует процессы кроветворения. В молекуле ваготонина содержится до 8% карнитина.
377
373 :: 374 :: 375 :: 376 :: 377 :: Содержание
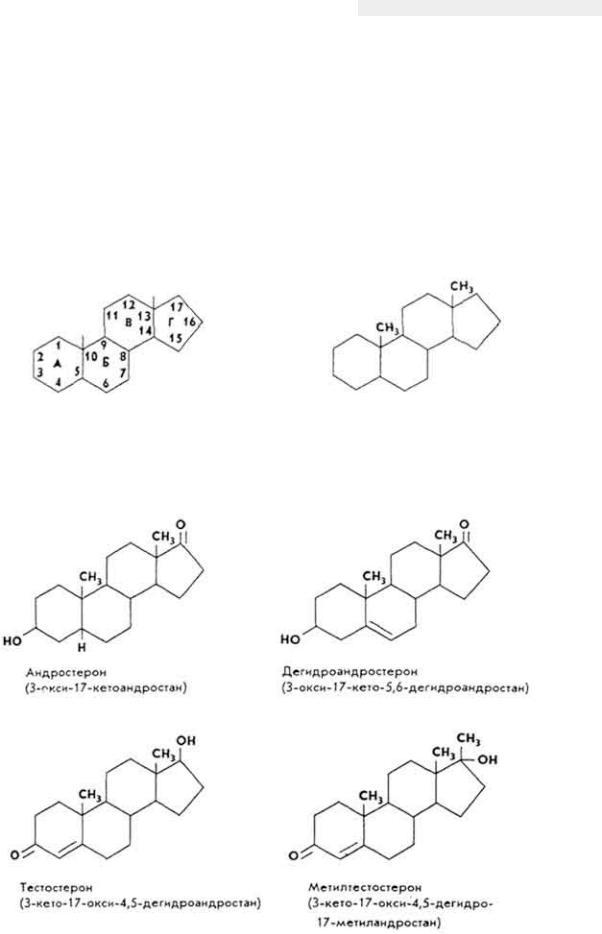
377 :: 378 :: 379 :: 380 :: Содержание
Мужские половые гормоны
Мужские половые гормоны - андрогены - синтезируются в основном в семенниках, некоторая часть - в яичниках и коре надпочечников. Наибольшее количество гормонов содержится в сперме.
Химическая природа. Первый андроген получен Я. Бутенандтом в 1932 г. и назван андростероном. Все андрогены являются производными циклического углеводорода - циклопентанпергидрофенантрена, в частности его метилированного гомолога - андростана.
377
Наибольшее значение имеют андростерон, дегидроандростерон, тестостерон и их синтетический аналог - метилтестостерон.
Андрогены не растворяются в воде, растворяются в этаноле, могут кристаллизоваться, имеют высокую температуру плавления, оптически активны.
Биосинтез. Синтезируются в интерстициальных клетках Лейтига.
Исходными веществами для синтеза служат холестерин и ацетил-KoA. Центральное место в синтезе занимает прегненолон, из которого двумя метаболическими путями (Δ4- и 5-пути) под влиянием ряда ферментов образуется тестостерон.
Биосинтез тестостерона и других гормонов регулируется гормонами передней доли гипофиза - фоллитропином и лютропином.
Метаболизм. Гормоны поступают в кровеносное русло, разносятся по организму и оказывают биологическое действие на обмен веществ. Период биологической полужизни молекулы тестостерона составляет 20 мин. Гормоны претерпевают ряд превращений и в виде конечных продуктов обмена выделяются из
378
Рис. 47. Механизм
действия стероидных гормонов (по Ю. Б. Филипповичу, 1985)
организма. Некоторое количество гормонов выделяется с мочой без изменений.
Биологическое значение. С деятельностью гормонов связано развитие и проявление вторичных половых признаков и устойчивого полового влечения. Выделение андрогенных гормонов протекает непрерывно. Стероидные гормоны сравнительно свободно проникают через клеточные мембраны и связываются в клетках-мишенях со специфическими белковыми рецепторами. Образовавшийся гормон-рецепторный комплекс проникает в кариоплазму, где и оказывает через ферментные системы влияние на матричный синтез ДНК и РНК, а затем - на клеточный синтез белка (рис. 47). Андрогены стимулируют биосинтез белка в мышечной ткани, вызывают накопление в организме азота, фосфора, калия, натрия, хлора. Тестостерон в 2 раза активнее дегидроандростерона, в 6 раз активнее андростерона.
Патология. Выделение гормонов нарушается при орхитах, эпидидимитах, травмах, опухолях семенников, инфекциях, интоксикациях. Кроме гипогонадотизма (недостатка продукции гормонов), встречается гипергонадотизм (чрезмерная продукция гормонов).
Применение в животноводстве и ветеринарии. В животноводстве

проводится кастрация, хирургическое удаление семенников. Поведение животных становится более спокойным, происходит переориентация обмена веществ на отложение избыточного количества жира. Андрогены и метилтестостерон применяются при
379
половой недостаточности, импотенции, недоразвитости семенников, половом и нервном истощении. Активность андрогенов измеряется петушиными единицами (ПЕ) и в интернациональных единицах (ИЕ). За 1 ПЕ принято минимальное количество гормона, которое необходимо ввести каждому из трех петушков породы леггорн, чтобы вызвать у них на 3-4 сут увеличение площади гребешка на 20%. 1 ИЕ равна 0,1 мг андростерона.
380
377 :: 378 :: 379 :: 380 :: Содержание
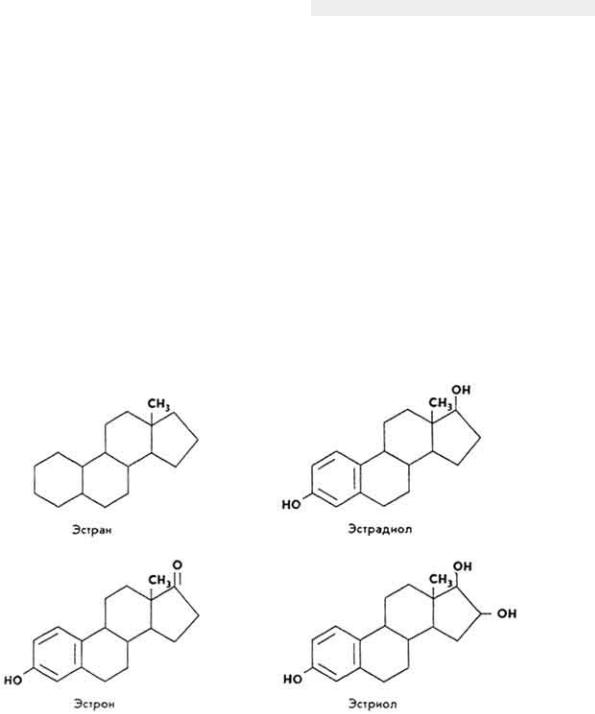
380 :: 381 :: 382 :: 383 :: 384 :: Содержание
Женские половые гормоны
Женские половые гормоны синтезируются в яичниках, плаценте и частично в надпочечниках. Отличаются между собой химическим строением, свойствами и значением.
Химическая природа. Их делят на пять групп: эстрогены, гестагены,
релаксин, андрогены и гормоны плаценты. |
|
|
||
Э с т р о г е н ы |
и |
г е с т а г е н ы |
являются |
производными |
циклопентанпергидрофенантрена. Эстрогены в основе молекулы содержат ядро эстрана. Впервые выделены из мочи беременных в 1927 г., затем получены в чистом виде эстрон, эстрадиол и эстриол.
Молекула эстрогенов в ядре А содержит три двойные связи.
380
Эстрон часто называют фолликулином. Эстрогены - кристаллические вещества с высокой температурой плавления, оптически активны, не растворяются в воде, растворяются в этаноле и маслах.
Г е с т а г е н ы - это гормоны желтого тела и продукты их обмена, производные прегнана. Наибольшее значение имеет прогестерон (гормон беременности).
Это кристаллические вещества, имеют высокие температуры плавления, оптически активны, хорошо растворимы в этаноле и эфире, нерастворимы в воде.
Р е л а к с и н - полипептид, обладает основными свойствами. Молекула состоит из двух субъединиц, соединенных дисульфидным мостиком. Синтезируется желтым телом беременных самок. Релаксин свиньи имеет молекулярную массу 6500.
А н д р о г е н ы (см. с. 377), синтезируемые в яичнике самок, не имеют существенного значения в их половой деятельности.
Х о р и о н и ч е с к и й |
г о н а д о т р о п и н |
( х о р и о н г о н а д о т р о п и н ) |
- это гормон плаценты. Гликопротеид, |
молекулярная масса - около 100 тыс., содержит до 18% углеводов, 8,4% азота, термостабильный. В крови жеребых кобыл имеется хорионгонадотропин с молекулярной массой 60-80 тыс., содержащий до 25% углеводов, он активируется амилазой слюны.
Биосинтез. Биосинтез женских половых гормонов протекает циклически. Эстрогены в яичнике образуются в клетках внутренней теки фолликулов, звездчатых клетках желтых тел и интерстициальных клетках. После овуляции гранулезные клетки прорастают в кровяной сгусток и постепенно трансформируются в
381
лютеиновые клетки, образуя желтое тело, продуцирующее гестагены. При отсутствии беременности желтое тело рассасывается. Эти процессы регулируются нейрогуморально. Так, в начале цикла гипофиз выделяет фоллитропин. Под его влиянием развиваются фолликулы яичника, в которых под воздействием лютропина гипофиза синтезируются эстрогены. Они стимулируют рост фолликулов и их чувствительность к гонадотропинам. Когда инкреция эстрогенов достигает максимума, происходит выброс больших количеств лютропина из гипофиза (по принципу положительной обратной связи). Под их влиянием происходит овуляция. В дальнейшем развивается желтое тело, где синтезируются прогестерон и его аналоги.
Во время беременности в женском организме развивается плацента, где
продуцируются гормоны. Образование всех пяти групп гормонов катализируется одними и теми же ферментными системами, хотя существуют некоторые различия. Биосинтез релаксина и хорионгонадотропина - типичный синтез белка.
Метаболизм. Гормоны поступают в кровеносную систему и в виде биокомплексов с β-глобулинами транспортируются в органы и ткани. После биологического действия инактивируются в основном в печени и почках. Вначале часть эстрогенов превращается в связанные формы - глюкурониды и эфиры с серной кислотой. В дальнейшем основная масса эстрогенов инактивируется гидроксилированием, метоксилированием и окислением с образованием мало- и неактивных производных эстрогенов. Часть гормонов выделяется с мочой в неизменном виде (у лошади за сутки выделяется с мочой до 60 г эстрона). Основной продукт обмена прогестерона - прегнандиол, который выделяется в виде глюкуронидов.
Биологическое действие. Гормоны осуществляют репродуктивные функции. Эстрогены обеспечивают развитие и проявление у самок вторичных половых признаков (течку, половое влечение), оптимальные условия для оплодотворения яйцеклетки после овуляции, подготовку матки для имплантации оплодотворенной яйцеклетки. После наступления беременности на месте бывшего фолликула развивается истинное желтое тело, которое продуцирует гестагены. Под влиянием гестагенов стимулируется развитие маточных желез и
382
выделение ими секрета, служащего питательным и защитным веществом для развивающейся яйцеклетки до ее имплантации.
Прогестерон подготовляет слизистую оболочку матки к восприятию оплодотворенной яйцеклетки и способствует образованию материнской части плаценты. Он понижает сокращение матки и тормозит действие окситоцина. При беременности гестагены тормозят овуляцию и способствуют развитию молочной железы. Они замедляют выброс лютропина и не допускают овуляцию фолликулов. Прогестерон тормозит выделение фоллитропина, увеличивает скорость распада и синтеза белков, пуриновых оснований, углеводов.
Релаксин оказывает специфическое действие на поздних стадиях беременности: под его влиянием размягчаются эпифизы лонного сращения и расслабляются лобковые связки.
Хорионгонадотропин способствует нормальному протеканию беременности: влияет на развитие и функционирование истинных желтых тел, регулирует эндокринные функции плаценты.
Патология. К патологическим нарушениям выделения гормонов относятся различные заболевания: недоразвитость яичников, кисты яичников, дисфункция
гипофиза и щитовидной железы и др. Эти явления приводят к нарушениям реакций обмена веществ, в которых участвуют гормоны. При близкородственном разведении часто возникает инфантилизм - общее недоразвитие организма или отдельных органов, особенно половых и центральной нервной системы.
Применение в животноводстве и ветеринарии. Гормоны и их синтетические аналоги применяются в качестве лекарственных средств при различных нарушениях женской половой сферы. Особое место принадлежит синэстролу, применяемому для борьбы с яловостью, при лечении эндометритов и для ускорения отделения последа у коров.
Высокой эстрогенной активностью обладает октэстрол: он в 2,5 раза активнее фолликулина, по
383
активности он равен синэстролу. При откорме животных используется стильбэстрол.
384
380 :: 381 :: 382 :: 383 :: 384 :: Содержание
384 :: 385 :: 386 :: 387 :: Содержание
Гормоны коры надпочечников
В коре надпочечников синтезируется ряд гормонов стероидной природы.
Химическая природа. По физиологическому действию гормоны делят на четыре группы: глюкокортикоиды (кортикостерон, гидрокортикостерон, кортизон), минералокортикоиды (альдостерон, дезоксикортикостерон), андрогены (андростендион, дегидроэпиандростерон, тестостерон и др.), эстрогены (эстроген, эквиленин и др.). Первые две группы называют собственно кортикостероидами. Гидрокортизон и кортикостерон составляют около 80% всех гормонов коры, альдостерон - 2, остальные - 18%.
384
Биосинтез. В клетках клубочковой зоны коры надпочечников образуется альдостерон, в пучковой зоне - гормоны, обеспечивающие регуляцию обмена многих органических веществ и реакцию организма на стрессовые воздействия. Биосинтез кортикостероидов регулируется гормоном гипофиза АКТГ. Здесь из предшественников (холестерина и ацетил-КоА) образуются гормоны.
Между эндокринными железами, участвующими в образовании и
регуляции биосинтеза кортикостероидов, существует прямая и обратная связь. Так, при появлении в крови избытка кортикостероидов в гипоталамусе уменьшаются синтез и выделение кортиколиберина, что приводит к уменьшению скорости биосинтеза AKTT в гипофизе, и наоборот. Некоторые предшественники гормонов образуются в стероидпродуцирующих органах, особенно в половых железах и плаценте, затем поступают в кору надпочечников.
Специфичность в образовании гормонов зависит от вида животного, от активности ферментов, катализирующих данные процессы. Так, разрыв боковой цепи прегнана осуществляется карбоксилазами. Образование гидроксильных групп катализируется гидроксилазами, которые различны в зависимости от места расположения групп - ОН. Источником водорода чаще бывает витамин С, которым богата кора надпочечников. Водород транспортируется в виде НАДФ∙H2.
Метаболизм. Гормоны поступают в кровеносное русло. Около 90% общего количества их находится в виде комплексных соединений с белками. Так, гидрокортизон и кортизон соединяются с α-глобулинами, альдостерон - с альбуминами крови. Это дает возможность клеткам постепенно использовать гормоны и предохраняет кортикостероиды от разрушения. Период биологической полужизни молекулы гидрокортизона равен 80-110 мин, кортикостерона - 60-90 и кортизона - 30 мин.
Основная масса кортикостероидов выделяется из организма в виде их метаболитов. Общее для всех стероидных гормонов - преобладание в их обмене восстановительных реакций. Восстановленные метаболиты в печени образуют парные соединения с глюкуроновой и серной кислотами. Они выделяются из организма с мочой и калом. Около 1% гидрокортизона выводится с
385
мочой в неизменном виде. Кортикостерон выделяется с желчью.
Биологическое действие. Под влиянием глюкокортикоидов увеличивается распад белков и тормозится их синтез, уменьшается масса тела и возрастает выделение с мочой азотсодержащих соединений, возрастает содержание гликогена в мышцах, стимулируется гликонеогенез, повышаются уровень глюкозы в крови и накопление гликогена в печени. Уменьшение выделения этих гормонов оказывает обратное действие. Интенсивный синтез глюкокортикоидов способствует увеличению в крови количества лейкоцитов, особенно нейтрофилов, и уменьшению в ней числа эозинофилов и лимфоцитов.
Минералокортикоиды влияют на водно-солевой обмен. Они задерживают в тканях ионы Na+ и создают предпосылки для удерживания организмом воды. При их недостатке уменьшается содержание в тканях ионов Na+ и хлорид-ионов,
падает |
осмотическое |
давление, |
наступает |
обезвоживание. |
||
Минералокортикоиды, |
особенно |
альдостерон, |
обладают |
слабым |
||

глюкокортикоидным действием, влияя на обмен углеводов. Они оказывают некоторое влияние на минеральный обмен. Андрогены и эстрогены в коре надпочечников синтезируются в небольшом количестве. Они не оказывают существенное влияние на обмен веществ.
Патология. При гипофункции коры надпочечников возникает острая и хроническая недостаточность четырех групп гормонов. Причиной первой из них могут быть инфекционно-токсические процессы, новообразования, травмы и другие поражения органа. При этом ослабевает сердечная деятельность и нарушается работа пищевого канала. Причиной хронической недостаточности может быть атрофия коры надпочечников. При этом падает кровяное давление, уменьшается мышечный тонус, возникает бронзовая окраска кожи и слизистых оболочек (бронзовая болезнь), наступает гипогликемия и гипоазотемия, нарушается водно-минеральный обмен.
Иногда встречается гиперфункция коры надпочечников. В ее основе лежит усиление функционирования клеток какой-то одной зоны. Так, при повышенной функции клубочковой зоны возрастает выделение альдостерона и развивается синдром альдостеронизма
386
(гипертония, гипернатриемия, судороги, парез). Причиной этого могут быть аденомы и карциномы коркового вещества надпочечников или различные инфекционные и токсические процессы. При опухолях пучковой зоны коры начинается избыточное выделение глюкокортикоидов, что приводит к возникновению надпочечно-коркового синдрома обменного типа - затухает синтез белков, возрастает их распад и подавляется иммунобиологическая реактивность организма.
Применение в животноводстве и ветеринарии. Гормоны применяют в соответствии с их биологическим действием. Так, кортизон используется при лечении ревматоидного артрита, полиартритов, острого суставного ревматизма, волчанки, спондиоартритов, бронхиальной астмы и др. Ацетат кортизона применяют для лечения ревматизма, дерматитов, лейкозов; альдостерон (в 30120 раз активнее дезоксикортикостерона) - при нарушениях минерального обмена. Для этой цели используют синтетические аналоги - дексаметазон (в 30 раз активнее гидрокортизона) и 9α-фторпреднизолон (в 50 раз активнее гидрокортизона) .
387
384 :: 385 :: 386 :: 387 :: Содержание
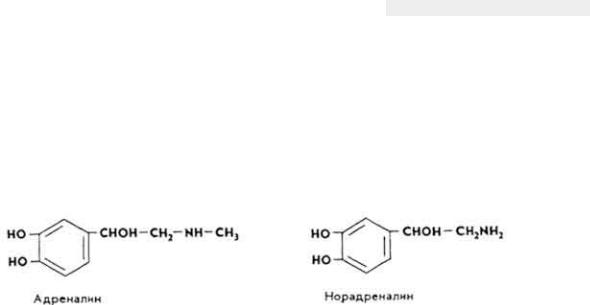
387 :: 388 :: 389 :: Содержание
Гормоны мозгового вещества надпочечников
Вмозговом веществе надпочечника синтезируются два гормона - адреналин
инорадреналин.
Химическая природа. Гормоны являются производными диоксибензола (катехола или пирокатехина). Их называют катехоламинами.
В органах и тканях, особенно в симпатической нервной системе, содержится L-адреналин, который в 15-40 раз активнее D-адреналина. Адреналин - кристаллическое вещество белого цвета, горькое на вкус, трудно растворяется в воде, оптически
387
активное, нестойкое, легко вступает в реакции окисления и замещения.
Биосинтез. Основная масса обоих гормонов синтезируется в округлых или многоугольных клетках мозгового вещества надпочечников, часть - в симпатических отделах нервной системы. Источником для их биосинтеза служит L-тирозин.
Метаболизм. Синтезированные гормоны поступают в кровеносное русло. Здесь они соединяются с белками крови и разносятся по организму. Часть гормонов в нервных окончаниях симпатической нервной системы депонируется в виде солей с АТФ. После выполнения специфических функций гормоны инактивируются в печени путем образования парных соединений с серной и уксусной кислотами, которые выводятся из организма с мочой. Кроме того, адреналин и норадреналин подвергаются сложным химическим превращениям, которые приводят к образованию меланоидного пигмента, удаляемого из организма животного с мочой.
Значительное количество гормонов инактивируется метилированием и дезаминированием с образованием продуктов, которые в виде парных соединений с серной и глюкуроновой кислотами выводятся с мочой из организма.
Биологическое действие. Гормоны вместе с простагландинами (см. ниже) влияют на обмен углеводов, белков, липидов и других соединений.
Молекула гормона из кровеносного русла поступает в межклеточную
жидкость, а из нее - на поверхность клетки-мишени. Здесь молекула адреналина, как и других гормонов, взаимодействует с рецепторами поверхности клетки. Рецепторы взаимодействуют с ферментом аденилатциклазой, которая находится в неактивной форме. Под влиянием фермента из АТФ образуется цАМФ. Он и является посредником между гормоном и соответствующим ферментом. Если субстратом оказывается гликоген, через цАМФ гормон оказывает действие на молекулу неактивной фосфорилазы, превращая ее в активную форму. Активная фосфорилаза и осуществляет фосфоролиз гликогена, превращая его в глюкозо-1-фосфат.
Повышенное выделение гормонов или избыточное введение их в организм вызывает гипергликемию и глюкозурию. Гормоны увеличивают скорость
388
расщепления в тканях белков и выделения азотистых продуктов обмена с мочой, активируют липазу жировых депо и ускоряют мобилизацию липидов. Действие адреналина проявляется в дозах 0,0001-0,00001 мг на 1 кг живой массы. При этом повышается кровяное давление, учащается и усиливается сердцебиение, ускоряется ритм дыхания, замедляется перистальтика кишок, увеличивается температура тела и др. Адреналин повышает систолическое давление, норадреналин - систолическое и диастолическое. Норадреналин не учащает пульс и не усиливает потребление тканями кислорода.
Действие гормонов связано с их взаимодействием с адренорецепторами. α- Адренорецепторы связаны с возбуждением, а β-адренорецепторы - с торможением сокращений мышечных волокон гладких мышц, учащением и усилением сердечных сокращений.
Патология. Мозговое вещество поражается при многих инфекционных, незаразных и инвазионных болезнях, новообразованиях, травмах и других патологических процессах. Атрофируется хромаффинная ткань, уменьшается выделение гормонов, что приводит к торможению всех химических реакций, в которых участвуют катехоламины. Иногда наступает гиперфункция мозгового вещества, когда оно поражается симпати-кобластомой. Возникает избыток гормонов и их предшественников, усиливаются реакции обмена, в которых участвуют адреналин и норадреналин. Возникает гипертония (с тахикардией), гипергликемия, глюкозурия, развиваются атеросклероз, нефрит, нарушается мозговое кровообращение, угнетается деятельность коры надпочечников, может наступить смерть.
Применение в животноводстве и ветеринарии. Препараты гормонов применяют при сердечно-сосудистой недостаточности, шоках, гипогликемической коме, лечении бронхиальной астмы. Использование их противопоказано при органических поражениях сердца и высоком кровяном давлении.
389

387 :: 388 :: 389 :: Содержание
389 :: 390 :: 391 :: 392 :: 393 :: 394 :: 395 :: Содержание
Гормоноиды
Гормоноиды, или паратгормоны, представляют собой разнородные по химическому строению вещества, которые оказывают сильное биологическое действие на многие физиологические процессы в организме. В
389
отличие от гормонов их биосинтез не имеет строгой локализации: они образуются в самых различных органах и тканях. Гормоноиды обладают кратковременным биологическим действием. К ним относятся Простагландины, гормоноиды пищевого канала и нейрогормоны.
П р о с т а г л а н д и н ы . Впервые были обнаружены в семенной жидкости человека. Ульф ван Эйлер в 1936 г. выделил эти вещества из вытяжки предстательной железы и назвал их простагландинами. Сейчас известно свыше 20 природных простагландинов.
Химическая природа. Все эти вещества по агрегатному состоянию являются жидкостями или низкоплавкими кристаллическими веществами. По химической природе они представляют собой ненасыщенные жирные кислоты, имеющие скелет из 20 углеродных атомов. Их делят на четыре основные группы: E, А, В и F. Каждый из простагландинов в основе молекулы имеет циклопентановое кольцо, две боковые цепи, двойную связь между 13-м и 14-м углеродными атомами. Индивидуальные представители внутри каждой группы отличаются между собой числом двойных связей в боковых цепях.
Эти связи обозначаются внизу буквы с цифровым индексом.
Наибольшей биологической активностью обладают два простагландина: ΠΓ-Ε1 и ПГ-F3α.
Биосинтез. Простагландины образуются в клетках различных тканей. Их
предшественниками служат ненасыщенные жирные кислоты: линолевая, линоленовая,
390
арахидоновая и др. При эндогенном происхождении жирных кислот из фосфолипидов под воздействием фосфолипаз высвобождаются полиненасыщенные жирные кислоты, обычно с линейной цепью из 20 углеродных атомов. В дальнейшем под влиянием ферментов в микросомах происходит окислительная циклизация с образованием простагландина по типу:
В организме человека ежесуточно образуется около 100 мкг простагландинов. В отдельных тканях (например, в тканях предстательной железы) их содержание достигает 1 мкг на 1 г, в семенной жидкости содержится до 100-300 мкг н 1 мл.
Метаболизм. Простагландины обладают высокой степенью метаболизма. Наиболее интенсивно они распадаются в тканях легких, почек и печени. Так, после однократного прохождения крови через легкие и печень инактивируется соответственно 95 и 70% ПГ-Е2. Эти процессы включают окисление гидроксила
у C15, восстановление ∆13-двойной связи, β-окисление, ω-гидроксилирование и ω-окисление,
Биологическое действие. Простагландины по биологическому действию можно отнести к "местным", или клеточным, гормонам. Прежде всего, они воздействуют на активность аденилатциклазы, регулирующей в клетках содержание цАМФ - посредника между гормонами и ферментами. Так, в жировой ткани под влиянием аденилатциклазы усиливается липолиз, в мышечной - гликогенолиз, в корковом веществе
391
надпочечников-стероидогенез. В клетках простагландины обычно находятся в
связанном состоянии. Их действие активируется адреналином. Важную роль в осуществлении действия простаглавдинов могут играть АТФ и ионы Ca2+.
Патология. Биосинтез гормоноидов и их обмен нарушаются при многих болезнях, особенно печени, легких, почек, центральной нервной системы, половых желез, а также при недостатке и отсутствии в кормах ненасыщенных жирных кислот.
Применение в животноводстве и ветеринарии. Применяют для лечения бронхиальной астмы, бронхитов, артритов, тромбозов, язвы желудка, синхронизации охоты у самок и стимуляции опоросов у свиноматок.
Г о р м о н о и д ы п и щ е в о г о к а н а л а . В слизистой оболочке пищевого канала вырабатываются некоторые биологически активные вещества, которые по своему действию напоминают гормоны.
Г а с т р и н . Это вещество полипептидной природы, вырабатываемое слизистой оболочкой привратника желудка:
Гастрин выделяется в ответ на раздражение слизистой оболочки при растяжении или действии кормов. Способствует выделению желудочного сока, сока поджелудочной железы, желчи, повышает тонус и моторику желудка и кишок. Повышение концентрации соляной кислоты в желудочном соке тормозит биосинтез гастрина.
392
С е к р е т и н . Вырабатывается клетками слизистой оболочки тонкой кишки под влиянием соляной кислоты желудочного сока. Полипептид, молекула его построена из 27 аминокислотных остатков, причем 14 из них соединены в такой последовательности, как и в молекуле глюкагона. Секретин получен в чистом виде из слизистой оболочки кишок свиньи. Всасывается слизистой оболочкой кишок, попадает в кровеносную систему, затем в поджелудочную железу. Стимулирует выделение поджелудочной железой воды и электролитов
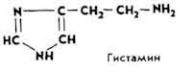
(в основном гидрокарбонатов).
П а н к р е о з и м и н . Этот полипептид вырабатывается слизистой оболочкой тонкой кишки. Структура его молекулы изучена недостаточно. Панкреозимин способствует выработке секреторной частью поджелудочной железы гидрокарбонатов и ферментов.
Х о л е ц и с т о к и н и н . Вещество, вырабатываемое слизистой оболочкой тонкой кишки. Биосинтез стимулируется липидами, белками и минеральными веществами кормов. По химической природе - это полипептид. Вызывает сокращение мышц желчного пузыря и выделение желчи в двенадцатиперстную кишку.
Н е й р о г о р м о н ы . Синтезируются в нейро-секреторных клетках. Затем они поступают в нервные окончания и межклеточное пространство. Больше всего нейрогормонов синтезируется в клетках ядер промежуточного мозга. К ним относятся вазопрессин и оцитоцин, гормоны гипоталамуса, гистамин, серотонин, ацетилхолин, адреналин и норадреналин и некоторые др.
Г и с т а м и н . Гистамин - производное аминокислоты гистидина. Много его вырабатывается тканями кожи, пищевого канала, легких. Выполняет роль гуморального возбудителя желудочной секреции, повышает тонус гладких мышц, расширяет капилляры. Находится в связанном состоянии с гепарином и другими веществами. Секреторная деятельность гормоноида регулируется соматотропином, адреналином, норадреналином, ацетилхолином. Инактивируется клеточными белками и гистаминазой. Содержание гистамина в тканях возрастает при ожогах, шоке и др.
393
С е р о т о н и н . Образуется из L-триптофана в центральной нервной системе, клетках слизистой оболочки кишок и поджелудочной железы. Обладает широким диапазоном действия на функции нервной, сердечнососудистой, мышечной, мочеполовой и эндокринной систем. Служит медиатором нервного импульса в нервных центрах (например, в гипоталамусе)
ина периферии.
Втканях быстро разрушается под влиянием фермента МАО, превращаясь в 5-гидроксииндолилуксусную кислоту, которая с мочой выводится из организма. Оказывает влияние на сокращение гладких мышц и передачу нервных импульсов, участвует в регуляции кровяного давления, температуры тела, дыхания, мочеотделения, деятельности пищевого канала. Нарушение обмена серотонина может быть одной из причин возникновения инфаркта миокарда, язвенной болезни, многих психических заболеваний.

А ц е т и л х о л и н . Ацетилхолин - один из наиболее распространенных медиаторов нервного возбуждения. Синтезируется в эндоплазматической сети многих нейронов центральной и периферической нервной системы. Им богаты нервные клетки парасимпатических ганглиев.
Выделяется ацетилхолин окончаниями двигательных и парасимпатических нервных волокон в синаптическую щель и вызывает со стороны иннервируемого органа соответствующий эффект.
Биосинтез ацетилхолина происходит в результате реакции между холином и ацетил-КоА под влиянием фермента холин - ацетилтрансферазы, ионов Mg 2+, K+, Ca2+.
394
Н е к о т о р ы е д р у г и е г о р м о н о и д ы. Наибольший интерес представляют ангионтензин и кинины.
А н г и о т е н з и н . По химической природе гормоноид представляет собой полипептид, образуется из β-глобулинов крови. При недостатке в тканях почек кислорода в них вырабатывается фермент ренин. Под влиянием ренина и трипсина от молекулы глобулина отщепляется декапептид - неактивный ангиотензин I. Когда он подвергается действию фермента ангиотензиназы, то отщепляются два аминокислотных остатка и образуется ангиотензин II: Фен- Προ-Гис-Илей-Тир-Вал-Арг-Асп. Гормоноид является составной частью системы ренин - ангиотензин. Объектом действия ангиотензина служат почечные артериолы. При гиперинкреции возникает почечная гипертония.
К и н и н ы . Эти полипептиды участвуют в регуляции скорости кровотока, уменьшают кровяное давление, усиливают работу сердца и легких. Образуются в тканях и крови из кининогенов под влиянием специализированных ферментов. Наибольшее значение имеют два кинина: брадикинин - Арг-Про-Про-Гли-Фен- Сер-Про-Фен-Арг и каллидин -Арг-Про-Гли-Фен-Сер-Про-Фен-Арг-Три.
Контрольные вопросы
1. Что такое гормоны и гормоноиды, каковы их общая характеристика, механизм действия и классификация?

2.Проанализируйте химическую природу, биосинтез, метаболизм, биологическое действие, патологию, применение в животноводстве и ветеринарии гормонов: гипоталамуса; трех долей гипофиза; щитовидной железы; паращитовидной железы; тимуса; поджелудочной железы; семенников; женских половых органов; коры надпочечника; мозгового слоя надпочечника.
3.Что вам известно о химической природе, биосинтезе, метаболизме, биологическом действии, патологии, применении в животноводстве и ветеринарии гормоноидов?
4.Каковы причины возникновения и клинические симптомы гигантизма и акромегалии, микседемы и креатинизма, эндемического зоба и базедовой болезни, гипер- и гипопаратиреозмов, сахарного и несахарного диабетов, импотенции и нимфомании, бронзовой болезни?
395
389 :: 390 :: 391 :: 392 :: 393 :: 394 :: 395 :: Содержание

396 :: 397 :: 398 :: 399 :: Содержание
ГЛАВА 12
ОБМЕН РАЗЛИЧНЫХ ВЕЩЕСТВ КАК ЕДИНОЕ ЦЕЛОЕ
Биохимические превращения различных веществ в организме взаимосвязаны. Нарушение обмена одной группы веществ, как правило, влечет за собой изменение обмена веществ организма в целом. Известно, что обмен веществ складывается из двух процессов: ассимиляции и диссимиляции. У молодого организма процессы ассимиляции преобладают над процессами диссимиляции, У взрослых животных между процессами ассимиляции и диссимиляции устанавливается динамическое равновесие. У стареющих и больных животных распад веществ преобладает над их синтезом.
Реакции обмена веществ, протекающие в организме, характеризуются высокой степенью согласованности. Они составляют упорядоченную и целостную систему, которая сложилась в результате длительной эволюции живого мира, закрепилась генетически и передается по наследству от поколения к поколению. Обмен веществ представляет собой закономерный порядок превращений веществ и энергии в организме, органах, тканях, клетке.
Взаимосвязь и взаимообусловленность реакций обмена веществ координируются центральной нервной системой и железами внутренней секреции, образуя стройную систему нейрогуморальной регуляции. Регуляция в клетке осуществляется с помощью ферментов, гормонов, цАМФ, медиаторов возбуждения, общих продуктов биохимических реакций. Каждая ферментативная реакция - это звено соответствующего метаболического пути, а все метаболические пути в совокупности составляют обмен веществ. Биохимические реакции взаимосвязаны и протекают в определенном порядке и последовательности. Так, обмен нуклеиновых кислот, белков, липидов, углеводов на первых этапах происходит различными путями, но в итоге образуются одни и те же конечные продукты СO 2 и H2O, а при окислении нуклеиновых кислот и белков, кроме того, азотистые соединения: мочевина, мочевая кислота и др.
Взаимосвязь обмена нуклеиновых кислот с обменом других веществ.
Обмен нуклеиновых кислот связан с другими видами обмена веществ. В частности,
396
интенсивность биосинтеза зависит от наличия в клетке соответствующего "сырья" и белков-ферментов: ДНК- и РНК-полимераз, полинуклеотидфосфорилазы, синтетаз пуриновых и пиримидиновых оснований и др. При распаде пуриновых оснований образуется глиоксиловая кислота, из которой образуется глицин. При распаде пиримидиновых оснований возникает β-аланин - источник образования пантотеновой кислоты и коэнзима А. Глицин
и β-аланин могут служить материалом для биосинтеза белков.
Существует связь между обменом нуклеиновых кислот и углеводов. Так, D- рибоза и D-дезоксирибоза используются для биосинтеза нуклеозидов, нуклеотидов и нуклеиновых кислот. Биосинтез углеводов зависит от биосинтеза нуклеиновых кислот. Так, часть УТФ используется для образования уридиндифосфоглюкозы - основы для биосинтеза полиглюканов.
β-Окисление высших жирных кислот дает клетке макроэргические соединения - нуклеозидди- и нуклеозидтрифосфаты, которые являются источниками химической энергии для образования многих веществ. Биосинтез некоторых фосфолипидов зависит от ЦТФ.
Образование нейтральных жиров из углеводов. Углеводы служат источником образования жиров. Так, при откорме свиньи в течение 3 мес за счет углеводов может образоваться до 22 кг жира. Связующим звеном перехода углеводов в жиры и обратно служит ацетил-КоА. Глицерин образуется за счет восстановления 3-фосфоглицеринового альдегида или фосфодиоксиацетона. Высшие жирные кислоты (ВЖК) синтезируются из ацетил-КоА. В дальнейшем из глицерина и ВЖК синтезируется молекула нейтрального жира.
Образование углеводов из жиров. Углеводы в организме могут синтезироваться из жиров. Этот процесс имеет особое значение для животных, которые впадают в зимнюю спячку. Запасы жира у них к моменту спячки достигают 50% общей массы, дыхательный коэффициент зимой низок - 0,4-0,6. Под влиянием клеточных липаз жир гидролизируется. Глицерин окисляется в глицериновый альдегид, который фосфорилируется и может служить источником образования глюкозы и гликогена. Из высших жирных кислот при β-окислении образуется ацетил-КоА, из него - другие вещества. Из глюкозы образуется гликоген.
397
Образование белков из углеводов. Между углеводным и белковым обменами существует взаимосвязь через общие метаболические пути превращения.
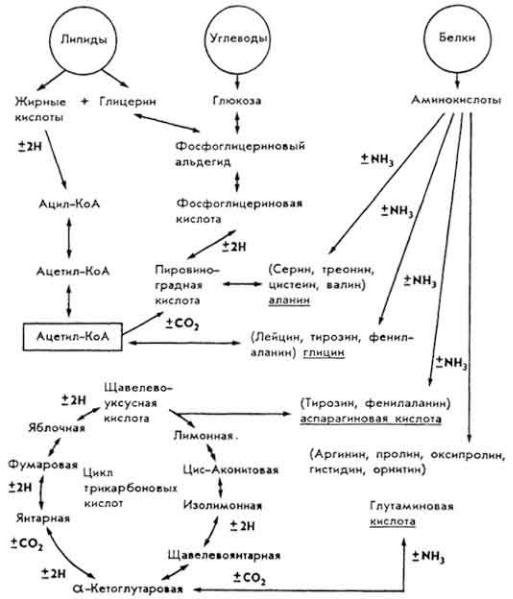
И в данном случае ключевым продуктом обмена является ацетил-КоА, из которого могут образоваться аланин, фенилаланин, тирозин, триптофан, гистидин и др. Кроме того, из него образуется щавелевоуксусная кислота, которая дает аспарагиновую. В ходе функционирования цикла трикарбоновых кислот возникает α-кетоглутаровая кислота, которая дает глутаминовую, и т. д. Процессы превращения углеводов в белки и белков в углеводы регулируются глюкокортикоидами.
398
Единство обмена веществ в организме. Обмен различных веществ в организме представляет собой единое целое. В зависимости от потребностей организма в тканях и клетках из общих продуктов химических реакций могут синтезироваться необходимые для жизнедеятельности вещества. Ведущая роль в этих процессах принадлежит ферментам. ДНК обеспечивает передачу генетической информации и строгую специфичность в структуре. биополимеров. При расщеплении углеводов и липидов, а иногда и белков возобновляются запасы АТФ и других макроэргических соединений.
Таким образом, живой организм представляет собой саморегулирующуюся

систему, которая беспрерывным обменом веществ обеспечивает свое существование. Нарушение реакций обмена и деятельности этой системы приводит к патологии.
Контрольные вопросы
1.Каково значение ацетил-КоА в обмене жиров, белков и углеводов?
2.Как взаимосвязаны в обмене веществ нуклеиновые кислоты и белки, жиры и углеводы, белки и углеводы? Иллюстрируйте химическими реакциями.
3.Нарисуйте схему взаимосвязи обмена различных веществ в организме.
399
396 :: 397 :: 398 :: 399 :: Содержание

400 :: 401 :: 402 :: 403 :: Содержание
ЧАСТЬ II
БИОХИМИЯ СПЕЦИАЛИЗИРОВАННЫХ ТКАНЕЙ И ОРГАНОВ
ГЛАВА 1
БИОХИМИЯ НЕРВНОЙ ТКАНИ
Химический состав нервной ткани
Нервная ткань составляет 2,0-2,5% общей массы организма. Она состоит из нервных клеток, нервных волокон, нервных окончаний и нейроглии. Структурной и функциональной единицей нервной ткани является нейрон (рис. 48). Нейроны объединяются в органы, органы - в нервную систему, которая воспринимает внешние и внутренние раздражения, анализирует их, регулирует и координирует все основные функции организма, объединяет его в единое целое, осуществляет связь организма животного с внешней средой.
Биохимия нервной ткани подробно изучена отечественными учеными и, в первую очередь, А. В. Палладиным, Г. E. Владимировым, E. M. Крепсом, Я. В. Великом, их школами и последователями в СССР и за рубежом.
Химический состав нервной ткани и ее структурных элементов определяется значением органа нервной системы в жизнедеятельности организма, местом животного в филогенетическом ряду, возрастом и функциональным состоянием организма и др. Нервная ткань эмбриона в среднем содержит 90% воды и 10% сухого остатка, взрослого организма - соответственно 65% воды и 35% сухого остатка. Больше всего воды имеется в сером веществе коры больших полушарий головного мозга (82,7%), меньше - в белом (72,8%) и в спинном мозгу (74%). Серое вещество мозга крупного рогатого скота содержит 80,6% воды и 19,4% сухого остатка, в сухом остатке 55,4% составляют белки, 43,1 - липиды и 1,5% зола, белое вещество имеет 68,4% воды и 31,6% сухого остатка, в сухом остатке 24,8% составляют белки, 74,6 - липиды и 0,6% зола (Д. Петровский, 1870).
400
Рис. 48. Строение нейрона: 1 - ядро с ядрышком; 2 - аксон;
3 - дендриты; 4 - миелиновая оболочка; 5 - нервные окончания
Белки. В нервной ткани имеется от 5-7 до 16 индивидуальных белков (в т. ч. в митохондриях - до 8), представляющих около 100 различных растворимых белковых фракций. Они относятся к двум группам - протеинам и протеидам. Протеины представлены: нейроальбуминами (они являются основным белковым компонентом фосфопротеидов и составляют основную массу растворимых белков - 89-90%), нейро-глобулинами (около 5% всех растворимых белков), гистонами (пять фракций катионных белков) и нейросклеропротеидами (структурно-опорные белки -нейроколлагены, нейроэластины, нейростромины и др., составляют 8-10% от всех простых белков, ими богаты белое вещество мозга и периферическая нервная система).
Протеиды нервной ткани представлены следующими подгруппами: нуклеопротеидами (ДНП и РНП), липопротеидами (липидный компонент состоит в основном из фосфатидов и холестерина), протеолипидами (их больше всего имеется в миелине), фосфопротеидами (около 2% всех сложных белков), гликопротеидами (гликопротеиды, содержащие до 40% углеводов и их производных в молекуле, белковая часть чаще всего представлена альбуминами и глобулинами; гликопротеиды, содержащие 40-85% углеводов и нередко липидный компонент,
401

А. В. Палладин (1885-1972)
гликолипопротеиды). В нервной ткани обнаружено два специфических белка -S- 100, или белок Мура (его иногда называли "белком памяти", 85-90% белка сосредоточено в нейроглии, 10-15% -в нейронах), и белок 14-3-2 (как предыдущий, он относится к кислым белкам). В нервной ткани содержатся ферменты всех шести классов, катализирующих все стороны обмена веществ, восприятие, анализ и передачу нервных импульсов.
Содержание углеводов. Нервная ткань бедна углеводами, хотя потребность в них здесь велика (например, в мозгу имеется 1,0-1,5 г/кг гликогена, в мышцах - 10-20 г/кг). Основными углеводами здесь являются глюкоза (1-4 мкмоля на 1 г ткани) и гликоген (2,5-4,5 мкмоля на 1 г). У новорожденных животных содержание гликогена в мозгу в 3 раза выше, чем у взрослых. Большая часть гликогена (около 80%) связана с белками и липидами, меньшая (до 20%) находится в свободном состоянии. Нервная ткань содержит промежуточные продукты углеводного обмена - гексозо- и триозофосфаты, молочную, пировиноградную и другие кислоты.
Содержание липидов. Нервная ткань богата
402
липидами, часть из которых специфична для нее. Так, в расчете на сухой остаток серое вещество мозга крупного рогатого скота содержит 43,1% и белое вещество-74,6% липидов. Из них фосфатиды соответственно составляют 16,3 и 27,5%, в том числе лецитины-3,2 и 3,3; кефалины-9,4 и 19,2; сфингомиелины - 3,7 и 5,0; холестерин - 3,2 и 10,9; цереброзиды - 4,3 и 14,1%. В нервной ткани мало жиров. ВЖК, входящие в состав молекул липидов, содержат одну и несколько (4 - арахидоновая и даже 5 - клупанодоновая кислоты) двойных связей. Они могут быть представлены лигноцериновой [CH3(CH2)22СООН],
цереброновой [CH3(CH2)21CH(OH)COOH] и другими характерными для нервной ткани кислотами и оксикислотами. Из нервной ткани выделены страндин и другие сложные гликолипиды.
Содержание нуклеотидов и креатинфосфата. Из свободных нуклеотидов адениловые нуклеотиды составляют 84%. В головном мозгу крыс содержание нуклеотидов и КрФ (в мкмолях на 1 г сырой ткани) следующее: АТФ - 2,30-2,90;
АДФ - 0,30-0,50; АМФ -0,03 - 0,05; ГТФ - 0,20-0,30; ГДФ - 0,15-0,20; УТФ - 0,17- 0,25; КрФ - 3,50-4,75. Это свидетельствует о высоком уровне энергетического обмена в ткани. Для нервной ткани характерно высокое содержание цАМФ (1-2 нмоль/г) и цГМФ (0,2 нмоль/г).
Содержание минеральных веществ. Нервная ткань содержит различные минеральные вещества, сравнительно равномерно распределенные в отдельных участках нервной системы млекопитающих (в % влажного вещества), по Д. Л. Фердману
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Минеральное |
|
Серое вещество |
|
|
Белое |
|
Спинной |
|
Периферические |
|
|
|
вещество |
|
головного мозга |
|
|
вещество |
|
мозг |
|
нервы |
|
|
|
|
|
|
|
|
|
|
|||||
|
Зола |
|
1,0-2,2 |
|
|
0,7-0,25 |
|
|
1,2-1,9 |
|
1,0-1,1 |
|
|
|
|
|
|
|
|
|
|||||
|
Na |
|
0,11-0,21 |
|
|
0,10-0,20 |
|
|
0,13-0,20 |
|
0,17-0,4 |
|
|
|
|
|
|
|
|
|
|||||
|
К |
|
0,20-0,35 |
|
|
0,18-0,38 |
|
|
0,26-0,34 |
|
0,12-0,20 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
Ca |
|
0,01-0,013 |
|
|
0,010- |
|
|
0,018- |
|
- |
|
|
|
|
|
0,013 |
|
|
0,032 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
Mg |
|
0,02-0,023 |
|
|
0,026- |
|
|
0,038- |
|
- |
|
|
|
|
|
0,040 |
|
|
0,048 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
|
С |
|
0,11-0,22 |
|
|
0,09-0,18 |
|
|
0,12-0,15 |
|
0,17-0,28 |
|
|
|
|
|
|
|
|
|
|||||
|
N |
|
0,056-0,08 |
|
|
0,09-0,015 |
|
0,08-0,10 |
|
0,07-0,12 |
|
|
|
|
|
|
|
|
|
|
|||||
|
P |
|
0,019-0,29 |
|
|
0,33-0,48 |
|
|
0,52-0,55 |
|
0,20-0,48 |
|
|
|
|
|
|
|
|
|
|||||
|
H2O |
|
83-87 |
|
|
70-74 |
|
|
65-75 |
|
60-70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
403 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
400 :: 401 :: 402 :: 403 :: Содержание |
||||||

404 :: 405 :: 406 :: 407 :: 408 :: 409 :: 410 :: Содержание
Обмен веществ в нервной ткани
Изучение обмена веществ в нервной ткани сопряжено с рядом трудностей. Прежде всего, нервная ткань обладает сложным строением, химическим составом, многообразием функций и реакций обмена веществ. В организме человека имеется 1010 нейронов (см. рис. 48), в коре больших полушарий - около 14 млрд. Каждый нейрон в среднем связан с 5 тыс. клеток. Синтез белков в нейроне больше, чем в другой клетке, предельно совершенен, что обеспечивает полноценное функционирование нейрона в течение всей жизни организма. Головной мозг заключен в черепную коробку, спинной - в позвоночный канал. Малейшее вмешательство в структуру нервной ткани грозит патологией. Многие реакции протекают в ней в течение десятых, сотых и даже тысячных долей секунды. Все это требует особого подхода к изучению обмена веществ в нервной ткани.
Дыхание нервной ткани. Мозг потребляет 20-25% всего кислорода, поступающего в организм. Газообмен мозга в 20 раз больше газообмена покоящихся мышц. Так, нервная ткань за 10 с способна использовать весь кислород, который в ней содержится. У молодых животных нервная система потребляет 40-50% кислорода, поступившего в организм, причем 80% расходуют нейроны. Больше всего кислорода поглощает сетчатка глаза крыс (470 мм3 на 1 г сухой массы), меньше - кора больших полушарий (185 мм3), симпатические узлы (112 мм3) и нервные стволы (11-33 мм3). При возбуждении потребление кислорода нервной тканью возрастает примерно на 50%.
Обмен углеводов. Основной источник химической энергии для нервной ткани - глюкоза. Нервная ткань вдвое больше потребляет глюкозы, чем мышечная, и втрое больше, чем почки. Предполагается, что глюкоза, прежде чем используется клетками нервной системы, проходит стадию биосинтеза гликогена. Гликоген может расщепляться гидролитическим и фосфоролитическим путями. В головном мозгу преобладает первый путь.
Серое вещество мозга вчетверо больше потребляет глюкозы, чем белое. Химическая энергия, заключенная в глюкозе, освобождается анаэробным и аэробным
404
путями. Около 85% глюкозы окисляется до CO2 и H2O.
Обмен углеводов в нервной ткани зависит от обеспечения ее витамином B1 - его пирофосфат является коферментом пируватдекарбоксилазы, превращающей пировиноградную кислоту в ацетил-КоА (см. с. 259).
Обмен белков. Для белков характерна высокая степень метаболизма. Так, за время превращения нейробласта в нейрон содержание белка в клетке
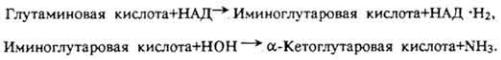
возрастает более чем в 2000 раз. Период полужизни молекул белков составляет 2,8-15,2 сут. Обмен белков быстрее происходит в сером веществе мозга, медленнее -в белом, медленно - в периферических нервах. Интенсивность обмена белков в нервных клетках в 53-70 раз большая, чем в глиоцитах. Глиоциты составляют около 40% объема мозга. В центральной нервной системе млекопитающих содержится около 140 млрд глиоцитов.
Нервная ткань богата аминокислотами. Так, если в крови в среднем содержится аминокислот 0,064 г/л, то в тканях мозга - 0,36 г на 1 кг. Среди них особое место принадлежит глутаминовой кислоте, из которой образуется глутамин и далее после транспортировки в печень - мочевина. На его долю приходится 80% аминного азота. Часть кислоты декарбоксилируется, образуется γ-аминомасляная кислота, которая через янтарный полуальдегид превращается в янтарную кислоту. Она включается в цикл трикарбоновых кислот, что приводит к образованию макроэргических соединений, CO2 и H2O.
Глутаминовая кислота под влиянием ГДГ может дезаминироваться и превращаться в α-кетоглутаровую кислоту:
α-Кетоглутаровая кислота идет в цикл трикарбоновых кислот. Аммиак - на образование глутамина, а затем - на синтез мочевины в печени. Некоторое количество мочевины может синтезироваться в нервной ткани и другими путями.
405
В нервной ткани образуются некоторые аминокислоты: глутаминовая, аспарагиновая, аланин, серин, цистин, глицин и аргинин.
Обмен липидов. В тканях головного мозга превращения жиров не имеют существенного значения. Здесь синтезируется холестерин из ацетил-КоА. Количество холестерина возрастает при абсцессах мозга, менингоэнцефалитах и др. Состав липидов нервной ткани сравнительно стабилен. Так, если в тканях печени в течение суток обновляется 50% всех жирных кислот, то в нервной системе за неделю обновляется лишь 20%.
Быстрее всего обновляются фосфатиды, особенно инозитфосфатиды. При возбуждении в нервной ткани задерживается холестерин и выделяется в кровеносное русло лецитин.
Химизм передачи нервного импульса. Нервная система выполняет ряд специфических функций: восприятие и передачу информации об изменениях внешней и внутренней среды в соответствующие центры, переработку этой информации, передачу эффекторных импульсов к исполнительным органам и
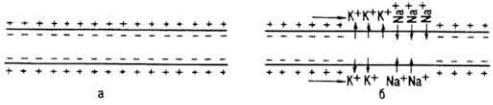
тканям, регуляцию деятельности последних и др. Механизм передачи нервных импульсов - электрический, химический и смешанного типа.
Нервная система состоит из нейронов, нейрон - из тела нервной клетки, аксона (аксонов), дендритов и нервных окончаний (см. рис. 48). Нейрон имеет наружную плазматическую мембрану. Согласно ионной теории передачи нервного импульса внутренняя поверхность мембраны во время покоя заряжена отрицательно, наружная - положительно (рис. 49). Эти заряды возникают в результате функционирования
Рис. 49. Ионный механизм
передачи нервного импульса: а - мембрана нейрона в состоянии покоя; б - мембрана нейрона при возбуждении
406
натрий-калиевого насоса. В нейроне ионов K+ содержится в 30 раз больше, чем во внеклеточном пространстве. Величина потенциала покоя в аксоне достигает 60-70 мВ. Под влиянием различных факторов нейрон возбуждается, изменяется проницаемость мембраны и ионы Na+ устремляются в клетку.
Внутренняя часть мембраны приобретает положительный заряд, наружная - отрицательный. Возникает потенциал действия. Нервный импульс с помощью нервных окончаний передается на соответствующий объект. После прекращения раздражения в нейроне восстанавливается динамическое равновесие между содержанием ионов K+ и Na+, так как натрий-калиевый насос удаляет избыток ионов Na+ из клетки.
Согласно химической теории, нервный импульс от нейрона к нейрону или на соответствующий орган передается с помощью специальных веществ - медиаторов. В передаче импульсов участвуют нервные окончания, входящие в состав синапса. Число синапсов на отдельных нейронах велико - до 10-20 тыс. и больше. Синапс состоит из пресинаптической части (синаптического окончания нейрона), синаптической щели и постсинаптической части.
Медиаторы синтезируются в теле нервной клетки и ее отростках, связываются с белками и накапливаются в виде синаптических пузырьков. Под влиянием раздражителя пресинаптическая мембрана деполяризуется, увеличивается ее проницаемость к ионам Ca2+ - они проникают в пресинаптические окончания и вызывают расщепление комплекса белок - медиатор. Медиатор диффундирует через поры мембраны в синаптическую щель, взаимодействует с рецепторами постсинаптической мембраны и вызывает потенциал действия.
Функциями медиаторов обладают ацетилхолин, катехоламины, серотонин,
гистамин, γ-аминомасляная кислота и др.
А ц е т и л х о л и н - медиатор в синапсах центральной, парасимпатической и симпатической нервной системы. Синтезируется из ацетил-КоА и холина под влиянием холинацетилтрансферазы и ионов Mg 2+, K+, Ca2+. Образуется в эндоплазматической сети нейрона, поступает в синапсы, связывается с белками, предохраняющими от воздействия АХЭ, и накапливается в виде синаптических пузырьков. После возникновения
407
нервного импульса комплекс ацетилхолин - белок расщепляется, медиатор через поры пресинаптической мембраны проникает в синаптическую щель и взаимодействует с холинорецепторами постсинаптической мембраны. Возникает потенциал действия, и возбуждение передается от нейрона к нейрону или к эффектор-ной клетке. Ацетилхолин разрушается АХЭ, синтезированной в той же клетке и сконцентрированной в синаптических пузырьках. Холин используется для ре-синтеза медиатора и других веществ.
К а т е х о л а м и н ы ( с и м п а т и н ы ) - медиаторы симпатической нервной системы, хромаффинной ткани мозгового вещества надпочечников и скоплений хромаффинных клеток. К ним относятся дофамин, норадреналин и адреналин. Медиаторы синтезируются в теле нервной клетки и в виде гранул откладываются в нервных окончаниях. После возбуждения нервной клетки медиаторы выделяются в синаптическую щель, где взаимодействуют с α-адрено-
иβ-адренорецепторами постсинаптической мембраны. Медиаторы инактивируются под воздействием двух ферментов: катехол-метилтрансферазы
иМАО. Образующиеся 3-метокси-адреналин и 3-метокси-4- гидроксиминдальная кислота обезвреживаются в печени и в виде парных соединений с глюкуроновой и серной кислотами выделяются с мочой.
С е р о т о н и н ( 5 - о к с и т р и п т а м и н ) - медиатор нервной системы, образуется из аминокислоты триптофана. После оказания биологического действия в синапсе дезаминируется, образовавшаяся 5- оксииндолилуксусная кислота выделяется из организма с мочой.
Г и с т а м и н образуется из гистидина под влиянием гистидиндекарбоксилазы. Принцип действия гистамина такой же, как и остальных медиаторов. После оказания своего действия инактивируется дезаминированием гистаминазой или путем соединения с клеточными белками.
γ-Аминомасляная кислота (ГАМК) - промежуточный продукт обмена веществ в нервной ткани. Образуется из глутаминовой кислоты под влиянием глутаматдекарбоксилазы. Оказывает тормозящее действие на функции дендритов нейронов головного и спинного мозга и деятельность мионевральных бляшек. После оказания
408
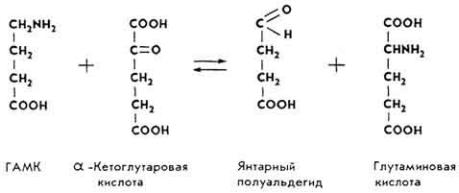
биологического действия инактивируется переаминированием с α- кетоглутаровой кислотой.
Связь между отдельными группами нейронов мозга осуществляется и с помощью опиоидных пептидов - эндорфинов и энкефалинов, которые являются нейромедиаторами и нейромодуляторами.
Связь между функциональным состоянием головного мозга и процессами обмена веществ в организме. Нервная система оказывает регулирующее действие на реакции обмена веществ. При возбуждении отдельных центров нервной системы реакции обмена веществ усиливаются, в состоянии покоя устанавливается динамическое равновесие между реакциями анаболизма и катаболизма, а при торможении реакции обмена веществ замедляются.
Ликвор (спинномозговая жидкость) циркулирует в полости желудочков головного мозга, спинномозгового канала и субарахноидальном пространстве головного и спинного мозга. Он предохраняет мозг от вредных внешних воздействий, участвует в регуляции внутричерепного давления и отдельных сторон тканевого обмена в нервной системе. Количество ликвора у лошади и крупного рогатого скота достигает 300-320 мл, у овец и коз - 15-20, у кроликов - 0,8-1,5 мл. Плотность ликвора - 1,007-1,009, рН 7,4-7,8. По химическому составу ликвор сходен с сывороткой крови. Так, он содержит белки и другие азотистые вещества, углеводы, хлорид-ионы, К+ и Ca2+. Химический состав ликвора изменяется при нервных болезнях. В клинике проводится пункция ликвора и введение некоторых лекарственных веществ в ликвор для облегчения их контакта с нейронами.
409
Контрольные вопросы
1.Какие особенности химического состава нервной ткани вы знаете?
2.Чем отличается обмен веществ в нервной системе?
3.Каков химизм передачи нервного возбуждения? Напишите формулы известных вам медиаторов.

410
404 :: 405 :: 406 :: 407 :: 408 :: 409 :: 410 :: Содержание

410 :: 411 :: Содержание
ГЛАВА 2
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Общая характеристика мышечной ткани
Мышечная ткань составляет более 40% общей массы животного. Различают три основных типа мышечной ткани: поперечнополосатую, сердечную и гладкую. Основной функцией мышечной ткани является сокращение и расслабление. Структурная и функциональная единица мышечной ткани - мышечное волокно. Мышечные волокна, объединяясь, образуют мышечные пучки, последние - индивидуальные мышцы. С деятельностью мышц связаны все основные физиологические отправления организма - движение, дыхание, пищеварение, кровообращение, выделение, размножение и др.
Каждое волокно окружено оболочкой - сарколеммой, в которой располагаются нервные окончания. Под сарколеммой находится саркоплазма, где сосредоточены саркоплазматическая сеть, митохондрии, рибосомы, лизосомы, миофибриллы и др. Сарколемма имеет белково-липидную природу. Она регулирует проникновение различных веществ в симпласт и из него в межклеточное пространство, а также выполняет роль диэлектрика, изолируя два "ионных бассейна": внутри симпласта и вне его.
Сократительный компонент мышечного волокна - миофибриллы - размещаются в саркоплазме равномерно или в виде скоплений. Основой каждой миофибриллы являются протофибриллы - белковые нити двух типов: толстые и тонкие (рис. 50). Толстые протофибриллы состоят главным образом из белка миозина, имеют длину около 1500 нм и диаметр 10-15 нм. Тонкие протофибриллы - в основном из белка актина, имеют длину 1000-1100 нм и диаметр 5-8 нм. Тонкие протофибриллы прикрепляются к сложному переплетению белковых нитей в миофибрилле - полоске Z. Участок
410
Рис. 50. Ультраструктура миофибриллы в
оптическом (а) и электронном (б) микроскопах:1 - полоска M; 2 - полоска Z; 3 - диск H; 4 - диск А; 5 - диск I; 6 - толстая протофибрилла; 7 - тонкая протофибрилла; 8 - субдиск H; 9 - мостики
миофибриллы между двумя полосками Z называют саркомером. Каждая миофибрилла имеет несколько сот таких саркомеров. Каждый саркомер состоит из двух участков - дисков с неодинаковой оптической плотностью: темных А (анизотропных) и светлых I (изотропных). Центральная зона диска А, лишенная тонких протофибрилл, называется субдиском H. В центре субдиска H есть полоска M, образованная сплетением коротких белковых М-нитей. В гладких мышечных волокнах протофибриллы не объединены в миофибриллы и диффузно заполняют все пространство саркоплазмы:
411
410 :: 411 :: Содержание

411 :: 412 :: 413 :: 414 :: 415 :: Содержание
Химический состав скелетных мышц
В скелетных мышцах теплокровных животных содержится 72-80% воды и 20-28% сухого остатка. Сухой остаток в основном состоит из белков. При утомлении содержание воды в мышцах достигает 80-83%, так как ее отток затруднен.
411
Белки мышечной ткани. Белки делятся на три группы: саркоплазмы, миофибрилл и мышечной стромы.
К белкам саркоплазмы относятся миоген, миоглобин, глобулин X и миоальбумин.
М и о г е н представляет собой гетерогенную фракцию белков мышц, составляет в среднем около 30% их общей массы. Состоит из миогена А и миогена В. Миоген А обладает свойствами фермента альдолазы. Миоген В ферментативно неактивен.
М и о г л о б и н - красный дыхательный пигмент мышечной ткани, осуществляет перенос кислорода к окислительным системам клеток. В мышцах содержится около 2% миоглобина в пересчете на сухой остаток. У морских животных его содержание может достигать 20%. Молекула миоглобина состоит из одной полипептидной цепи, содержащей 153 остатка аминокислот (см. рис. 20). Молекулярная масса белка составляет 17 тыс. Активной частью молекулы миоглобина является гем. Миоглобин с кислородом образует оксимиоглобин. У человека и наземных позвоночных с миоглобином связывается около 14% всего кислорода.
Г л о б у л и н X - гетерогенный белок, который остается в мышечной ткани после выделения миогеновой фракции. По химическим свойствам напоминает глобулины. Обладает ферментативными свойствами. Составляет в среднем 20% общего количества белков ткани.
Миоальбумин по химическим свойствам сходен с альбуминами крови. Им богаты мышцы эмбрионов и гладкие мышцы.
К белкам миофибрилл относятся миозин, актин, актомиозин и тропомиозин.
М и о з и н составляет около 40% всех белков мышечного волокна. По химической природе - глобулин. Молекулярная масса достигает 500 тыс. Молекула миозина состоит из 5 тыс. остатков 18 аминокислот. Обладает АТФазной активностью, что дает возможность энергию АТФ превращать в механическую работу мышечного сокращения. АТФ влияет на физические свойства миозиновых нитей. Миозин обладает свойствами АМФ-
аминогидролазы.
А к т и н существует в глобулярной (Г-актин) и фибриллярной (Ф-актин) форме. Составляет около 14% общего количества белков мышц. Молекулярная масса
412
Г-актина около 70 тыс. Ф-Актин - продукт полимеризации Г-актина. При переходе Г-актина в Ф-актин изменяются форма, вязкость, химическое строение
иактивность белка.
Ак т о м и о з и н - комплекс, который образуется актином и миозином, основной сократительный белок мышечной ткани. Молекулярная масса - около 5 млн. Обладает свойствами АТФ-азы. Главной особенностью белка является его
способность сжиматься под влиянием АТФ и при наличии ионов К + и Mg2+. При этом вытесняется вода, уменьшается частица белка, после чего он распадается на актин и миозин. Взаимодействие актомиозина с АТФ - основа мышечного сокращения.
Т р о п о м и о з |
и н существует в |
виде двух |
форм: водорастворимой и |
водонерастворимой. |
Составляет 4-11 |
% общего |
количества белков мышц. |
Молекулярная масса - 50 тыс. В молекуле преобладают остатки глутаминовой кислоты, лизина и аланина. По свойствам сходен с миозином.
Белки мышечной стромы - белки, которые остаются в мышечной ткани после экстракции белков саркоплазмы и миофибрилл солевыми растворами. Имеют соединительно-тканевое происхождение (из сарколеммы, сухожилий, стенок сосудов, оболочек нервов и нервных волокон с окончаниями). Составляют 15-20% общего количества белков мышц. В их состав входят структурные (коллаген, эластин, нейрокератин) и ферментативные (АТФ-аза, АХЭ, АМФ-аминогидролаза) белки.
Липиды мышечной ткани. В составе липидов находятся нейтральные жиры, стерины и стериды, фосфатиды и гликолипиды. Содержание триглицеридов в межмышечной соединительной ткани колеблется в широких диапазонах. Общее содержание стеринов и стеридов колеблется в пределах 0,03- 0,23%, фосфатидов - 0,4-1%.
Экстрактивные вещества мышечной ткани. Представляют собой органические и минеральные соединения, которые хорошо экстрагируются водой из измельченной мышечной ткани. Органические соединения делят на азотистые и безазотистые.
Азотистые экстрактивные вещества составляют около 1% общей массы мышц. Содержание небелкового азота в составе мышечной ткани достигает 0,3- 0,9%. К ним относятся креатин и креатинин, карнозин,
413
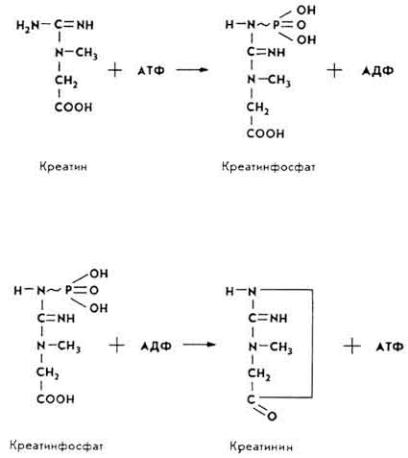
карнитин и ансерин, пуриновые и пиримидиновые соединения, полипептиды и аминокислоты и другие азотистые вещества. Большинство этих веществ находятся в фосфорилированном состоянии, составляя кислоторастворимую и кислотонерастворимую фракции.
К р е а т и н и к р е а т и н и н. Азот креатина составляет около 60% небелкового азота мышц. Его содержание в мышцах колеблется в пределах 0,2- 0,6%. Больше 50% креатина находится в виде креатинфосфата (КрФ) или фосфагена. Креатин образуется из трех аминокислот: глицина, аргинина и метионина. Так, в почках из глицина и аргинина под влиянием соответствующих ферментных систем образуется гуанидин-уксусная кислота, а из нее и метионина в тканях печени возникает креатин.
Креатин с током крови поступает в мышечную ткань, где фосфорилируется под влиянием фермента креатинкиназы.
КрФ является временным депо фосфора и энергии для биосинтеза АТФ. При расходовании АТФ в мышцах происходит регенерация АТФ за счет КрФ.
В мышечной ткани креатина содержится 3-7 мг%. Избыток его выделяется из организма с мочой.
414
К а р н о з и н , а н с е р и н и к а р н и т и н .В мышцах млекопитающих (в расчете на сырую массу) содержится 0,2-0,3% карнозина, 0,09-0,15% ансерина и 0,02-0,5% карнитина.
П у р и н о в ы е в е щ е с т в а. В мышечной ткани содержатся АМФ, АДФ,

АТФ, НАД, НАДФ, ГТФ, УТФ, ИТФ и др.
А м и н о к и с л о т ы . Мышечная ткань богата глутаминовой кислотой и глутамином, составляющими около 75% всех аминокислот и их амидов. Связанный аммиак в виде глутамина используется тканью для аминирования пуриновых и пиримидиновых оснований, карбоновых кислот, а его избыток с током крови поступает в печень, где из него синтезируется мочевина.
Ткань содержит мочевину, спермин, таурин, гипоксантин, инозитовую и мочевую кислоты, ксантин, тиамин и др.
Безазотистые экстрактивные вещества представляют собой прежде всего гликоген (3-4%) и продукты анаэробного и аэробного обмена углеводов: молочная кислота, гексозофосфаты, глюкоза, янтарная кислота, витамин С, инозит и др.
Минеральные вещества мышечной ткани. После сжигания мышечной ткани образуется зола (1-1,5% общей массы). Мышечная ткань богата ионами K+, Na+. Ионы Ca2+ и Mg2+ в основном сконцентрированы внутри мышечных волокон. Ионы Fe3+ входят в состав миоглобина. Мышечная ткань содержит ионы Co2+, B3+, Hg2+, Cl-, свободный и связанный фосфор.
Особенности химического состава сердечной и гладкой мышц. Эти мышцы содержат те же вещества, что и поперечнополосатые: воду (78-79%) и плотный остаток. Плотный остаток на 80% состоит из белков. Сердечная мышца вдвое беднее креатином и АТФ, имеет более стабильное содержание гликогена, несколько больше фосфатидов, глутаминовой кислоты и глутамина.
Гладкие мышцы содержат около 75% воды. Основой сухого остатка являются белки. В них много актомиозина, креатина, АТФ, есть следы ансерина и карнозина, беднее фосфатидами, богаче холестерином, тропомиозином, миоальбумином и белками стромы.
415
411 :: 412 :: 413 :: 414 :: 415 :: Содержание

416 :: 417 :: 418 :: 419 :: Содержание
Обмен веществ в мышечной ткани
Мышечная ткань характеризуется высокой степенью метаболизма. Источник энергии - реакции анаэробного гликогенолиза и цикла трикарбоновых кислот. Во время работы в ткани резко возрастает содержание молочной кислоты, уменьшается содержание гликогена, макроэргических соединений и др. При этом накапливаются многие продукты обмена, некоторые из них - ядовиты.
Химизм мышечного сокращения. Обмен веществ в ткани регулируется нервной системой. Сокращение мышцы начинается сокращением отдельных мышечных волокон. Каждое мышечное волокно имеет нервное окончание мотонейрона. Оно вместе с контактирующей частью мышечного волокна образует моторную бляшку - синапс. Пресинаптической мембраной служит цитомембрана нервного окончания, постсинаптической - сарколемма, образующая впячивание.
Под влиянием нервного импульса из пор Пресинаптической мембраны выделяется ацетилхолин. Он поступает в синаптическую щель, где взаимодействует с холинорецепторами цитомембраны мышечного волокна. Комплекс миоген - К+ распадается на миоген и ионы K+. Повышается проницаемость сарколеммы для ионов Na+ и K+, что приводит к ее деполяризации и возникновению постсинаптического потенциала. Появляется волна возбуждения, которая охватывает все волокно, его сарколемму, саркоплазму и миофибриллы.
Во время прохождения нервного импульса из структур саркоплазматической сети мышечного волокна в гиалоплазму выделяются ионы Ca2+, которые и активируют АТФ-азную функцию миозина. Молекула миозина до возбуждения связывает некоторое количество АТФ. При возбуждении происходит реакция:
Миозин-АТФ → Миозин+АТФ.
В дальнейшем миозин фосфорилируется с участием АТФ-азной части его молекулы. В булавовидных расширениях миозиновых протофибрилл возникает макроэргическая связь:
АТФ+Миозин → АДФ+Миозин~Фосфат.
416
Фосфорилированный миозин связывается с актином:
Миозин~Фосфат+Актин → Фосфат+Актин-Миозин (актомиозин).
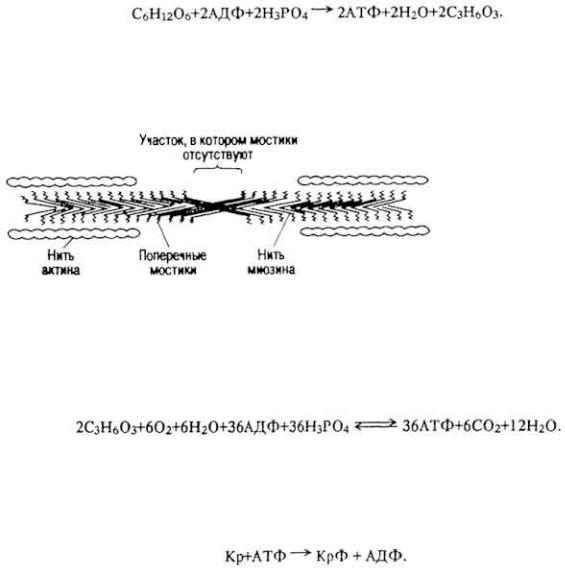
Энергия макроэргической связи используется мышцей для работы, а комплекс актин - миозин расщепляется до исходных веществ:
Актин-Миозин+Н2О → Актин+Миозин.
Тонкие актиновые нити обеих половин саркомера проникают между толстыми миозиновыми нитями, что приводит к укорачиванию саркомера, миофибрилл, мышечного волокна, пучков мышечных волокон и мышцы в целом (цвет. табл. VII). Скольжение тонких актиновых нитей вдоль толстых миозиновых обеспечивается перемещением поперечных мостиков частицы миозина по углублениям тонких нитей, как движение цепи с помощью зубчатого колеса (рис. 51).
Мышечная ткань имеет небольшие запасы АТФ, которые быстро расходуются. Реакции гликолиза (гликогенолиза) и клеточного дыхания приводят к восстановлению запаса АТФ в мышечной ткани. Так, при гликолизе из одной молекулы глюкозы получаются две молекулы АТФ:
Если источником глюкозы является гликоген, то при гликогенолизе из одной молекулы глюкозы образуются три молекулы АТФ. 80-85% молочной кислоты идет на ресинтез гликогена, остальная часть
Рис. 51. Схема контакта между
актином и миозином (по Г. Хаксли)
417
является источником энергии в цикле трикарбоновых кислот. Из суммарного уравнения клеточного дыхания видно:
Постоянное содержание АТФ в мышечной ткани связано с образованием и расщеплением креатинфосфорной кислоты (КрФ). Так, при избытке в ткани АТФ она под влиянием креатинкиназы взаимодействует с креатином (Kp):
При недостатке АТФ, например в работающей мышечной ткани, осуществляется регенерация АТФ:
Часть АТФ синтезируется из 1,3-дифосфоглицериновой и фосфопировиноградной кислот.
Некоторые данные по биохимии расслабления мышц. Основной функцией мышц является их сокращение и расслабление. После сокращения комплекс актин -миозин расщепляется до актина и миозина. Саркомер и миофибрилла восстанавливаются до исходного состояния. В гиалоплазме мышечного волокна резко уменьшается содержание ионов Ca2+. Тормозится деятельность миозиновой АТФ-азы. Мышечное волокно восстанавливает прежние запасы АТФ и КрФ.
Биохимические процессы в мышцах при тренировке и утомлении. При интенсивной работе мышц расходуются гликоген, глюкоза, АТФ. Затрудняется доступ веществ, необходимых для физиологической регенерации. Замедляется клеточное дыхание, накапливаются молочная кислота, аммиак, производные пурина и другие продукты обмена. Нарушается ритм нейрогуморальной регуляции. Наступает утомление мышц.
Тренированный организм обладает большей работоспособностью. При тренировке в ткани улучшаются кровообращение и газообмен, биосинтез белков и фосфатидов, гликогена и макроэргов, интенсивнее удаляются конечные продукты обмена веществ, совершенствуется деятельность различных ферментов,
418
уменьшается содержание жира. Тренированные животные медленнее утомляются, быстрее восстанавливают работоспособность и лучше переносят большие функциональные нагрузки. Эффективность тренировки зависит от полноценности рациона.
Особенности обмена веществ в сердечной мышце. Сердечная мышца функционирует непрерывно. От скелетных мышц отличается структурой мышечных волокон, ритмом работы и некоторыми сторонами обмена веществ. Миокард взрослого человека за одно сокращение направляет в аорту 60 мл крови, за 1 мин - 5 л, за 1 ч - 3 ц, за сутки - 7,2 т. Миокард беден гликолитическими ферментами, АТФ и КрФ. Для сердечной мышцы характерен аэробный путь расщепления углеводов. Она богата миоглобином, что обеспечивает большой запас кислорода. Окислительные процессы протекают в митохондриях мышечных волокон. Часть энергии в виде АТФ сердечная мышца получает вследствие окисления жирных кислот и оксикислот, а также реакций пентозного пути.
Биохимические изменения в мышцах при патологии. Химическая статика и динамика ткани нарушаются при многих заболеваниях общего и местного характера: прогрессивной мышечной атрофии, полиомиелите, костно-

суставных поражениях, авитаминозах и генетических болезнях и пр. В мышечной ткани уменьшается содержание белков, гликогена, АТФ, возрастает содержание коллагена, происходит переход некоторых ферментов в плазму крови. Это явление используется при диагностике и прогнозе болезней, например, при диагностике инфаркта миокарда изучается спектр изоферментов ЛДГ.
419
416 :: 417 :: 418 :: 419 :: Содержание

419 :: 420 :: Содержание
Окоченение мышц
После смерти прекращается кровообращение и мышечная ткань лишается питательных веществ. Замедляется, а затем прекращается удаление продуктов распада, реакция среды становится кислой, мышцы затвердевают и укорачиваются. Развивается трупное окоченение - посмертное затвердевание мышц и связанная с ним неподвижность суставов. Оно может наступить через несколько минут или часов после
419
клинической смерти. Его скорость зависит от наличия в ткани гликогена, молочной кислоты, рН и окружающей температуры. В ткани резко уменьшаются запасы гликогена, АТФ, КрФ, глюкозы и др. Вскоре они исчезают совсем. Возрастает содержание молочной кислоты и фосфатов, происходит коагуляция белков и увеличивается кислотность. Эти процессы быстрее наступают в скелетных, медленнее - в гладких мышцах. Через некоторое время окоченение мышц прекращается и они снова становятся мягкими.
Контрольные вопросы
1.Охарактеризуйте химический состав скелетной, сердечной и гладкой
мышц.
2.Составьте схему (с химизмом реакций) мышечного сокращения.
3.Какие биохимические нарушения лежат в основе известных вам заболеваний мышечной системы?
420
419 :: 420 :: Содержание

420 :: 421 :: 422 :: Содержание
ГЛАВА 3
БИОХИМИЯ КРОВИ
Физико-химические свойства крови
Кровь - это биологическая жидкость, обеспечивающая органы и ткани питательными веществами и кислородом. Вместе с лимфой она образует систему циркулирующих жидкостей в организме, которая осуществляет связь между химическими превращениями веществ в различных органах и тканях.
Кровь в организме выполняет ряд жизненно важных функций: питательную, дыхательную, выделительную, защитную, регуляторную, поддержания водного равновесия в тканях, регуляции температуры тела, механическую и др.
Количество крови у млекопитающих и птиц составляет 8-15% массы, у взрослого человека - 1/13 (5-6 л).
Кровь состоит из жидкой части - плазмы и форменных элементов - эритроцитов (от них зависит цвет крови), лейкоцитов, тромбоцитов. Плазма крови, лишенная белка фибриногена, называется сывороткой крови.
Плотность крови равна 1,050-1,060, осмотическое давление - 686,8-737,3 Па. Осмотическое давление
420
крови на 75% зависит от содержания в ней минеральных веществ. Осмотическое давление, обусловленное наличием в крови белков и других коллоидов,
называют онкотическим давлением.
Вязкость крови животных в 4,5-6 раз больше, чем у воды, сыворотки крови - в 1,5-2 раза. Она возрастает при многих болезнях, недостатке воды, тяжелой работе и т. д.
Поверхностное натяжение сыворотки крови колеблется в пределах 55-75 ·10-3 Н/м (у лошади -73,5 ·10-3 Н/м, коровы - 70,2-10-3 Н/м). Уменьшается при заболеваниях печени, почек и других органов, возрастает при некоторых отравлениях.
Кровь имеет слабощелочную реакцию. Ее рН колеблется в очень узких пределах. Так, у лошади рН крови равен 7,2-7,6; у коровы - 7,36-7,50; у овцы - 7,4-7,58; у козы - 7,4-7,58; у свиньи - 7,85-7,95. В эмбриональный период рН крови близок к 6, в последние дни эмбриогенеза он равен 6,5-6,8, в первые дни постнатальной жизни - 7,0. Постоянство рН крови тонко регулируется

буферными системами организма как один из важнейших показателей его гомеостаза.
Основные буферные системы крови: гидрокарбонатная (7% общей массы), фосфатная (1%), белковая (10%), гемоглобиновая и оксигемоглобиновая (до 81%) и кислотная (около 1%). В плазме крови преобладают гидрокарбонатная, фосфатная, белковая и кислотная буферные системы, в эритроцитах - гидрокарбонатная, фосфатная, гемоглобиновая, оксигемоглобиновая и кислотная. Кислотная буферная система образована органическими кислотами (уксусной, молочной, пировиноградной и др.) и их солями с сильными основаниями. Если катионы Na+ и K+ обозначить В, а гемоглобин - Hb, то буферные системы будут выглядеть так:
421
Наибольшее значение имеют гидрокарбонатная и гемоглобиновая буферные системы. В плазме крови содержание гидрокарбонатов в 20 раз больше содержания угольной кислоты. Запас гидрокарбонатов в крови характеризуется резервной щелочностью, т. е. количеством щелочи, способной связывать угольную и другие кислоты, возникающие при обмене веществ.
Механизм действия буферных систем рассмотрим на примере гидрокарбонатного буфера. При поступлении в кровь избытка кислот, которые могут сдвинуть рН в сторону ацидоза, часть гидрокарбонатов буферной системы расходуется на нейтрализацию этих кислот:
Образовавшаяся угольная кислота может входить в состав буферной системы или как нестойкое соединение разлагаться на CO2 и H2O. Повышенная концентрация СО2 в крови раздражает дыхательный центр головного мозга, деятельность легких усиливается и избыток CO2 выделяется в окружающую среду. NaCl удаляется с мочой.
Если в кровь поступает избыток основных продуктов, способных сдвинуть рН в сторону алкалоза, они нейтрализуются угольной кислотой и сдвиг рН крови не происходит:
Гидрокарбонат вдет на пополнение нижней части буферной системы, его

избыток удаляется почками, а вода выделяется обычным путем: через кожу, почки, легкие.
422
420 :: 421 :: 422 :: Содержание

422 :: 423 :: 424 :: 425 :: 426 :: 427 :: 428 :: 429 :: 430 :: Содержание
Химический состав крови
А. Химический состав плазмы крови
Кровь характеризуется постоянством химического состава. Плазма крови составляет 55-60% общего объема крови и на 90% состоит из воды. Сухой остаток составляют органические (9%) и минеральные (1%) вещества. Основой органических веществ являются белки, большинство которых синтезируется в печени.
422
Белки плазмы крови. Общее содержание белков млекопитающих колеблется в пределах 6-8%. Известно около 100 белковых компонентов плазмы. Условно их можно разделить на три группы: альбумины, глобулины ж фибриноген. Белки плазмы, которые остались после удаления фибриногена,
называют сывороточными белками крови (табл. 9).
Соотношение между содержанием альбуминов и глобулинов определяется альбуминово-глобулиновым коэффициентом - А/Г. У лошади в норме А/Г равен 0,6, у крупного рогатого скота - 0,7-1, у овцы - 0,7-0,9, у свиньи - 0,7-1. А/Г изменяется в онтогенезе, при интенсивной работе и при патологии.
Альбумины участвуют в транспортировании многих веществ: углеводов, жирных кислот, витаминов, неорганических ионов, билирубина и др. Они также обусловливают около 80% онкотического давления, участвуют в регуляции рН, водного и минерального обменов.
Глобулины сыворотки крови делятся на три фракции: α-, β-, γ-глобулины. Каждая фракция, в свою очередь, делится на подфракции (рис. 52). Разделение основано на их различной электрофоретической подвижности. Глобулины сыворотки крови выполняют ряд жизненно важных функций. Так, α- и β- глобулины участвуют в траспортировании к клеткам нерастворимых в воде липидов, стероидных гормонов, витаминов A, D, E и К. Они связывают свыше 2/3 холестерина крови. В состав α-глобулинов входят некоторые ферменты, мукопротеины, протромбин и др. Фракция β-глобулинов включает трансферрины, антигемофильный глобулин и др.
γ-Глобулины - белковая фракция сыворотки крови, обладающая наименьшей электрофоретической
9. Содержание белков в сыворотке крови животных, %
Животное |
|
Общий белок |
|
Альбумины |
|
Глобулины |
|
|
|
|
|||
Крупный рогатый скот |
|
7,4 |
|
3,3 |
|
4,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лошадь |
|
|
|
|
|
|
|
|
|
|
7,3 |
2,7 |
4,6 |
|
||||
|
Овца |
|
|
6,8 |
|
2,7 |
|
4,1 |
|
|
|
|
|
|
|
||||
|
Свинья |
|
|
8,0 |
|
3,5 |
|
4,5 |
|
|
|
|
|
|
|
||||
|
Кролик |
|
|
6,2 |
|
4,4 |
|
1,8 |
|
|
|
|
|
|
|
||||
|
Курица |
|
|
4,1 |
|
1,2 |
|
2,9 |
|
|
|
|
|
|
|
|
|
|
|
423
подвижностью. γ-Глобулины содержат специфические белки - антитела. Имеют невысокую молекулярную массу (160-300 тыс), их изоэлектрические точки находятся в пределах рН 6,8-7,3. По химической природе антитела можно отнести к гликопротеидам. Антитела появляются в крови в первые дни постнатальной жизни. По иммунологическому действию могут быть лизинами (растворять чужеродные клетки), антитоксинами (нейтрализовывать токсины), агглютининами (связывать чужеродные белки), преципитинами (образовывать осадки с антигенами) и др. Содержание антител возрастает при многих инфекционных и инвазионных заболеваниях. γ-Глобулины, полученные из сыворотки здоровых или иммунизированных животных, применяют с профилактической и лечебной целями. К γ-глобулинам иногда относят комплекс пропердин, способный уничтожать вирусы и бактерии.
Рис. 52. Электрофоретическое разделение сыворотки крови на
фракции и подфракции
Кроме рассмотренных белков, в состав плазмы и сыворотки крови входят свыше 50 ферментов, белковые гормоны и др.
Биосинтез альбуминов в основном протекает в тканях печени. Большинство γ-глобулинов образуется в лимфоидных и плазматических клетках ретикулоэндотелиальной системы, особенно в селезенке, лимфоузлах и костном мозгу. Часть α- и β-глобулинов синтезируется в печени, часть - в клетках ретикулоэндотелиальной системы.
Небелковые азотистые вещества плазмы и сыворотки крови. Эти вещества называют остаточным азотом. Их содержание в плазме и сыворотке крови составляет 0,02-0,06%, возрастает при тяжелой работе, заболеваниях почек, профузных кровотечениях, инфекционных болезнях и др. В состав остаточного азота входят мочевина, аминокислоты, эрготионеин, мочевая кислота, креатин и др. Остаточный азот содержит также полипептиды, образующие кининовую систему, которая

424
регулирует кровоток, проницаемость стенок сосудов и свертываемость крови.
Безазотистые вещества плазмы и сыворотки крови. К этой группе веществ относятся многие органические соединения.
У г л е в о д ы . В плазме крови содержатся глюкоза, фруктоза, гликоген, глюкозамин, фосфаты моноз и другие продукты промежуточного обмена углеводов. Основа углеводов представлена глюкозой. Ее содержание выражается в микромолях. Вместе в глюкозой при этом определяются "примеси" - фруктоза, галактоза, манноза.
Глюкоза и другие монозы в плазме крови находятся в свободной и связанном с белками состоянии. Содержание связанной глюкозы достигает 4050% общего содержания углеводов.
Среди продуктов промежуточного обмена углеводов выделяется молочная кислота, содержание которой в плазме крови резко возрастает после тяжелой физической нагрузки (например, у лошади с 0,01 до 0,1%).
Содержание глюкозы в плазме крови может изменяться при многих патологических состояниях. Явление гипергликемии характерно для сахарного диабета, гипертиреоза, шока, наркоза, лихорадочных заболеваний. Гипогликемия возникает при голодании, избыточном поступлении в кровь инсулина и др.
Л и п и д ы . В плазме крови содержится до 0,7% и больше липидов. Липиды находятся в свободном и связанном с белками состоянии. Содержание общих липидов у животных различных видов колеблется в широких пределах, например, у коровы - 0,8%, у кролика - 0,24%. В плазме крови лактирующих коров содержится 0,16% холестеридов, 0,02 - холестерина, 0,15 - фосфюлипидов и 0,03% триглицеридов.
Содержание липидов в плазме крови изменяется при патологии. Так, при туберкулезе оно достигает 3-10%.
А ц е т о н о в ы е т е л а. Содержание в плазме крови крупного рогатого скота ацетоновых тел (β-оксимасляной и ацетоуксусной кислот, ацетона) колеблется от 0,001 до 0,005%. Оно возрастает при кетозах, родильном парезе, сахарном диабете, гепатитах и других болезнях. Возникают ацетонемия, токсикозы, ацетонурия.
425
10. Содержание химических элементов в сыворотке крови животных, мг на
100 г (по П. А. Коржуеву)
Фосфор |
|
Фосфор |
|
|
|
|
Животное |
|
Натрий |
|
Калий |
|
Кальций |
|
Магний |
|
общий |
|
неорганический |
|
Хлор |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Лошадь |
|
320,0 |
|
|
18,0 |
|
12,0 |
|
|
2,5 |
|
12,5 |
|
|
4,8 |
|
|
360,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Крупный |
|
330,0 |
|
|
19,0 |
|
11,0 |
|
|
3,5 |
|
11,0 |
|
|
5,0 |
|
|
370,0 |
|
|
рогатый скот |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Овца |
|
325,0 |
|
|
19,0 |
|
11,5 |
|
|
2,5 |
|
11,5 |
|
|
6,0 |
|
|
370,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Свинья |
|
335,0 |
|
|
20,0 |
|
12,0 |
|
|
3,0 |
|
10,0 |
|
|
5,0 |
|
|
370,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Курица |
|
375,0 |
|
|
0,22 |
|
20,0 |
|
|
2,3 |
|
33,0 |
|
|
4,2 |
|
|
470,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б е з а з о т и с т ы е |
в и т а м и н ы. |
В плазме крови |
содержатся |
многие |
|||||||||||||||
провитамины и витамины (каротин, ретинол, витамин С и др.).
Минеральные вещества плазмы и сыворотки крови. В крови содержатся различные минеральные вещества. Их биологическое значение разнообразно. Они участвуют в поддержании осмотического давления и постоянства рН среды, служат активаторами и ингибиторами ферментов, являются строительным материалом для органов и тканей, участвуют в защитных реакциях организма. Так, кальций участвует в процессах свертывания крови, магний является составной частью пропердиновой системы.
Содержание отдельных минеральных веществ изменяется в зависимости от зоны обитания, состава кормов, возраста, вида животного (табл. 10), уровня продуктивности, а также при патологии, что используется для контроля минерального питания организма животного и в ветеринарной диагностике.
Б. Химический состав форменных элементов крови
Эритроциты. Эритроциты составляют основную массу крови. В 1 мм3 крови лошади, например, содержится 6-10 млн эритроцитов, крупного рогатого скота - 5,5-10, овцы - 8-16, козы - 15-19, свиньи - 5,9-9 млн. Размеры эритроцитов млекопитающих составляют около 50 мкм2. Небольшие размеры эритроцитов и
426
большое их количество создают огромную поверхность, что очень важно для процессов дыхания. Образуются в красном костном мозгу. Каждый эритроцит имеет свой жизненный цикл. За это время он осуществляет около 300 тыс. оборотов в сосудистом русле. За сутки разрушается 1% эритроцитов. Средняя продолжительность жизни эритроцита в организме человека составляет 100-120 сут, у собаки - 107, у кролика и кошки - 68. Химический состав эритроцитов у различных видов животных неодинаков (табл. 11).
Эритроциты отличаются высоким содержанием фосфорных эфиров тиамина - 0,00001%. Главные функции эритроцитов - дыхательная, регуляторная
итранспортная.
Учеловека и млекопитающих они не имеют ядер, обладают ничтожно

малым клеточным дыханием и хорошо выраженным гликолизом (на 1 мл клеток в течение 1 ч образуется 300-700 мг молочной кислоты).
Основной белок эритроцитов - гемоглобин. Каждый эритроцит содержит до 280 млн молекул гемоглобина. До 97% белка сосредоточено внутри клетки. Благодаря гемоглобину эритроциты в 70 раз быстрее насыщаются кислородом, чем плазма. Кровь поэтому имеет высокую кислородную емкость. У взрослых животных в эритроцитах содержится гемоглобин А. У новорожденных в крови преобладает гемоглобин F. С возрастом его содержание в крови уменьшается и исчезает.
Биосинтез гемоглобина происходит в красном костном мозгу, частично - в печени и селезенке, причем глобин и гем синтезируются отдельно. Вначале из глицина и янтарной кислоты образуется порфобилиноген, затем - порфин и, наконец, гем. Источник для биосинтеза гема - железо ферритинов. Известно 24 формы гемоглобина, из которых 3 имеются у здоровых и 21 - у больных животных.
Кроме гемоглобина, эритроциты содержат стромин, образующий вместе с фосфатидами мембранную основу клетки, ферменты карбоангидразу, каталазу, АХЭ, пептидгидролазы и др.
Лейкоциты. Общая масса их - десятые доли процента по отношению к общему количеству форменных элементов крови. В норме содержится 4-10 тыс. лейкоцитов в 1 мм3. Лейкоциты делятся на две группы: гранулоциты (эозинофилы, базофилы, нейтрофилы) и
427
11. Химический состав эритроцитов, % (по Э. Абдергальдену)
Химическое вещество
 Собака
Собака
 Кошка
Кошка
 Свинья
Свинья
 Кролик
Кролик
 Бык
Бык 
 Лошадь
Лошадь
 Овца
Овца 
 Коза
Коза
Вода |
|
64,44 |
|
62,12 |
|
62,56 |
|
63,35 |
|
59,19 |
|
61,32 |
|
60,43 |
|
60,87 |
|
|
|
|
|
|
|
|
|
||||||||
Сухой остаток |
|
35,38 |
|
37,58 |
|
37,44 |
|
36,65 |
|
40,81 |
|
38,68 |
|
39,52 |
|
39,13 |
|
|
|
|
|
|
|
|
|
||||||||
Гемоглобин |
|
32,75 |
|
33,00 |
|
32,68 |
|
33,19 |
|
31,67 |
|
31,51 |
|
30,33 |
|
32,40 |
|
|
|
|
|
|
|
|
|
||||||||
Другие белки |
|
0,99 |
|
2,68 |
|
1,92 |
|
1,22 |
|
6,42 |
|
5,68 |
|
7,85 |
|
5,40 |
|
|
|
|
|
|
|
|
|
||||||||
Холестерин |
|
0,22 |
|
0,13 |
|
0,05 |
|
0,07 |
|
0,34 |
|
0,04 |
|
0,24 |
|
0,17 |
|
|
|
|
|
|
|
|
|
||||||||
Лецитин |
|
0,26 |
|
0,31 |
|
0,35 |
|
0,46 |
|
0,37 |
|
0,40 |
|
0,34 |
|
0,39 |
12. Обмен газов крови животных, об. % (по С. И. Афонскому)
|
|
|
|
|
100 мл |
|
|
|
100 мл |
|
100 мл крови в |
||||||
Животное |
|
артериальной крови |
|
Животное |
|
венозной крови |
|
капиллярах |
|||||||||
|
|
|
содержит |
|
|
|
содержит |
|
воспринимают |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 |
|
|
CO2 |
|
N2 |
|
|
|
O2 |
|
CO2 |
|
O2 |
|
CO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
Лошадь |
|
|
|
14,0 |
|
|
|
49,4 |
|
|
|
- |
|
|
|
Лошадь |
|
|
|
6,7 |
|
|
|
55,9 |
|
|
|
7,3 |
|
|
|
6,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Овца |
|
|
|
10,7 |
|
|
|
45,1 |
|
|
|
1,8 |
|
|
|
Овца |
|
|
|
6,5 |
|
|
|
48,3 |
|
|
|
6,3 |
|
|
|
8,7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
Коза |
|
|
|
14,1 |
|
|
|
42-45 |
|
|
|
- |
|
|
|
Коза |
|
|
|
9,15 |
|
|
|
55,9 |
|
|
|
5,0 |
|
|
|
12,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
Собака |
|
|
|
22,4 |
|
|
|
44,2 |
|
|
|
1,2 |
|
|
|
Собака |
|
|
|
14,5 |
|
|
|
50,1 |
|
|
|
7,9 |
|
|
|
5,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
Курица |
|
|
|
10,7 |
|
|
|
48,1 |
|
|
|
- |
|
|
|
Курица |
|
|
|
4,7 |
|
|
|
47,5 |
|
|
|
6,6 |
|
|
|
9,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
428 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
агранулоциты (лимфоциты, моноциты). Гранулоциты образуются в красном костном мозгу, лимфоциты - в лимфоузлах, селезенке и других органах, моноциты - в красном костном мозгу, селезенке и лимфоузлах. Лейкоциты в 2-3 раза крупнее эритроцитов. Время созревания гранулоцитов длится 8-10 сут, длительность пребывания в сосудах - от 10 ч до 15 сут. Лимфоциты находятся в крови 2-10 ч, затем несколько месяцев мигрируют в другие ткани, превращаясь в макрофаги и плазматические клетки, которые участвуют в иммунологических реакциях.
Химический состав лейкоцитов изучен мало из-за трудностей выделения достаточного количества клеток для химического анализа. Сухой остаток содержит белки (нуклеопротеиды, альбумины и глобулины), частично - липиды, азотистые экстрактивные вещества и минеральные соединения. Химический состав лейкоцитов (по H. Б. Черняку) следующий, мг на 109 клеток:
|
|
|
|
|
|
|
|
|
|
Азот общий |
|
20,38 |
|
Мочевая кислота |
|
0,60 |
|
|
|
|
|
|
|
|
||
|
Азот белка |
|
16,32 |
|
Креатинин общий |
|
3,69 |
|
|
|
|
|
|
|
|
||
|
Азот остаточный |
|
4,06 |
|
Креатинин |
|
2,68 |
|
|
|
|
|
|
|
|
||
|
Креатин |
|
1,01 |
|
Азот аминокислот |
|
1,66 |
|
|
|
|
|
|
|
|
||
|
Фосфор общий |
|
5,71 |
|
Сахар |
|
0,00 |
|
|
|
|
|
|
|
|
|
|
Для лейкоцитов характерна высокая активность ферментов, связанных с деятельностью лизосом: кислой и щелочной фосфатаз, карбоксилэстеразы, липазы, фосфолипаз А и В и др. В лейкоцитах выявлены ЦХО и цитохромпероксидаза, витамины, многие макро- и микроэлементы. Содержание всех этих веществ изменяется при патологии, особенно лейкозах.
Тромбоциты. Тромбоциты, или кровяные пластинки, участвуют в процессах свертывания крови. Образуются в красном костном мозгу. Их форма удлиненно-овальная, размер 2-5 мкм2. У млекопитающих тромбоциты не имеют ядер. Продолжительность жизни 8-11 сут.
При травмировании кровеносных сосудов происходит агрегация и агглютинация тромбоцитов, образуется пластинчатый осадок, вокруг которого выпадают нити фибрина, оседают эритроциты и лейкоциты. Тромбоциты богаты белком, липидами, они содержат также фосфатиды, холестерин, гликоген и около 11 факторов

429
свертывания крови. В сухом остатке тромбоцитов содержатся натрий, калий, кальций, магний, медь, железо и марганец. Тромбоциты отличаются высоким содержанием АТФ, высокой активностью АТФ-азы, АХЭ и др.
Газы крови. В крови содержатся кислород, углекислый газ и азот в свободном и связанном состояниях. Так, 99,5-99,7% кислорода связано с гемоглобином, 0,3-0,5% находится в свободном состоянии.
Газы крови характеризуются постоянным обменом (табл. 12).
Из таблицы 12 следует, что ткани организма из каждых 100 мл артериальной крови извлекают в среднем 5-8% O2 и отдают в кровь 6-12% CO2. Эти процессы протекают благодаря разности парциального давления p газов крови:
|
|
|
|
|
|
|
|
Кровь |
|
p Ο2, кПа |
|
p CO2, кПа |
|
|
|
|
|
|
||
|
Артериальная |
|
13,3 |
|
5,3 |
|
|
|
|
|
|
||
|
Венозная |
|
5,3-6,7 |
|
6,1 |
|
|
|
|
|
|
||
|
Капиллярная |
|
2,7-5,3 |
|
6,7 |
|
|
|
|
|
|
|
|
При уменьшении содержания кислорода в крови на 20-25% наступает кислородное голодание. Причинами могут быть горная болезнь, эмфизема легких, пери- и эндокардиты, отравление инертными, ядовитыми газами и др.
430
422 :: 423 :: 424 :: 425 :: 426 :: 427 :: 428 :: 429 :: 430 :: Содержание

430 :: 431 :: 432 :: 433 :: Содержание
Дыхательная функция крови
Главной функцией эритроцитов является перенос кислорода от легких к тканям и удаление из тканей в окружающую среду углекислого газа. Вдыхаемый воздух содержит 20,9% O2 и 0,03% CO2, выдыхаемый - 15,5-16,3% O2 и 4,1% CO2.
Легкие имеют огромную поверхность соприкосновения с атмосферным воздухом. У обезьяны она достигает 90 м2. Стенки альвеол, альвеолярных мешочков и ходов тканей легкого построены из респираторного эпителия, толщина которого едва достигает 0,004 мм. Через них газы диффундируют в кровь. Процессу диффузии способствует разница между парциальным
430
давлением кислорода и углекислого газа. Так, давление кислорода в окружающем воздухе равно 20,3 кПа, в альвеолярном - 14,7, в венозной крови - 5,3-6,7 кПа. Это и создает оптимальные условия для перехода кислорода из альвеолярного воздуха в кровь, а также выделения углекислого газа из крови в окружающую среду.
Диффундировавший через стенки респираторного эпителия кислород соединяется с гемоглобином, образуя оксигемоглобин (HbO2). В составе артериальной крови HbO2 поступает в органы и ткани. Здесь создаются оптимальные условия для газообмена. В артериях парциальное давление равно 13,3 кПа, в тканях оно уменьшается до 5,3, в межклеточной жидкости - до 0,7- 2,7 кПа. Оксигемоглобин распадается на гемоглобин и кислород. Кислород диффундирует в клетки и используется для клеточного дыхания. Под влиянием ЦХО он вступает во взаимодействие с водородом, образуя воду. В ходе клеточного дыхания изменяются свойства гемоглобина. Так, кислотные свойства HbO2 в 70 раз больше, чем Hb. Поэтому в тканях он легко присоединяет углекислый газ, который затем выделяется в окружающую среду в результате перехода в капиллярах легких HbCO2 в Hb.
Углекислый газ связывается двумя путями: образованием карбогемоглобина и гидрокарбонатов. В первом случае он присоединяется к свободной аминогруппе Hb:
Карбогемоглобин - нестойкое соединение и в тканях легких распадается с отщеплением CO2, который удаляется с выдыхаемым воздухом.
Предполагается, что реакция присоединения и отщепления CO2 к Hb протекает без участия ферментов.
Во втором случае CO2 связывается натриевыми и калиевыми солями белков крови:
431
Эти реакции обратимы. Чем больше парциальное давление CO2, тем больше образуется гидрокарбонатов, и наоборот. В капиллярах легких HHbO2 вытесняет угольную кислоту из гидрокарбонатов:
Под влиянием карбоангидразы угольная кислота распадается на углекислый газ и воду. Углекислый газ удаляется из легких вместе с выдыхаемым воздухом. Участие гемоглобина в газообмене связано с его способностью удерживать рН крови на определенном уровне. Это достигается в результате обмена ионами между плазмой и эритроцитами в тканях организма и в легких (рис. 53). Мембрана эритроцитов пропускает внутрь анионы плазмы (Cl-) и почти непроницаема для катионов (Na+ и K+). Согласно уравнению Доннана, с увеличением парциального давления углекислого газа в капиллярах тканей анионы Сl- переходят в эритроциты, образуя соли с катионами K + гемоглобина.
Катионы Na+ плазмы вступают в реакцию с анионами HCO - , образуя
3
гидрокарбонаты:
Рис. 53. Роль эритроцитов в обмене газов
между тканями и легкими
432
В капиллярах легких под влиянием HbO2 реакция идет в обратном

направлении, что приводит к выделению CO2.
Артериальная кровь различных животных в среднем содержит 0,21 л/л кислорода, венозная - 0,15 л/л. Следовательно, при прохождении артериальной крови через органы и ткани в них задерживается 0,06 л/л кислорода и используется для окисления органических веществ.
Организм массой 70 кг ежесуточно потребляет в среднем 600 л O2 и выделяет 450 л CO2.
Содержание в крови HbO2 зависит от парциального давления кислорода. При его снижении уменьшается содержание HbO2 в крови, что приводит к гипоксемии. При уменьшении содержания кислорода в тканях наступает гипоксия и даже аноксия - прекращение дыхания. Часто причиной аноксии могут быть различные отравления (оксидами азота, мышьяковистыми соединениями, угарным газом и др.), что приводит к образованию стойких форм производных гемоглобина - метгемоглобина или карбоксигемоглобина.
433
430 :: 431 :: 432 :: 433 :: Содержание

433 :: 434 :: Содержание
Свертывание крови
Защитная реакция организма, предохраняющая его от кровопотерь при ранении кровеносных сосудов, проявляется в свертывании крови. При этом образуется эластический сгусток, который закрывает просвет сосуда, и прекращается кровотечение. Скорость свертывания крови уменьшается при понижении температуры. Так, у коровы при 25°C кровь свертывается через 6,6- 10 мин, при 10° С - через 20 мин.
Номенклатура факторов свертывания крови. В процессе свертывания крови принимают участие плазменные и тромбоцитарные факторы. Плазменные факторы обозначаются римскими цифрами:
Фибриноген |
I |
Проконвертин (конвертин) |
VII |
Протромбин |
II |
Глобулин А |
VIII |
|
|
Кристмас-фактор |
|
Тромбопластин |
III (антигемофильный глобулин |
IX |
|
|
|
В |
|
Кальций |
IV Стюарт-проувер-фактор |
X |
|
Ас-глобулин плазмы |
V |
|
|
Ас-глобулин сыворотки |
VI |
|
|
Предшественники плазменного |
XI |
Фибринстабилизирующий |
XIII |
тромбопластина (РТА) |
|
фактор (фибриназа) |
|
Хагеман-фактор |
XII Профибринолизин |
Плазминоген |
|
|
|
Фибринолизин |
Плазмин |
|
|
Антифибринолизин |
Антиплазмин |
433
Тромбоцитарные факторы обозначаются арабскими цифрами:
фактор 1 - вещество, превращающее протромбин в тромбин, по химической природе близкое к фактору V;
фактор 2 - вещество, ускоряющее превращение фибриногена в фибрин в присутствии тромбина;
фактор 3 - имеет фосфолипидную природу и обладает тромбопластической активностью;
фактор 4 - выделен как фракция фактора 3, обладает антигепариновой активностью. В процессе участвуют вещества типа антифибринолизина, фибриназы, ретрактоэнзим (тромбостенин) и некоторые другие агенты (например, гепарин).

434
433 :: 434 :: Содержание

434 :: 435 :: 436 :: 437 :: Содержание
Химическая природа основных факторов свертывания крови
Ф и б р и н о г е н - белок плазмы крови. Относится к глобулинам. Молекулярная масса - 340-400 тыс. Синтезируется в печени. Содержание в плазме - 4-7,5 г/л. Под влиянием тромбина превращается в фибрин. Препараты фибрина применяют как кровоостанавливающее средство в виде гемостатической губки и пленки.
П р о т р о м б и н - белок плазмы крови, глюкопротеид. Молекулярная масса протромбина лошади - 130 тыс., быка - 68 500. Предшественник тромбина. Синтезируется в печени при наличии витамина К. Превращается в тромбин под влиянием тромбопластина. Молекула тромбина состоит из двух полипептидных цепей: А и Б. В Б-цепи локализирован активный центр и размещена углеводная часть. Кроме превращения фибриногена в фибрин, фермент осуществляет сжатие (ретракцию) кровяного сгустка.
Т р о м б о п л а с т и н - белково-липидный комплекс, вызывающий превращение протромбина в тромбин в присутствии ионов Ca2+. Молекулярная
434
масса - 170 тыс. В неактивном состоянии входит в состав тромбоцитов. Тромбопластином богаты клетки костного мозга, легких и селезенки. После ранения из разрушенных тромбоцитов и других клеток поступает в кровь и превращается в активную форму.
Г л о б у л и н ы , у с к о р я ю щ и е с в е р т ы в а н и е к р о в и. К ним относятся факторы свертывания крови: V, VI, VII, VIII, IX, X, XI и XII. Принадлежат к отдельным фракциям и подфракциям глобулинов. Образуются в печени и клетках ретикуло-эндотелиальной системы. Обладают высокой биологической активностью: период полураспада их молекулы составляет от 5070 ч до 4 ч.
Фактор XIII - фермент плазмы, способствующий полимеризации фибринмономеров в фибрин-полимер. Влияет на образование пептидных связей между остатками аминокислот - растворимый фибрин переходит в нерастворимый. Стабилизируется сгусток фибрина. Реакция протекает в присутствии ионов
Ca2+.
Π л а з м и н (фибринолизин, фибринокиназа) - фермент плазмы, предохраняющий организм от тромбозов. Осуществляет расщепление фибриногена и фибрина. Находится в плазме в виде профибринолизина. Молекулярная масса - 90 500. Антагонистами являются α1-, α2- и β-глобулины крови. Вместе с гепарином используется при лечении тромбозов. Ингибируется антифибринолизинами.
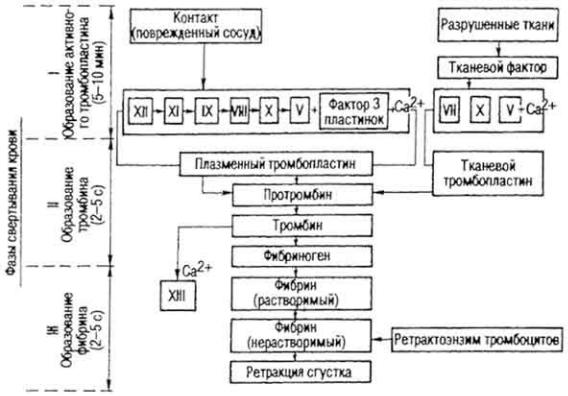
Г е п а р и н (антитромбин) - гликозаминогликан, построенный из остатков глюкуроновой кислоты, глюкозамина и серной кислоты. Молекулярная масса - 15-20 тыс. Замедляет свертываемость крови. Антикоагулянт.
Химизм свертывания крови. В процессе свертывания крови различают три фазы и одну послефазу (рис. 54).
П е р в а я ф а з а. При травме разрушаются тромбоциты и другие клетки. Фактор XII активируется и превращается в фактор XIIa. Под его влиянием происходит ряд последовательных реакций, в которые вовлекаются все присутствующие в крови факторы, начиная от XI до V. Возникают тромбопластины.
В т о р а я ф а з а. Под влиянием плазменного и тканевого тромбопластинов и ионов Ca2+ протромбин (фактор II) превращается в тромбин (фактор IIа).
435
Рис. 54. Схема
|
свертывания крови (по Л. M. Ишимовой) |
Т р е т ь я |
ф а з а. Под влиянием тромбина фибриноген вначале |
превращается в растворимый фибрин-мономер, затем, при действии фибринстабилизирующего фактора XIII и ионов Ca2+, - в нерастворимый фибрин-полимер. В сложно переплетенных нитях фибрина оседают форменные элементы крови. Возникает кровяной сгусток, закрывающий просвет травмированного сосуда.
П о с л е ф а з а . Образовавшийся кровяной сгусток уплотняется (ретрактирует). При этом выделяется сыворотка крови. Тромбин адсорбируется

на нитях фибрина. Тромб становится основой для регенерации стенки сосуда. К ней мигрируют соединительнотканные клетки, возникают соединительнотканные волокна, восстанавливаются эндотелий, мышечная и внешняя оболочки сосуда.
В регуляции свертывания крови участвуют двигательная область коры больших полушарий головного мозга, симпатические и парасимпатические участки вегетативной нервной системы, гипоталамус, гипофиз, корковое и мозговое вещество надпочечников, щитовидная железа, половые железы. Так, адреналин,
436
кортизон, соматотропин, вазопрессин, оцитоцин, тестостерон, прогестерон и некоторые другие гормоны ускоряют этот процесс, тироксин замедляет.
В клинической практике часто применяют переливание крови. Из крови готовят лечебные препараты - иммунные сыворотки, плазму, эритроцитарную и лейкоцитарную массу, фибринные губки и пленки, тромбин и др.
437
434 :: 435 :: 436 :: 437 :: Содержание

437 :: 438 :: Содержание
Лимфа
Лимфа вместе с кровью составляет систему циркулирующих жидкостей в организме, которые омывают все органы и ткани, обеспечивая доставку питательных веществ и удаление продуктов распада. Лимфа - прозрачная или слабоопалесцирующая жидкость, с приторным запахом, соленая на вкус. Во время пищеварения лимфа, оттекающая от кишок, приобретает молочный цвет из-за наличия в ней жировых капелек. Ее называют млечным соком, или
хилусом.
Плотность лимфы составляет 1,012-1,026, относительная вязкость - 1,0-1,5, рН 7,4-9, поверхностное натяжение - 1,0-1,02. Общее содержание лимфы достигает уровня содержания крови. Химический состав лимфы и плазмы крови сходен (табл. 13).
13. Химический состав лимфы и плазмы крови, мг на 100 г(по Д. Л.
Фердману)
|
|
|
|
|
|
|
|
|
|
Вещество |
|
Лимфа шейного |
|
Лимфа грудного |
|
Плазма |
|
|
|
ствола |
|
протока |
|
крови |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
Вода |
|
95 |
|
94 |
|
90 |
|
|
|
|
|
|
|
|||
|
Белки |
|
2 |
|
4 |
|
7 |
|
|
|
|
|
|
|
|||
|
Фибриноген |
|
- |
|
40 |
|
300 |
|
|
|
|
|
|
|
|||
|
Глюкоза |
|
100 |
|
110 |
|
100 |
|
|
|
|
|
|
|
|||
|
Натрий |
|
330 |
|
330 |
|
320 |
|
|
|
|
|
|
|
|||
|
Калий |
|
23 |
|
24 |
|
20 |
|
|
|
|
|
|
|
|||
|
Кальций |
|
10 |
|
11 |
|
10 |
|
|
|
|
|
|
|
|||
|
Магний |
|
3 |
|
3 |
|
1,8 |
|
|
|
|
|
|
|
|||
|
Хлор |
|
420 |
|
410 |
|
370 |
|
|
|
|
|
|
|
|
|
|
|
Фосфор |
|
3 |
|
4 |
|
3,7 |
|
|
неорганический |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
П р и м е ч а н и е . Содержание воды и белков приводится в процентах.
437
В общий белок лимфы крупного рогатого скота входят альбумины, α-, β-, γ- глобулины. Фибриногена в лимфе в 4-5 раз меньше, чем в крови. Остаточного азота всего лишь 0,03%. Лимфа богата лейкоцитами. Так, в лимфе крупного рогатого скота содержится в среднем 7100 лейкоцитов на 1 мм 3. Из них лимфоциты составляют 86 %; моноциты - 5,1; нейтрофилы - 1,2; эозинофилы - 2,5; переходные элементы - 0,3; неопределенные - 2,9%. Состав лимфы изменяется при патологии.

Контрольные вопросы
1.Охарактеризуйте основные физико-химические свойства крови различных видов животных.
2.Каков химический состав крови (плазмы, сыворотки и форменных элементов) у различных видов животных?
3.Как происходит свертывание крови и какие вещества в нем участвуют?
4.Что общего и чем различается химический состав лимфы и
438
437 :: 438 :: Содержание

438 :: 439 :: 440 :: 441 :: Содержание
ГЛАВА 4
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Соединительная ткань составляет более 50% общей массы животного организма. Она выполняет ряд жизненно важных функций - структурную, метаболическую, защитную и репаративную. Существует несколько типов и видов соединительной ткани. Так, различают рыхлую и плотную волокнистую неоформленную соединительную ткань, плотную оформленную волокнистую соединительную ткань и соединительную ткань со специализированными свойствами (жировую, пигментную, ретикулярную). Некоторые виды соединительной ткани имеют самостоятельное значение - кровь, костная, хрящевая ткани и др. Первые две рассматриваются в отдельных главах. Из всех типов и видов ткани наиболее распространена в организме рыхлая неоформленная соединительная ткань, содержащая все виды клеток и межклеточных структур, характерных для соединительной ткани в целом.
Соединительная ткань состоит из клеток, основного вещества, или субстанции, и волокон (коллагеновых, эластических, ретикулярных). Для клеток (фибробластов и фиброцитов, гистиоцитов и тучных) характерен хорошо развитый аппарат биосинтеза белков
438
Рис. 55. Строение
коллагенового волокна: А - схема: I -. полипептидная цепочка; II - молекулы коллагена (тропоколлаген); III - протофибриллы; IVфибрилла минимальной толщины, у которой становится видимой поперечная исчерченность; V - коллагеновое волокно; Б - спиральная структура макромолекулы коллагена (по Ричу); мелкие светлые кружки - глицин, крупные светлые кружки - пролин, заштрихованные кружки - гидроксипролин; В - коллагеновая фибрилла под электронным микроскопом (х200 000). В темных и светлых дисках видны внутренние, вторичные полосы (препарат M. H. Павловой)
439
(высокое содержание РНК, наличие ферментных систем энергетического обмена, многих синтетаз и др.). В клетки из крови и межклеточной жидкости поступают различные вещества (аминокислоты, моносахариды, жирные кислоты, соли и др.). В клетках образуются оксипролин и оксилизин. Из аминокислот на рибосомах
Рис. 56. Образование межклеточного вещества: 1 - фибробласт; 2 - полипептидные цепочки; 3 - молекулы тропоколлагена; 4 - гликозаминогликаны; 5 - полимеризация молекул тропоколлагена, 6 - протофибрилла; 7 - пучок протофибрилл (коллагеновая фибрилла); 8 - молекула эластина; 9 - эластическая фибрилла (по Кристичу с изменением)
440
клеток (например, фибробластов) синтезируются полипептидные α-цепочки (рис. 55 и 56). Три такие цепочки обвивают друг друга и образуют молекулу проколлагена или тропоколлагена. Через поры наружной плазматической мембраны молекулы тропоколлагена выделяются в межклеточное пространство, участвуя в формировании основного вещества соединительной ткани. Здесь происходит их полимеризация, что приводит к образованию длинных (4-12 нм) протофибрилл. Одновременно в клетках (в комплексе Гольджи) синтезируются молекулы гликозаминогликанов, которые таким же путем выделяются в межклеточное вещество. Полимерные цепочки протофибрилл, используя энергию АТФ, с помощью водородных связей соединяются между собой и при

участии молекул гликозаминогликанов образуют пучки фибрилл (12-30 нм). Они и формируют коллагеновые волокна. Аналогично образуются и другие волокна, в частности эластические (клетками типа фибробластов, гладкомышечными) и ретикулярные (ретикулоцитами, тучными клетками, звездчатыми клетками печени). Часть секрета клеток идет на образование основного вещества соединительной ткани вместе с соединениями, которые сюда поступают с током крови. Основное вещество соединительной ткани составляет около 20% массы животного организма и в зависимости от типа и вида ткани имеет неодинаковый химический состав (костная и хрящевая ткань, дентин и др.).
441
438 :: 439 :: 440 :: 441 :: Содержание

441 :: 442 :: 443 :: Содержание
Химический состав соединительной ткани
Как и другие ткани, соединительная ткань состоит из воды и сухого остатка. В сухой остаток входят органические и минеральные вещества (табл. 14).
Из таблицы 14 видно, что главный белок ткани - коллаген. Он составляет 25-33% всех белков организма и 6% общей массы тела. Его молекулярная масса - 120 тыс. Каждая молекула состоит в среднем из 1000 аминокислотных остатков, треть из которых представлена глицином, 11 % - пролином, 3- и 4- оксипролинами, 11 % - аргинином. Коллаген здесь синтезируется фибробластами, в других типах ткани - их аналогами: в костной - остеобластами, в хрящевойхондробластами. Поэтому и волокна называют коллагеновыми,
441
14. Химический состав соединительной ткани быка (по С. И. Афонскому)
|
|
|
|
|
|
|
|
Вещество |
|
Ахиллово сухожилие, % |
|
Выйная связка, % |
|
|
|
|
|
|
||
|
Вода |
|
63,0 |
|
57,6 |
|
|
|
|
|
|
||
|
Плотные вещества |
|
37,0 |
|
42,4 |
|
|
|
|
|
|
|
|
|
В том числе: |
|
|
|
|
|
|
|
|
|
|
||
|
липидов |
|
2,8 |
|
2,7 |
|
|
|
|
|
|
||
|
коллагена |
|
85,1 |
|
17,0 |
|
|
|
|
|
|
||
|
эластина |
|
4,39 |
|
75,0 |
|
|
|
|
|
|
||
|
протеогликанов |
|
3,46 |
|
1,2 |
|
|
|
|
|
|
||
|
альбумина и глобулина |
|
0,59 |
|
1,4 |
|
|
|
|
|
|
||
|
экстрактивных веществ |
|
3,20 |
|
2,3 |
|
|
|
|
|
|
||
|
неорганических веществ |
|
0,46 |
|
0,40 |
|
|
|
|
|
|
|
|
оссеиновыми и хондриновыми. У животных имеется четыре типа коллагена: I - кожи, костей и сухожилий; II - хряща; III - стенок кровеносных сосудов и кожи эмбрионов; IV - соединительных мембран. Они отличаются аминокислотным составом и строением молекул.
Второй белок соединительной ткани - эластин. Фибриллярный белок, придающий упругость кожи, легочной ткани, связкам, кровеносным сосудам. Его предшественник - тропоэластин, секретируется фибробластами и гладкомышечными клетками в виде полипептидной цепи. Молекулярная масса - 100 тыс. Богат остатками глицина, аланина и валина, беден - остатками полярных аминокислот. После синтеза подвергается посттрансляционной модификации, которая заключается в ограниченном протеолизе и образовании

поперечных связей. Последние возникают между полипептидными цепочками после окисления боковых цепей лизина и конденсации альдегидных групп. Образуется сложная полипептидная сеть, обусловливающая упругость белковой молекулы и ее нерастворимость в воде.
В составе основного вещества имеются белки и полисахариды, образующие между собой комплексные соединения различной молекулярной структуры и прочности. Они представлены двумя группами - протеогликанами и гликопротеидами. Протеогликаны составляют около 30% сухой массы ткани. В их молекуле на углеводную часть приходится 95% общей массы, на белковую - 5%. Обе части связаны друг с другом пептидными связями. Углеводы здесь представлены
442
гиалуроновой кислотой, хондроитинсульфатами А, В и С, кератан-сульфатом, гепаран-сульфатом или гепарином.
Значительная часть основного вещества ткани является гликопротеидами (гликопротеинами) - сложными белками, молекула которых состоит из простого белка (до 96% общей массы) и углеводной группы (до 4%). Последняя состоит из 2-15 мономерных единиц (гексозаминов, гексоз, сиаловых кислот, фукозы) и присоединена к белку ковалентно. Молекулярная масса гликопротеидов -15 тыс. -1 млн. Углеводная часть обеспечивает для гликопротеидной молекулы необходимую конфигурацию, защищает от протеолиза, обеспечивает беспрепятственное транспортирование и придает ей иммунологические свойства. Существует несколько групп гликопротеидов, различных по химической структуре молекул, свойствам и значению.
443
441 :: 442 :: 443 :: Содержание

443 :: 444 :: Содержание
Обмен веществ в соединительной ткани
Для соединительной ткани характерна высокая степень метаболизма. Так, период полураспада молекулы гиалуроновой кислоты - около 2 сут, хондроитинсульфатов основного вещества кожи - 2, хряща - 16 сут. Химический состав ткани изменяется в онтогенезе, при функциональных нагрузках и в патологии. Например, основа кожи свиного эмбриона содержит большие количества гиалуроновой кислоты и следы хондроитинсульфатов. У взрослых свиней здесь уже преобладают хондроитинсульфаты. В ходе развития и с наступлением старости в ткани постепенно уменьшается содержание гликозаминогликанов и возрастает содержание коллагена и эластина.
Обмен веществ в ткани регулируется нейрогуморально. Прежде всего, такая регуляция осуществляется корой больших полушарий мозга, симпатическими и парасимпатическими нервными окончаниями, медиаторами. Соматотропин стимулирует включение пролина в полипептидную цепь тропоколлагена и превращению его в коллаген. Минералокортикоиды способствуют пролиферации фибробластов, превращению их в фиброциты и биосинтезу ими основного вещества ткани. Тироксин активирует ферментные системы, деполимеризующие
443
гиалуроновую кислоту. Глюкокортикоиды тормозят биосинтез коллагена и гликозаминогликанов.
444
443 :: 444 :: Содержание

444 :: Содержание
Биохимические изменения соединительной ткани при патологии
Обмен веществ в соединительной ткани нарушается при многих заболеваниях, и прежде всего при коллагенезах. К последним относятся ревматизм, ревматический артрит, системная красная волчанка, склеродермия, дерматомиозит, узелковый полиартрит и др. При многих из них набухают и дегенерируют коллагеновые волокна, происходит замена коллагена фибриноидом, прогрессирует деполимеризация гликозаминогликанов до мономеров, особенно гиалуроновой кислоты, активируются ферменты лизосом, происходит распад и даже разложение соединительнотканных структур. Коллагенозы могут возникать и на животноводческих комплексах, где животные подвержены вынужденной гипокинезии и не получают нужных моционов.
Контрольные вопросы
1.Что вам известно о соединительной ткани, ее отдельных видах, биологическом значении и биосинтезе ее составных частей?
2.Охарактеризуйте химический состав соединительной ткани, обмен веществ в ней у клинически здорового организма и при патологии.
444
444 :: Содержание

444 :: 445 :: Содержание
ГЛАВА 5
БИОХИМИЯ КОСТНОЙ ТКАНИ
Костная ткань представляет собой специализированный вид соединительной ткани. Составляет 6-13% общей массы организма. Различают компактную и губчатую костные ткани. Примером компактной ткани может быть ткань диафизов трубчатых костей, примером губчатой - ткань эпифизов трубчатых костей.
Костная ткань состоит из межклеточного вещества и клеток. Межклеточное вещество богато минеральными соединениями, которые придают костям необходимую прочность и стойкость к внешним воздействиям. В нем размещаются в виде плотных пучков оссеиновые
444
волокна и клетки - остеоциты и остеокласты. Межклеточное вещество имеет пластинчатую или волокнистую структуру.
При пластинчатой структуре оно располагается в виде пластинок вокруг кровеносных сосудов - остеонов. Каждый остеон состоит из 5-10 и больше пластинок. В остеоне волокна идут в определенном направлении. В волокнистой костной ткани оссеиновые волокна размещены беспорядочно. Межклеточное вещество возникает вследствие деятельности остеобластов, которые по мере образования костной ткани "замуровываются" в ней, превращаясь в остеоциты. Кроме того, в костной ткани функционируют остеокласты, осуществляющие ее резорбцию.
445
444 :: 445 :: Содержание

445 :: 446 :: Содержание
Химический состав костной ткани
Костная ткань животных состоит из твердых веществ (75-80%) и воды (2025%). Из общей массы твердых веществ в среднем 60% приходится на неорганические и 40% - на органические соединения. Межклеточное вещество компактной ткани на 20% состоит из органических и на 80% - из неорганических веществ. Губчатая ткань содержит 50% органических компонентов, 35-40% - минеральных веществ и 10-15% - воды.
Органические вещества костной ткани. Органические вещества костной ткани - это нуклеиновые кислоты, белки, липиды, углеводы, различные другие соединения и продукты обмена. 95% этих веществ составляет коллаген. Коллаген костной ткани имеет такую же структуру молекулы, что и в других тканях. Для него характерно высокое содержание остатков глицина, оксипролина, оксилизина, он беден остатками тирозина, гистидина, метионина, не содержит триптофана и цистеина. Алании составляет 1/9 общего числа
аминокислот, пролин и оксипролин - 2/9. Ткань содержит ферменты шести классов и рад изоферментов (ЛДГ).
В костной ткани в среднем содержится около 3,2% гликозаминогликанов, которые находятся в свободном и связанном состоянии. Это хондроитин-4- сульфат, хондроитин-6-сульфат, гиалуроновая кислота,
445
кератаносульфаты. Гликозаминогликаны участвуют в формировании тканевого каркаса, образовании фибрилл коллагена, регуляции водного обмена и др. В костной ткани содержится 50-80 мкг/г влажной ткани гликогена, которым насыщена цитоплазма остеобластов. Остеоциты не содержат углевода.
В компактной ткани трубчатых костей содержится 0,1-0,7% липидов. Костная ткань содержит большие концентрации лимонной кислоты: до 1 % общей массы - важного фактора регуляции кальциевого обмена в организме животного.
Минеральные вещества костной ткани. В костной ткани откладываются многие макро- и микроэлементы. В ней сосредоточено около 99% Ca, 87% P и 58% Mg. Здесь содержится свыше 30 микроэлементов: Cu, Sr, Ba, Zn, Al, Be, Si, F, Pb и др. В золе костей есть фосфаты и карбонаты кальция, фосфаты магния, фториды кальция и другие соли.
Минеральные вещества образуют кристаллы размером от 20 x 3 до 20 x 7 нм. Структура кристаллов и их размеры обеспечивают максимальный обмен между костной тканью и межклеточной жидкостью. Активная поверхность 1 г костей ткани составляет 130-260 м2. Кристаллы откладываются в основном веществе и в коллагеновых волокнах. В. Ньюман и M. Ньюман (1961)
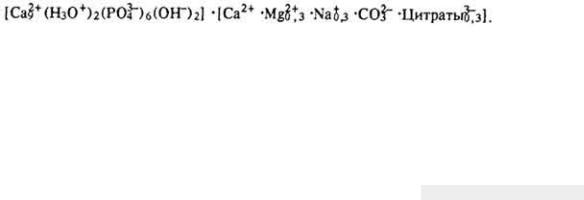
предложили такой химический состав кристаллов:
Основой аморфных соединений костной ткани служит аморфный фосфат кальция, содержание которого уменьшается с возрастом. Так, в ткани бедренной кости восьмидневной крысы содержится аморфного фосфата кальция 69,5%, у 264-дневной - 35,5%.
446
445 :: 446 :: Содержание

446 :: 447 :: Содержание
Процессы минерализации костной ткани
Процессы образования костной ткани в эмбриогенезе и в постнатальной жизни протекают в основном однотипно. В остеобласты поступает "сырье" для биосинтеза нуклеиновых кислот, белков, липидов, углеводов, минеральных соединений и других веществ. Из глюкозы образуется гликоген. Гликоген и глюкоза подвергаются анаэробному расщеплению.Образовавшиеся
446
при этом лактат и пируват поступают в цикл трикарбоновых кислот. Ткань получает АТФ, АДФ, гексофосфорные эфиры и другие соединения. Гексозофосфаты расщепляются гидролазами:
Образовавшаяся ортофосфорная кислота может взаимодействовать с хлоридом кальция, который поступает с током крови:
Одновременно остеобласты синтезируют коллаген и гликозаминогликаны. Частицы коллагена проникают во внеклеточное пространство, образуя межклеточное вещество. Часть из них уплотняется, формируя протофибриллы, фибриллы и оссеиновые волокна. В межклеточное вещество из остеобластов выделяются частицы гликозаминогликанов, которые адсорбируют ионы Ca 2+ и фосфат-ионы, частично - соли. Активируются кислые гидролазы лизосом. Возрастает проницаемость мембран остеобластов. Ферменты проникают во внеклеточное пространство и активируют реактивные группы коллагена (-NH2, - COOH, -SH). Эти группы взаимодействуют с фосфатами. Возникают ядра кристаллизации. Ионы Ca2+ и фосфат-ионы, адсорбированные ранее гликозаминогликанами, освобождаются и концентрируются вокруг ядер, образуя первые микрокристаллы костных солей. Далее формируется типичная костная ткань. Процессы образования костной ткани регулируются центральной нервной системой, гормонами, многими ферментами. Процесс образования костей зависит от состава корма, а именно: наличия в нем нужных минеральных веществ, витаминов, особенно A, D, С и др.
447
446 :: 447 :: Содержание

447 :: 448 :: 449 :: Содержание
Обмен веществ в костной ткани
Для костной ткани характерна высокая степень метаболизма. Это связано с выполнением ею ряда жизненно важных функций, к которым в первую очередь следует отнести участие в регуляции минерального гомеостаза, кроветворении, функции опоры и защиты.
447
Как и весь организм, кости вначале растут, затем находятся в состоянии динамического равновесия, потом наступает старение. С возрастом в костной ткани уменьшается содержание общего азота и гликозаминогликанов, снижается активность многих ферментов, возрастает прочность коллагена.
Костная ткань - это подвижный резерв минеральных веществ. Так, скорость протекания крови по сосудам кости собаки и кролика составляет 10 мл/мин на 100 г сырой массы. Количество кальция з костной ткани может уменьшаться или увеличиваться в зависимости от его содержания в плазме крови. Высвобождение кальция осуществляется разрушением ткани остеокластами, а его связывание - новообразованием костной ткани остеобластами и остеоцитами. Костная ткань скелета человека практически полностью обновляется через каждые 10 лет. При недостатке кальция в плазме крови в костной ткани под влиянием паратгормона возрастает концентрация лимонной и молочной кислот. Увеличивается сН, что способствует растворению кристаллов, деполимеризации гликозаминогликанов и активизации остеокластов. У растущих животных за сутки в костях откладывается 6,2% кальция и выделяется 4,7%.
Скорость обмена костного коллагена у взрослых животных в 3-10 раз выше, чем в сухожилиях и соединительной основе кожи. Для костной ткани характерна высокая активность α-амилазы, осуществляющей гидролитическое расщепление гликогена, концентрация которого уменьшается в период минерализации. Содержание стеридов возрастает по мере увеличения скорости минерализации, а триглицеридов - уменьшается.
Обмен веществ в костной ткани зависит от состава рациона и физиологической нагрузки животного. Так, недостаток кальция в рационе приводит к нарушениям процессов костеобразования у молодняка и у взрослых животных. Недостаток витамина D в рационе и содержание животных в темных неосвещенных помещениях приводит к возникновению рахита у молодняка. У животных, которые содержатся на бедном белковом рационе, содержание кальция в организме уменьшается на 10-12%. Избыток жиров в рационе отрицательно сказывается на усвоении кальция организмом. Усвоение кальция нарушается при избытке в рационе
448

фосфоpa, стронция, свинца, серебра, цинка и др., а также при гипокинезии в промышленных животноводческих комплексах.
449
447 :: 448 :: 449 :: Содержание

449 :: Содержание
Зубы
Различают коронку, шейку и корень зуба. Основная масса его - дентин, в области коронки покрыт эмалью, в области шейки и корня - цементом.
Эмаль - самая твердая ткань организма. Минеральная основа эмали - кристаллы гидроксиапатита размером 40x160 нм. Эмаль богата цитратом (0,1%). Очень твердая она у бобра. Минеральной основой дентина являются кристаллы гидроксиапатита размером 32 нм. Дентин содержит коллаген, гликозаминогликаны, цитрат.
Цемент - разновидность соединительной ткани. По химическому составу напоминает костную ткань. Богат минеральными веществами и коллагеном.
Пульпа состоит из рыхлой соединительной ткани. В наружном слое размещены одонтобласты, участвующие в образовании дентина и эмали.
Обмен веществ в зубной ткани протекает медленно. Он регулируется гормонами паращитовидной и щитовидной желез, передней доли гипофиза и центральной нервной системой.
Зубная ткань поражается при кариесе. Кариес зубов характеризуется нарушениями кальциевого и фосфорного обменов, разрушением плотных тканей зубов и образованием полостей. Причиной заболевания является недостаточное количество в кормах и воде йода, фтора, железа, молибдена, цинка, кальция, витаминов B1, B4, B12 и С. Кариес может быть вызван механическими повреждениями.
Контрольные вопросы
1.Какие особенности химического состава костной ткани вы знаете?
2.Как протекает обмен веществ в костной ткани у клинически здоровых и больных животных?
449
449 :: Содержание

450 :: 451 :: Содержание
ГЛАВА 6
БИОХИМИЯ ПЕЧЕНИ
Печень - крупнейшая дольчатая железа, выполняющая одновременно функции органа пищеварения, обезвреживания ядовитых продуктов, кровообращения и обмена многих жизненно важных веществ. Печень составляет 1,1-2,5% общей массы организма животного.
Основной структурной и функциональной единицей печени является печеночная долька (рис. 57). Она состоит из гепатоцитов, образующих печеночные балки. Между дольками размещается междолькозая соединительная ткань с триадой - междольковыми артерией, веной и желчным протоком, в центре дольки проходит центральная вена. Между печеночными балками размещены печеночные синусоиды, построенные из
Рис. 57. Схема васкуляризации
печеночной дольки (по У. Грау и В. Вальтеру): 1 - ветвь воротной вены; 2 - ветвь печеночной артерии; 3 - желчный проток; 4 - пучки соединительной ткани; 5 - центральная вена; 6 - внутридольковая капиллярная система
450
купферовых клеток. Гепатоциты составляют 70% клеток доль ки, купферовы клетки - 30%. В них осуществляются основные биохимические процессы, характерные для печени.

451
450 :: 451 :: Содержание

451 :: Содержание
Химический состав тканей печени
Ткань печени содержит 70-75% воды, 25-30% сухого остатка, который состоит из органических и минеральных веществ. Основой сухого остатка являются белки, липиды и углеводы. Минеральные вещества в ткани не превышают 1%.
Химический состав печени сельскохозяйственных животных (по С. И. Афонскому) следующий:
Вещество |
Содержание, % Вещество |
Содержание, % |
|
Вода |
70 |
Холестерин |
0,3-0,5 |
Твердые вещества |
30 |
Натрий |
0,2 |
Белки |
13 |
Калий |
0,3 |
Глобулины |
10 |
Хлор |
0,15 |
Альбумины |
2 |
Кальций |
0,012 |
Гликоген |
1,5-2 |
Магний |
0,023 |
Глюкоза |
0,1 |
Железо |
0,010 |
Жиры |
2 |
Цинк, медь, марганец и др. |
0,1-0,006 |
Фосфатиды |
2-3 |
|
|
451
451 :: Содержание

451 :: 452 :: 453 :: 454 :: Содержание
Обмен веществ в тканях печени
Для печени характерна высокая степень метаболизма. Так, капиллярная сеть печени человекообразных обезьян имеет поверхность до 400 м2, что обеспечивает прохождение через орган в течение суток до 2100 л крови. При прохождении крови печень поглощает около 15% всей энергии. Ткани печени обладают высокой степенью регенерации. Так, после хирургического удаления 3/4 органа у собак и кошек восстановление в прежних размерах происходит через 30-40 сут. Все виды обмена веществ в той или иной мере связаны с деятельностью печени.
Значение печени в азотистом обмене. На долю печени приходится около 13% всего белкового обмена. В печени синтезируется половина всех белков организма: 100% альбуминов и 80% глобулинов крови, весь
451
фибриноген, протромбин и другие белки. Здесь образуется ферритин. Белки печени полностью обновляются в течение недели (в других органах - за 17 сут и больше). Материалом для образования белков служат аминокислоты и другие соединения, поступающие с током крови из пищевого канала и других органов. В печени происходит синтез многих аминокислот и их обмен.
Печень - основной орган, в котором происходит обезвреживание аммиака и других ядовитых азотистых соединений.
Значение печени в углеводном обмене. В печени происходит биосинтез и расщепление различных углеводов. Прежде всего, печень поддерживает в организме определенное содержание глюкозы, поступающей сюда из тонкой кишки с током крови. В среднем 3% глюкозы превращается в гликоген, до 30% - в жирные кислоты, 50% служит источником энергии. Эти процессы регулируются нейрогуморальными путями и самой тканью печени через активирование и ингибирование соответствующих ферментных систем. Инсулин способствует биосинтезу гликогена из моноз, адреналин и глюкагон - его распаду. В печени около 80% молочной кислоты, образовавшейся при анаэробном распаде углеводов, идет на ресинтез гликогена. Содержание гликогена в печени колеблется в пределах 1,5-20% общей массы органа.
При недостатке глюкозы в крови и тканях печени происходит гликонеогенез. На уровень сахара в крови оказывают влияние натрий и калий. Ионы K+ способствуют синтезу гликогена, ионы Na +-распаду. Их содержание в крови регулируется гормоном альдостероном. Химическая энергия углеводов освобождается при анаэробном гликогенолизе или гликолизе, в цикле трикарбоновых кислот и пентозофосфатном пути.
Значение печени в липидном обмене. Из тонкой кишки через воротную
вену в печень поступают липиды, синтезированные в кишечной стенке и частично за счет кормов. Содержание липидов здесь колеблется от 3 до 8%, а в отдельных случаях - до 30% сухого остатка. Основную массу составляют фосфатиды (около 90%).
В печени происходит распад и синтез жиров. Жирные кислоты подвергаются различным превращениям:
452
удлинению или укорочению углеродных цепей, дегидрированию, β-окислению, использованию в качестве материала для биосинтеза молекул других липидов. Образуются жиры, свойственные для данного вида животного. Распад высших жирных кислот начинается в печени и завершается в других органах и тканях. При болезнях печени в моче появляются ацетоновые тела.
Печень - главный орган биосинтеза фосфатидов. Часть их используется самой печенью для процессов физиологической регенерации, основная же масса с током крови доставляется к различным органам и тканям. Для образования молекулы фосфатида используются вещества, синтезированные в гепатоцитах (глицерин, высшие жирные кислоты), и соединения, поступившие из кормов (холин, инозит, метионин). Особенно много фосфатидов расходуется у коров во время лактации, у домашней птицы - во время яйцекладки.
Печень - орган, где активно протекает обмен стеринов и стеридов. Источник для биосинтеза холестерина - ацетил-КоА. Так, после прохождения через ткани печени жидкостей (например, крови), богатых ацетил-КоА, содержание в них холестерина возрастает до 30%. В печени из холестерина и высших жирных кислот образуются стериды и желчные кислоты. Холестерин и стериды откладываются в купферовых клетках, после чего используются для различных нужд организма, 40% всего холестерина превращается в желчные кислоты. Избыток холестерина выделяется с мочой.
Значение печени в обмене минеральных веществ. В печени протекает активный водно-солевой обмен. Так, избыток воды, поступающей из крови, используется для образования лимфы и желчи. В печени образуется 1/2-1/3 всей лимфы организма. Печень участвует в поддержании кислотно-щелочного равновесия организма. Она - депо для многих минеральных веществ. Минеральные вещества здесь находятся в виде солей, кислот, ионов, биокомплексных соединений. В печени депонируется в виде ферритина около 25% всего железа. Ткани печени богаты натрием, калием, кальцием, хлором, магнием и другими макро- и микроэлементами. Многие катионы являются активаторами ферментов. Некоторые металлы (Mg, Mn, Fe, Cu, Zn) входят в состав молекул металлоферментов печени.
453
Печень и обмен витаминов. Печени принадлежит важная роль в обмене

витаминов. Так, жирорастворимые витамины всасываются после эмульгирования их частиц желчью. Каротины корма в печени расщепляются ферментом каротиназой с образованием витаминов группы А. В тканях печени откладываются витамины А, E, С, B1, B2, B6, PP, пантотеновая кислота, биотин, D, К и B12. Они (кроме первых двух и D) используются для биосинтеза многих ферментов.
Печень и обмен гормонов. Печень регулирует оптимальную активность многих гормонов. При прохождении через ткани печени вместе с кровью активность гормонов снижается, а их избыток разрушается ферментами. В частности, гормоны пептидного и белкового происхождения расщепляются здесь до аминокислот пептид-гидролазами. Тироксин инактивируется, образуя с глюкуроновой кислотой парное соединение, которое выделяется с желчью. В печени происходит инактивация андрогенов, эстрогенов и кортикостероидов с образованием глюкуронидов и эфиров с серной кислотой.
454
451 :: 452 :: 453 :: 454 :: Содержание

454 :: Содержание
Выделительная функция печени и состав желчи
В печени образуется желчь: за сутки у лошади до 5-6 л, у коровы - 2-6, у овцы - 0,3-0,4, у свиньи - 0,03-0,05 л. В желчный пузырь поступает желчь, содержащая 97,5% воды и 2,5% сухого остатка. Наиболее важные составные части ее - желчные кислоты, желчные пигменты и холестерин. Более подробно химический состав желчи рассмотрен на с. 86.
454
454 :: Содержание

454 :: 455 :: Содержание
Обезвреживающая функция печени
В печени обезвреживаются различные ядовитые вещества экзо- и эндогенного происхождения. Ядовитые вещества поступают с кровью в купферовы клетки. Здесь они образуют парные соединения с глюкуроновой, серной кислотами и другими продуктами обмена (глицином, ацетил-КоА, метионином, серином и т. д.). Если ядовитое вещество сразу не может
454
образовать парное соединение, то оно подвергается предварительной обработке: окислению, восстановлению, гидролизу и т. д. Например, индол вначале превращается в индоксил, затем - в индоксилсерную кислоту. Серная кислота активируется за счет энергии АТФ с образованием фосфоаденилата. Фосфоаденилат серной кислоты затем переносится на ОН-группу различных ядовитых веществ (фенола, крезола, индоксила, скатоксила) с образованием парных соединений.
Обезвреживание ядовитых веществ с помощью глюкуроновой кислоты осуществляется превращением ее в уридиндифосфоглюконовую кислоту, которая затем вступает в реакцию с ОН-группами аналогично фосфоаденилату серной кислоты.
Некоторые ядовитые вещества, имеющие карбоксильную группу, могут обезвреживаться глицином (у млекопитающих), орнитином (у птиц), глутаминовой кислотой (у человека и обезьян) с образованием пептидных связей за счет энергий АТФ.
Аммиак в печени обезвреживается вследствие образования мочевины, пуриновые основания - мочевой кислоты, гипоксантина, ксантина и аллантоина.
455
454 :: 455 :: Содержание

455 :: 456 :: Содержание
Значение изучения функционального состояния печени
Деятельность печени оценивается в клинической диагностике и терапии. Печень поражается при многих болезнях. При этом в сыворотке крови уменьшается содержание альбуминов и увеличивается количество глобулинов, особенно γ-глобулинов. Для изучения участия печени в углеводном обмене производится галактозная проба. При печеночной форме желтухи в крови и моче возрастает содержание "прямого", при гемолитической - "непрямого" билирубина. При паренхиматозной и механической желтухах в крови и моче увеличивается количество желчных кислот. Защитная функция печени определяется введением в организм бензойной кислоты (проба Квика). Если в печени протекает тот или иной патологический процесс, содержание гиппуровой кислоты в моче уменьшается. Выделительную функцию печени оценивают бромсульфофталеиновой пробой. При гепатитах и некоторых других
455
болезнях печени в крови задерживается 15-100% краски. При жировой дистрофии в крови возрастает концентрация пирувата.
Контрольные вопросы
1.Каковы роль печени в обмене веществ организма и особенности химического состава ее?
2.Что дает изучение функционального состояния печени животных для ветеринарной диагностики?
456
455 :: 456 :: Содержание

456 :: 457 :: Содержание
ГЛАВА 7
БИОХИМИЯ ПОЧЕК И МОЧИ
Почки - орган выделительной системы. В среднем они составляют 0,5% от общей массы животного. Основные функции почек - выделение конечных продуктов обмена веществ и поддержание постоянства состава жидкостей организма.
Химический состав почек
Состав почек: 83% воды, 17% - сухой остаток. В сухой остаток входят органические (до 16%) и неорганические (1%) вещества. Основа органических веществ - белки (12,3%), состоящие из 5-8 белковых фракций. Около 40% растворимых белков по электрофоретической подвижности близки к α- глобулинам сыворотки крови, 20% - к β-глобулинам, 10-20% - к γ-глобулинам, 3-8% - к альбуминам, 11-16% составляют малоподвижную фракцию. В тканях почек крупного рогатого скота находят аминокислоты: тирозин, триптофан, фенилаланин, серии, треонин, оксипролин, аргинин, гистидин, лизин, цистин и метионин. Имеются ферменты всех шести классов, нуклеиновые кислоты, липиды (2-5% от сухой массы), углеводы (1,1-1,2%) и др. Липиды представлены в основном фосфатидами, сфингомиелинами, жирами и сульфатидами, углеводы - гликозаминогликанами (в виде протеогликанов), гликогеном, частично глюкозой. Минеральные вещества составляют 1,1-1,2% сухой массы. В 100 г свежей ткани почек калия содержится 165-510 мг,
456
натрия - 165-390, хлора - 40-210, фосфора - 40-43, кремния - 15-20, кальция - 6- 19, магния - 5-20, брома - 0,5-1, йода - 0,02 мг.
457
456 :: 457 :: Содержание

457 :: Содержание
Обмен веществ в почках
Около 1/3 работы сердца затрачивается на кровообращение в почках. 8-10% всего кислорода, поступающего в организм, поглощается ими; 90% энергетических веществ расходуется на выделительную функцию, остальные 10% - для других потребностей почек. Ежесуточно через почки человека протекает 700-1500 л крови. Основной источник химической энергии в почках - углеводы. В освобождении энергии преобладают аэробный путь и связанное с ним окислительное фосфорилирование. Часть энергии почки получают за счет распада липидов и особенно жиров.
В тканях почек интенсивно протекает обмен белков и других азотистых соединений. Здесь проходят реакции дезаминирования, особенно глутамина, несколько меньше - аминокислот и пуриновых производных. Часть аммиака идет на нейтрализацию неорганических и органических кислот. Из аммиака образуется гуанидин-уксусная кислота - источник креатина.
457
457 :: Содержание
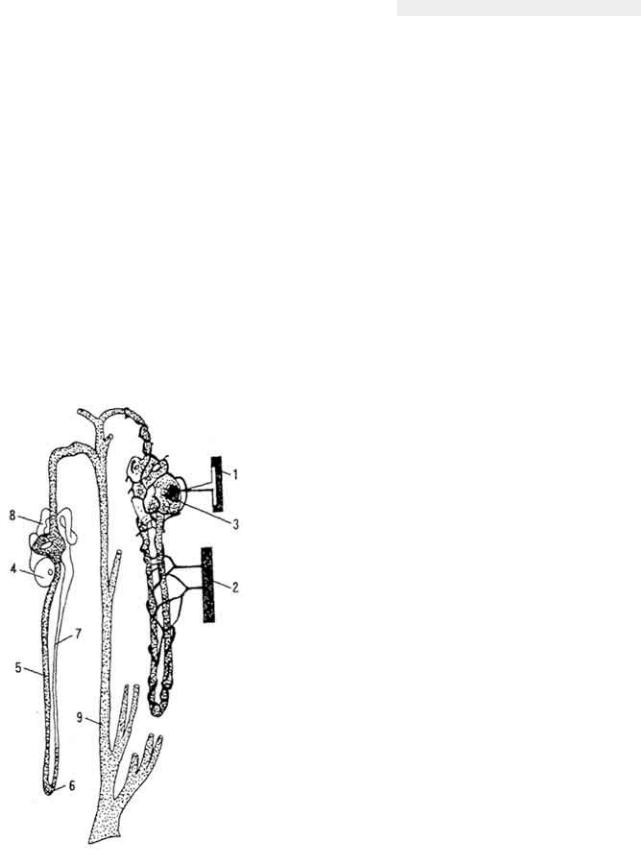
457 :: 458 :: 459 :: 460 :: Содержание
Химизм образования мочи
Главная функция почек - выделение мочи, чем и достигается постоянство "внутренней среды" организма. Это дает возможность сохранять необходимый водный состав и осмотическое давление жидкостей организма, регулировать концентацию различных ионов в частности и рН в целом, обеспечивать кислотно-щелочное равновесие, удалять конечные продукты обмена.
Образование мочи тесно связано с деятельностью сердечно-сосудистой системы. 25% артериальной крови поступает в почечные артерии. Конечные разветвления почечных артерий тесно связаны с секреторными отделами почки (рис. 58). Так, каждая почечная артерия разделяется на междолевые, а эти, в свою очередь, - на более мелкие сосуды, которые заканчиваются мальпигиевыми клубочками. Мальпигиев
457
Рис. 58. Схематическое изображение двух нефронов и их
кровоснабжение (по Кешни): 1 - междольковая артерия; 2 - междольковая вена; 3 - отводящая артериола; 4 - мальпигиев клубочек; 5 - проксимальный каналец; 6 - петля Генле; 7 - нисходящее колено; 8 - восходящее колено; 9 - собирательная трубка
клубочек и капсула Боумена образуют совместно с почечным канальцем нефрон. В почке собаки, например, от 186000 до 370000 нефронов. Протяженность капиллярной сети около 25 км, площадь ее в одной почке - до
1,5 м2.

Мочеобразование (цвет, табл. VIII) заключается в: 1) фильтарции плазмы крови в почечные канальцы; 2) реабсорбции части веществ из фильтрата; 3) секреции мочи в клетках почечных канальцев.
На первом этапе в верхние отделы почечного канальца из мальпигиевого клубочка фильтруется первичная моча. Она состоит из аминокислот, белка (иногда до 0,001%), глюкозы, мочевины, многих продуктов метаболизма, минеральных веществ. Около 20% плазмы крови фильтруется в виде первичной мочи. Интенсивность фильтрации определяется клиренсом, или коэффициентом очищения, который равен
Например, в организме за сутки образуется около 180 л первичной мочи, за 1 мин - до 125 мл фильтрата. Если вещество в проксимальных почечных канальцах полностью всасывается, то величина клиренса
458
равна нулю. Если вещество не всасывается и полностью входит в состав вторичной мочи, то клиренс приближается к величине фильтрата (в нашем примере125 мл).
Второй этап образования мочи - реабсорбция отдельных составных частей первичной мочи в проксимальных отделах почечных канальцев. Она происходит против градиента концентрации, так как концентрация веществ в жидкости канальцев небольшая по сравнению с концентрацией их в крови. Процесс осуществляется белковыми переносчиками, которые соединяются с глюкозой и транспортируют ее к капиллярам через эндоплазматическу ю сеть клетки (см. цвет, табл. VIII). Если в крови и в первичной моче глюкоза в избытке, она не успевает соединиться с переносчиком и прямо диффундирует во вторичную мочу. У собаки величина реабсорбции глюкозы достигает 303 мг/мин.
Для аминокислот существует несколько систем переносчиков. Так, одна из них участвует в транспортировании лейцина и изолейцина; вторая - лизина, аргинина, цистина, орнитина и гистидина; третья - глицина, аланина и креатина. Избыток в крови и первичной моче гистидина конкурентно угнетает реабсорбцию остальных аминокислот второй группы.
В проксимальных отделах почечных канальцев реабсорбируется около 96% воды и 80% ионов Na+ и Сl- первичной мочи, а также многие катионы и анионы. Процессы реабсорбции регулируются нейрогуморально. Так, вазопрессин активирует гиалуронидазу и способствует обратному всасыванию воды в почечных канальцах. Альдостерон регулирует содержание в моче ионов Na + и K+. Под влиянием ренина от α2-глобулина отщепляется декапептид ангиотензин I, из него образуется ангиотензин II, который поддерживает тонус артериол

клубочка и регулирует реабсорбцию многих веществ. В организм возвращается около 99% объема ультрафильтрата (В. В. Рудаков, 1969).
Третий этап образования мочи - секреция клетками почечных канальцев во вторичную мочу продуктов обмена веществ: парааминогиппуровой кислоты, мочевины, креатина и др. Этот процесс становится интенсивнее по мере приближения мочи к лоханке. Из нее моча поступает в мочеточники и мочевой пузырь.
459
В ходе секреции в мочу выделяются чужеродные для организма вещества, поступившие вместе с кормом, водой, воздухом, многие лекарственные средства и ядовитые продукты.
460
457 :: 458 :: 459 :: 460 :: Содержание

460 :: 461 :: 462 :: 463 :: 464 :: 465 :: 466 :: Содержание
Общая характеристика мочи
Исследование мочи дает информацию об общем состоянии организма, работе его отдельных систем и органов.
Физико-химические свойства мочи. За сутки у лошади в среднем выделяется 3-6 л мочи, у крупного рогатого скота - 6-12, у свиньи - 2-4, у верблюда - 8-15, у овцы и козы - 0,5-2, у кролика - 0,04-0,1 л.
Выделение мочи уменьшается при многих болезнях и называется олигурией. В некоторых случаях моча не выделяется совсем, например при опухолях, тогда наступает анурия. При сахарном диабете ее количество резко возрастает, наступает полиурия.
У большинства видов животных моча прозрачная. У лошади, мула и осла первые порции мочи мутные из-за присутствия муцина и высокого содержания солей - уратов, фосфатов, карбонатов. При стоянии моча некоторых животных (например, собак) мутнеет. Мутная моча бывает при наличии в ней гноя.
Моча многих видов животных - водянистая жидкость, у лошадей, мулов и ослов несколько тягучая из-за муцина и нуклеоальбумина, вырабатываемых железами почечной лоханки. При воспалительных процессах в почках и мочевыводящих путях в моче появляется много слизи.
Цвет мочи у лошади и крупного рогатого скота от светло-желтого до темнокоричневого, у свиньи, козы и собаки - от светло-желтого до насыщенного желтого.
Изменение окраски возникает при наличии в моче крови и гемоглобина (красная), желчных пигментов, что бывает при гепатитах и фасциолезе (желтая и зелено-желтая). Меняется она и на воздухе.
Свежая моча специфического запаха: у лошади - аммиака, у собак - чеснока. При родильном парезе и ацетонемии приобретает запах ацетона. Гнилостный
460
запах появляется при гнойных воспалительных процессах в мочеполовой системе.
Плотность мочи у лошади - 1,025-1,055; у крупного рогатого скота - 1,025- 1,050; у овцы - 1,015-1,070; у верблюда - 1,030-1,060; у козы - 1,015-1,065; у
свиньи - 1,018-1,022. Эти величины уменьшаются при полиурии и гнойных воспалительных процессах.
Осмотическое давление мочи определяют термометром Бекмана и
выражают депрессией . Так, у лошади равна 1,6-1,7, у крупного рогатого скота - 1,2, у свиньи - 1,0-1,5. Величина осмотического давления зависит от наличия в моче неорганических (хлоридов, сульфатов, фосфатов) и в меньшей мере - органических (мочевины, оксалатов, креатина и др.) соединений и колеблется от 606 до 11 312 кПа. Осмотическое давление изменяется при многих болезнях, особенно при нефритах и циститах.
Моча травоядных животных щелочной реакции, всеядных - близка к нейтральной, плотоядных - кислой. Так, у лошади рН мочи 7,2-8,7, у крупного рогатого скота - 7,7-8,7, у свиньи - 6,5-7,8, у козы - 8,0-8,5. Сдвиг рН в кислую сторону наблюдается при нефритах, гепатитах, в щелочную - при циститах и др. Реакция мочи у молодых животных более кислая, чем у взрослых.
Химический состав мочи. Моча содержит свыше 200 веществ. Иногда в ней встречаются нетипичные вещества в зависимости от природы кормов, состава воды, воздуха, употребления лекарств и др. Моча состоит из воды (96%) и сухого остатка (4%). В сухой остаток входят неорганические (1,5%) и органические (2,5%) вещества.
Н е о р г а н и ч е с к и е с о с т а в н ы е ч а с т и м о ч и. В моче содержатся соли натрия, калия, кальция, магния, аммония и других катионов с соляной, фосфорной, серной и другими минеральными кислотами. Количество солей подвержено суточным колебаниям. Часть катионов находится в составе органических соединений. Минеральный состав мочи изменяется при патологии. Так, кальция в моче больше при остеомаляции и аденоме паращитовидной железы, железа - при фасциолезе, аммонийных солей - при диабете.
461
15. Азотсодержащие, вещества мочи, г азота на 100 г экскретируемого азота
(по Ю. В. Наточину)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аминный |
|
|
|
|
|
|
|
|
|
Мочевая |
|
Неидентифи- |
|
|
Животное |
|
азот |
|
Аммиак |
|
Креатин |
|
Креатинин |
|
Мочевина |
|
кислота |
|
цированные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
соединения |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Верблюд |
|
1,7 |
|
2,4 |
|
2,1 |
|
10 |
|
68 |
|
1,3 |
|
14,8 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Собака |
|
- |
|
3,5 |
|
- |
|
0,8 |
|
91 |
|
_ |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Кит |
|
- |
|
1,9-3,6 |
|
_ |
|
Следы |
|
85-93 |
|
3 |
|
2,7-3,1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Курица |
|
6 |
|
1,5 |
|
- |
|
8 |
|
0,9 |
|
70 |
|
28 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Карп |
|
2,6 |
|
75-77 |
|
- |
|
- |
|
12,5-14,5 |
|
- |
|
5,5-12,5 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Камбала |
|
8,9 |
|
2,2 |
|
- |
|
20,5 |
|
17,3 |
|
1,2 |
|
50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О р г а н и ч е с к и е с о с т а в н ы е ч а с т и м о ч и. Они представлены азотсодержащими и безазотистыми соединениями,
Азотсодержащие вещества мочи - продукты конечного обмена белков. Основой их у многих животных служит мочевина или мочевая кислота (табл. 15). К крупного рогатого скота количество мочевины за сутки составляет 60-100 г, у лошади - 75-150. Содержание ее возрастает при интенсивной работе, болезнях, сопровождаемых лихорадкой, уменьшается - при гепатитах и др.
Аммиак мочи представлен неорганическими и органическими солями: NH4Cl, (NH4)2SO4, (COO)2(NH4)2 и др. У млекопитающих азот аммиака составляет 1/150-1/200 общего азота мочи. У крупного рогатого скота составляет
0,40-0,60 г, у овцы - 0,22, у лошади - 0,40 г.
Мочевая кислота - обязательный продукт азотистого обмена (у рептилий и птиц - основной). Она бывает в свободной и связанной формах. Содержание ее и уратов возрастает в моче при подагре, нефритах и т. д. В норме содержится до 0,0002% мочевой кислоты.
Адлантоин - продукт азотистого обмена млекопитающих (кроме человека и антропоидных обезьян). Образуется в печени из мочевой кислоты.
462
В моче рогатого скота он составляет 92,5% общего количества пуринов, лошади
- 87,5, овцы - 64, свиньи - 97,1%.
Креатин и креатинин - основные части мочи. Креатина в моче мало, иногда лишь следы. Креатинин у лошади составляет в среднем 0,0032% общего количества мочи, у коровы - 0,09, у свиньи - 0,01, у козы - 0,005. Для характеристики мышечной деятельности введен креатининовый коэффициент - количество креатина и креатинина в суточной моче животного. У лошади он равен 6,8-7,5; у собаки - 8,4; у птиц - 3,4. Увеличение содержания креатина в моче приводит к креатинурии. Она возникает при диабете, миозитах и т. д.
Гиппуровая кислота - продукт нейтрализации бензойной кислоты глицином. Ее количество в суточной моче лошади достигает 160 г, коровы - 150, овцы - 30 г. Синтезируется в печени, частично - в почках при участии KoA. Содержание этой кислоты возрастает при гепатитах и многих отравлениях.
Фенацетуровая кислота - продукт нейтрализации фенилуксусной кислоты глицином. Ее содержание в моче лошади составляет 0,8-1,0 г, коровы - до 2 г на 1 л мочи.
Содержание аминокислот в моче невелико - до 1 г за сутки. Глутаминовая кислота и глутамин составляют около 35% всех аминокислот, гистидин - 20, аспарагиновая кислота - 15, остальные - до 30%. Количество их возрастает при гепатитах и нефритах.
Концентрация индоксилсерной и скатоксилсерной кислот в моче невелика. Она возрастает при запорах, атониях преджелудков, гнилостных процессах в
пищевом канале.
В состав мочи входит индикан, например, в моче лошади его до 220 мг/л.
Кроме того, в моче содержится некоторое количество других азотсодержащих веществ: витаминов, гормонов, ферментов, пигментов (урохром, урохромоген, уроэритрин, уробилиноген) и др.
Безазотистые вещества мочи - щавелевая, глюкуроновая, янтарная кислоты и их производные, фенолы и их эфиры, ароматические оксикислоты, нейтральная сера, безазотистые витамины и др. Их содержание не превышает десятых долей процента.
463
Щавелевая кислота выделяется в виде оксалатов. Кристаллы имеют форму почтовых конвертов. Их содержание возрастает при нефритах, гепатитах, мочекаменной болезни.
Глюкуроновая кислота вырабатывается в печени и участвует в нейтрализации ядовитых продуктов, образуя парные соединения.
В моче содержатся некоторые количества янтарной, муравьиной, уксусной, пропионовой, валериановой и других жирных кислот в свободном и связанном состояниях.
Моча содержит фенолы. У лошади и крупного рогатого скота их 0,9-1,2 г/л. Они образуют с серной кислотой парные соединения - фенолсерную и крезолсерную кислоты, концентрация которых в моче возрастает при запорах, энтеритах, нефритах, перитонитах и др.
Нейтральная сера в моче находится в виде цистина, таурина и других соединений. Нейтральная сера составляет 50%, эфиры - 30, сульфаты - 20% ее общей массы. Количество серы возрастает при ожогах и заболеваниях кожи.
В моче содержатся безазотистые витамины (особенно С), гормоны (эстрадиол, эстриол, андростерон и др.).
Осадок мочи. В осадке кислой мочи есть гидроураты натрия и калия, оксалат кальция, щелочной - ортофосфаты кальция, магния и аммония, урат аммония, карбонат кальция, оксалат кальция (рис. 59) и др. В осадок могут попадать клетки эпителия, мочевыводящих путей, форменные элементы крови, микробы и др. Состав осадков изменяется при патологических состояниях.
Патологические составные части мочи. При патологических изменениях появляются
Рис. 59. Кристаллы оксалата кальция в осадках мочи
464
вещества, которых обычно нет в моче здоровых животных. Часто изменяется типичное соотношение составных частей мочи между собой. Интерес для диагностики представляет выявление в моче белков, углеводов, ацетоновых тел, желчных и кровяных пигментов и др.
Появление в моче белка называется протеинурией или альбуминурией. Различают почечную и внепочечную протеинурию. Нарушение фильтрационных свойств мальпигиевых клубочков приводит к почечной протеинурии. Она может быть физиологической (при переохлаждении, повышенной физической нагрузке, кормлении богатыми белками кормами) и патологической (при нефритах, отравлении заплесневелыми кормами, ядами, при многих болезнях). При почечной протеинурии содержание белка в моче не превышает 1%. Внепочечная протеинурия возникает при заболеваниях почечных лоханок, мочеточников, мочевого пузыря, мочеиспускательного канала.
Появление в моче крови или гемоглобина приводит к явлениям гематурии и гемоглобинурии. Кровь в моче может появиться при мочекаменной болезни, чуме, кровопятнистом тифе, сибирской язве и др. Причиной гемоглобинурии могут быть различные отравления.
Появление в моче глюкозы называется глюкозурией. Различают физиологическую и патологическую глюкозурию. Физиологическая наблюдается у животных при обильном кормлении кормами, богатыми углеводами, перевозбуждении, во время беременности, патологическая - при сахарном диабете (содержание сахара в моче доходит до 5-8%), нервной форме чумы, бешенстве, токсикозах и др.
Кетонурия (ацетонурия) возникает при повышенном содержании в моче кетоновых тел (ацетона, ацетоуксусной и β-оксимасляной кислот). В моче коровы обычно содержится 0,001-0,018% кетоновых тел, при кетозах количество их повышается. Кетонурия возникает при нарушениях липидного и белкового обменов, кетозах различного происхождения, родильном парезе, болезнях печени, у жвачных - при болезнях преджелудков, сахарном диабете, голодании и

др.
Билирубинурия - повышенное выделение билирубина с мочой. В моче клинически здоровых животных содержатся следы желчных пигментов. При закупорке
465
желчных протоков (при желчнокаменной болезни, фасциолезе) возникает механическая желтуха. При этом желчные пигменты и желчные кислоты попадают в кровь и мочу. Билирубин появляется в моче при паренхиматозных желтухах.
К патологическим составным частям мочи относятся мочевые камни и песок. У клинически здоровых животных соли обычно находятся в растворенном состоянии. При мочекаменной болезни нарушается синтез мукопротеидов слизистой оболочкой мочевыводящих путей, в результате чего появляется мочевой песок. Он задерживается в мочевыводящих путях и агрегатируется - возникают мочевые камни. Величина их может достигать размеров гусиного яйца. По химической природе они делятся на ураты, оксалаты, фосфаты. Встречаются камни смешанного состава. Иногда бывают цистиновые камни и сростки, образованные карбонатом кальция.
Половина мочевых камней состоит из оксалата кальция или из смеси различных солей, треть - представлена солями Са3(РO4)2, СаСО3, MgNH4PO4 или их смесями. У больных подагрой камни состоят из уратов. Возникновению камней способствуют различные инфекции, хроническое защелачивание мочи, избыточное выделение с мочой ионов Ca2+, гиподинамия, нарушения обмена глицина и др.
466
460 :: 461 :: 462 :: 463 :: 464 :: 465 :: 466 :: Содержание
466 :: 467 :: Содержание
Особенности свойств и химического состава мочи птиц
У птиц моча выделяется непосредственно в клоаку, где вместе с калом образует сплошную массу. Ее количество у кур достигает 120 мл в сутки, у уток
- 275 мг.
Моча птиц - водянистая жидкость, тяжелее воды (плотность у кур 1,005, у уток-1,0018, у гусей-1,004), с нейтральным или слабокислым рН. Состоит из воды (97,6%) и сухого остатка (2,4%). Основа сухого вещества мочи птиц - мочевая кислота (77,08%), мочевина (4,2%) аммиак (3,2%) и др. Специфической составной частью мочи птиц является орнитуровая кислота, которая образуется из орнитина и бензойной кислоты.
466
Моча содержит соли Ca, Na, К, Mg, P, Cl, S и др. Химический состав ее зависит от вида птицы, ее кормления, зоны обитания и др.
Контрольные вопросы
1.Дайте краткую характеристику химического состава почек, обмена веществ в них и химизма образования составных частей мочи.
2.Проанализируйте физико-химические свойства и химический состав мочи различных видов животных, в том числе птицы.
3.Назовите патологические составные части мочи и укажите, при каких заболеваниях они возникают.
467
466 :: 467 :: Содержание

468 :: Содержание
ЧАСТЬ III
БИОХИМИЯ НЕКОТОРЫХ ПРОДУКТОВ ЖИВОТНОВОДСТВА
Животноводство - важнейшая отрасль сельского хозяйства, обеспечивающая население продуктами питания, а легкую промышленность - сырьем. Из продуктов животноводства готовят иммунные сыворотки, гормональные препараты и др. Некоторые отходы животноводства используют в качестве кормов.
Задачи зоотехнической и ветеринарной науки - управление качественными и количественными процессами продуктивности сельскохозяйственных животных.
ГЛАВА 1
БИОХИМИЯ МЯСА
Общая характеристика мяса
Мясо - один из важнейших продуктов питания. Оно содержит полноценные белки, липиды, углеводы, витамины, минеральные вещества и другие соединения. Мясом обычно называют скелетные мышцы животных. В зависимости от вида животного различают говядину, телятину, свинину, оленину, баранину и т. д.
Кроме мяса от животных получают жиры - ценный продукт питания. В зависимости от источника получения и качества жиры делят на пищевые и технические. К пищевым относят говяжий, бараний и свиной жиры. Источник пищевых жиров - жировая ткань убойных животных. Технические жиры - продукт вытапливания, экстрагирования или прессования жиросодержащего сырья убойных животных. Они непригодны для пищи и используются для других целей, например для приготовления мыла, смазочных средств и др.
К субпродуктам относят внутренние органы, голову, вымя, мясо-костный хвост, путовый сустав, половые органы, мясную обрезь. Они составляют 20% массы мяса. Субпродукты птицы - сердце, желудок, печень, шейка, крылья, ножки - называют потрохами.
468
468 :: Содержание

469 :: Содержание
Биосинтез составных частей мяса
На мясо туши крупного рогатого скота приходится 48-68%, овцы - 46-65, свиньи - 36-64%. В состав мяса входят мышечная, жировая, костная, соединительная и нервная ткани.
Биосинтез химических составных частей каждой ткани протекает типично. Так, из аминокислот синтезируются белки сарколеммы, саркоплазмы и миофибрилл. Из поступившей в мышцы глюкозы образуется гликоген, содержание которого достигает 1% и больше. Ацетил-КоА служит источником образования высших жирных кислот, нейтрального жира, стеринов, стеридов и других липидов. В мышечной ткани образуются различные соединения, которые входят в состав мяса, определяя его качество. К ним прежде всего следует отнести макроэргаческие соединения (АТФ, КрФ) и молочную кислоту.
469
469 :: Содержание

469 :: 470 :: 471 :: 472 :: Содержание
Химический состав мяса
Химический состав мяса зависит от вида, возраста, породы, упитанности, рациона и функционального состояния животного в момент убоя. Содержание основных веществ в мясе различных животных следующее (табл. 16).
16. Химический состав мяса убойных животных, % (по И. А. Смородинцеву)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Продукт |
|
Вода |
|
Белки |
|
Жиры |
|
Зола |
|
Калорийность ккал/100 г |
|
|
|
|
|
|
|
|
|
|
|
|
мяса |
|
|
|
|
|
|
|
|
|
|
||||
|
Говядина I категории |
|
70,5 |
|
18,0 |
|
10,5 |
|
1,0 |
|
171 |
|
|
|
|
|
|
|
|
|
|
||||
|
Говядина II категории |
|
74,1 |
|
21,0 |
|
3-8 |
|
1,1 |
|
121 |
|
|
|
|
|
|
|
|
|
|
||||
|
Баранина I категории |
|
65,8 |
|
16,4 |
|
17,0 |
|
0,8 |
|
225 |
|
|
|
|
|
|
|
|
|
|
||||
|
Баранина II категории |
|
69,4 |
|
20,8 |
|
9,0 |
|
0,8 |
|
169 |
|
|
|
|
|
|
|
|
|
|
||||
|
Свинина жирная |
|
47,5 |
|
14,5 |
|
37,3 |
|
0,7 |
|
406 |
|
|
|
|
|
|
|
|
|
|
||||
|
Свинина мясная |
|
60,9 |
|
16,5 |
|
21,5 |
|
1,1 |
|
268 |
|
|
|
|
|
|
|
|
|
|
||||
|
Телятина жирная |
|
72,8 |
|
19,0 |
|
7,5 |
|
0,7 |
|
147 |
|
|
|
|
|
|
|
|
|
|
||||
|
Телятина тощая |
|
78,2 |
|
20,0 |
|
0,5 |
|
1,3 |
|
87 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Конина средней |
|
66,3 |
|
21,5 |
|
10,0 |
|
1,7 |
|
183 |
|
|
упитанности |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оленина средней |
|
72,9 |
|
19,0 |
|
6,0 |
|
1,1 |
|
138 |
|
|
упитанности |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Мясо яка |
|
75,1 |
|
20,0 |
|
3,5 |
|
1,2 |
|
115 |
|
|
|
|
|
|
|
|
|
|
||||
|
Мясо кролика |
|
69,3 |
|
21,5 |
|
8,0 |
|
1,2 |
|
162 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
469 |
|
|
|
|
|
|
||
Особой питательной ценностью отличается мясо сельскохозяйственной птицы (табл. 17).
Вода. Вода в мясе находится в связанном и свободном состояниях. Связанная вода в среднем составляет 4% общей массы мяса. Считают, что связь осуществляется в результате взаимодействия полярных групп молекул белков (- СООН, -NH2 и др.) с диполями воды. Кроме того, молекулы воды входят в состав цитоплазмы (иммобильная вода) и связаны с неорганическими ионами (гидратационная вода). Основная масса воды в мясе находится в свободном состоянии и удерживается мицеллярной структурой белков. Присутствие в мясе необходимого количества воды определяет его качество. В жировой ткани содержание воды колеблется от 4 до 40% общей массы.
Белки. Белки мяса содержат все незаменимые аминокислоты. По биологической ценности мясо как продукт питания стоит после молока и яйца. Оно состоит из белков миофибрилл (60%), саркоплазмы (30%) и
соединительнотканной стромы (10%). Белки миофибрилл содержат миоген, глобулин, α-миозин, тропомиозин, актин и актомиозин, миоглобин. Белки соединительнотканной стромы состоят из коллагена и эластина,
17. |
Средний |
|
химический |
|
состав |
|
и |
|
калорийность |
мяса |
||||||
сельскохозяйственной птицы, % (по данным ВНИИПП) |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Вид и возраст |
|
Категория |
|
Вода |
|
Жир |
|
Белок |
|
Зола |
|
Калорийность, |
|
||
|
птицы |
|
упитанности |
|
|
|
|
|
ккал/100 г мяса |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Куры |
|
|
I |
|
65,5 |
|
13,7 |
|
19,8 |
|
1,0 |
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
70,9 |
|
6,8 |
|
21,4 |
|
0,9 |
|
155 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Цыплята |
|
I |
|
67,5 |
|
11,5 |
|
19,8 |
|
1,2 |
|
185 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
72,1 |
|
4,0 |
|
22,8 |
|
1,1 |
|
140 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Индейки |
|
I |
|
60,0 |
|
19,1 |
|
19,9 |
|
1,1 |
|
250 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
66,8 |
|
8,0 |
|
24,0 |
|
1,2 |
|
175 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Индюшата |
|
I |
|
68,4 |
|
8,2 |
|
22,5 |
|
0,9 |
|
176 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
70,6 |
|
3,3 |
|
25,1 |
|
1,0 |
|
147 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Цесарки |
|
I |
|
61,1 |
|
21,1 |
|
16,9 |
|
0,9 |
|
254 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
71,4 |
|
7,1 |
|
20,5 |
|
1,0 |
|
155 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Утки |
|
|
I |
|
49,4 |
|
37,0 |
|
13,0 |
|
0,6 |
|
365 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
58,7 |
|
22,9 |
|
17,5 |
|
0,9 |
|
270 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Утята |
|
|
I |
|
56,6 |
|
26,8 |
|
15,8 |
|
0,8 |
|
294 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
63,0 |
|
19,2 |
|
16,9 |
|
0,9 |
|
236 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Гуси |
|
|
I |
|
48,9 |
|
38,1 |
|
12,2 |
|
0,8 |
|
369 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
59,4 |
|
22,8 |
|
16,9 |
|
0,9 |
|
266 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Гусята |
|
|
I |
|
52,9 |
|
29,8 |
|
16,8 |
|
0,5 |
|
323 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
II |
|
67,6 |
|
11,4 |
|
20,3 |
|
0,7 |
|
176 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
470 |
|
|
|
|
|
|
|
|
|
|
|
частично - из ретикулина, белков нервной ткани и некоторых других. Это неполноценные белки. Чем больше в мясе соединительной ткани (особенно у старых животных), тем меньше его питательная ценность.
Типичный состав незаменимых аминокислот в мясе следующий, % к белку:
Лизин |
7,8 |
Изолейцин |
4,9 |
Лейцин |
7,5 |
Фенилаланин |
4,1 |
Треонин |
5,1 |
Метионин |
2,5 |
Валин |
5,0 |
Триптофан |
1,4 |
В тушах крупного рогатого скота наиболее полноценное мясо находится в

спинной части (содержит 2% коллагена), наименее полноценное - в области голяшки (содержит 14% коллагена).
Липиды. В мышечной ткани в среднем содержится 1-3% липидов. В липидах мяса преобладают жиры. Их содержание колеблется в широких пределах. В тощем мясе уровень фосфатидов сравнительно стабилен: 0,5-0,8%. В липидах мяса преобладают высшие жирные кислоты нормального строения с четным числом атомов углерода. Олеиновая кислота составляет 33-47% всех ненасыщенных жирных кислот мяса. Состав жирных кислот говядины, свинины, баранины, конины, оленины и других видов мяса различен. Так, жиры мяса птиц больше содержат ненасыщенных жирных кислот, что сказывается на многих физико-химических показателях.
Углеводы. Они содержатся во всех тканях мяса. Особенно много их в мышечной и соединительной тканях. Из моносахаридов преобладает глюкоза, из полисахаридов - гликоген, гиалуроновая кислота и хондроитинсульфаты. Работающие мышцы содержат в среднем 3,6% гликогена. В телятине - 0,37- 0,45% моносахаридов, в говядине - 0,26-0,77, в свинине - 0,12-1,194%.
Азотистые экстрактивные вещества. Это аминокислоты и пептиды (до
2% общей массы), карнозин, ансерин, карнитин. В мясе содержатся фосфаген, АТФ, АДФ, АМФ, ИМФ и др. При гниении мяса из орнитина образуется путресцин, из лизина - кадаверин, трупные яды.
Безазотистые экстрактивные вещества. В эту группу веществ входят углеводы, их производные и
471
органические кислоты: молочная, гликолевая, янтарная и др.
Витамины. Мясо содержит различные витамины: А, B1, B2, PP, B3, С. Больше всего в нем витамина А: в говядине -60 ИЕ, в телятине - 20, в баранине - 200, свинине - 20, в печени лошади - 5,750, свиньи - 8240, теленка - 9720, коровы - 9720, овцы - 18 640 ИЕ на 100 г. В мясе кур много витаминов B1, B6, PP, B3, H, фолиевой кислоты, B12 и др.
Минеральные вещества. В тощем мясе содержится 1,0-1,5% минеральных веществ. Количественный состав их следующий, % в сырой ткани: К - 0,254- 0,398; Na - 0,065-0,156; Ca - 0,003-0,009; Mg - 0,022-0,028; P - 0,150-0,200; Cl- 0,07; Fe - 0,002-0,003; Zn - 0,003-0,005. B небольших концентрациях есть также Cu, Ba, В, Si, Pb, Sb, Со, Mn, Mo, P, Ni, I, Al, Ag и др.
472
469 :: 470 :: 471 :: 472 :: Содержание

472 :: 473 :: 474 :: 475 :: Содержание
Биохимические процессы в мясе после убоя животного
Все биохимические процессы, происходящие в мясе после убоя животного, условно делят на три последовательные фазы: окоченение, созревание и глубокий автолиз.
Окоченение. После убоя животного расслабленная туша начинает затвердевать. Это состояние называется посмертным окоченением. Оно сохраняется в течение 1-2 сут, после чего мышцы расслабляются и принимают свой первоначальный вид. Окоченение начинается с жевательных мышц и распространяется к тазовым конечностям. Исчезает оно в той же последовательности, как и наступило. Отдельные стороны химизма окоченения не изучены. Его степень зависит от наличия в мясе гликогена и АТФ. В мышцах больных животных содержание гликогена нарушено, что приводит к замедлению процессов окоченения. В ходе окоченения изменяется рН. Так, в живой мышце он равен 7,3-7,5, после убоя становится нейтральным, а через несколько часов достигает максимума - 5,3-5,5. Причиной изменения рН является распад гликогена и глюкозы до молочной кислоты в ходе гликолиза.
472
В первые 20-50 мин после убоя наблюдается повышение температуры мяса на 0,9-2,0° С, это результат нарушения сопряжения между клеточным дыханием и окислительным фосфорилированием, а также затухания последнего после смерти животного.
После окоченения в мясе резко уменьшается содержание органического фосфора и увеличивается концентрация неорганического, постепенно уменьшается и исчезает запас АТФ и креатинфосфата, накапливаются продукты, не свойственные живым мышцам.
Созревание мяса. Это процесс, протекающий после окоченения и приводящий к улучшению вкусовых качеств мяса, способствует появлению специфически приятного вкуса и аромата, сочности и нежности. При температуре 2-3° С созревание мяса завершается через 12-15 сут, при 12° С - на пятые, при 18° С - на вторые сутки, при 29° С - через несколько часов. Наилучшие результаты созревания достигаются при 0-4° С в камерах охлаждения. При созревании до 10 сут аромат, вкус и нежная консистенция мяса постепенно увеличиваются, достигая максимума.
Созревание мяса прежде всего связано с явлениями гликогенолиза. Эти процессы активируются после убоя животного и приводят к увеличению в мясе содержания молочной кислоты. В динамике количества гликогена мяса различают четыре периода: уменьшение содержания, сохранение концентрации на определенном уровне, вторичное небольшое увеличение количества гликогена и окончательный необратимый гликогенолиз.
При созревании происходит дефосфорилирование нуклеотидов, креатинфосфата и гексозофосфатов, что приводит к увеличению содержания неорганического фосфора. В мясе возрастает содержание молочной и ортофосфорной кислот, в результате этого среда становится кислой (у хорошо откормленных животных рН 5,6-5,8, у жирных рН 6,2-6,4). Нежная консистенция мяса достигается за счет кислот, "разрыхляющих" соединительнотканные прослойки.
Изменяются физико-химические свойства белков. Этот процесс происходит по стадиям: вначале меняются гидрофильные свойства белков, затем распадаются пептидные связи и белки теряют способность к коагуляции. Так, в первые часы после убоя животного влагосвязывающая способность мяса равна
100%, через
473
Рис. 60. Изменение содержания свободных аминокислот в говяжьем
мясе после убоя животного (по В. Пезацки): 1 - аланин; 2 - глицин; 3 - глутаминовая кислота; 4 - аспарагиновая кислота
24 ч - 74, через 48 ч - 78% и т. д. Под влиянием катепсинов происходит гидролиз белков до аминокислот и простетических групп. Содержание свободных аминокислот в мясе постепенно возрастает, достигая максимума (рис. 60). Так, содержание аланина и глицина увеличивается наполовину, аспарагиновой и глутаминовой кислот вместе с метионином к концу 18-х сут в - 6-10 раз. Изменяются и другие свойства мышечных белков. В живых мышцах часть белков ведет себя, как кислоты, образуя соли. При уменьшении рН эти соли распадаются и катионы переходят в раствор. Белки теряют гидрофильные свойства.
В дальнейшем образуется жидкая фракция - мясной сок, который равномерно пропитывает ткани мяса. Он содержит 89,4% воды, 6,4 - белков, 3 - экстрактивных веществ и 1,2% минеральных соединений. Мясной сок в

значительной степени определяет вкус мяса, так как содержит экстрактивные вещества - глутаминовую и инозитовую кислоты, аминокислоты и другие низкомолекулярные соединения. Специфические вкус и запах говядины, свинины, конины, баранины и других видов мяса связаны частично с их липидным составом.
Глубокий автолиз. При долгом хранении мяса изменяются его запах, вкус, цвет и другие показатели. Здесь следует различать два явления - загар и гниение мяса.
З а г а р м я с а - изменения, возникающие в мясе в процессе автолиза и приводящие к уменьшению
474
или потере пригодности его для пищевых целей. Цвет мяса становится серокрасным или серо-коричневым, запах - удушливо-кислым, консистенция - рыхлой, реакция - кислой. Возникает при прекращении доступа к мясу кислорода, повышенной температуре хранения (15° С и больше) и высокой влажности среды. В мясе повышается температура (больше 37° С), расщепляется гликоген, накапливаются продукты гликолиза и глико-генолиза, разлагаются белки с выделением серосодержащих аминокислот, из которых образуется H2S. Для предупреждения загара мясо хранят в прохладном помещении с хорошей вентиляцией.
Г н и е н и е м я с а - это разложение органических веществ мяса под влиянием ферментов микрофлоры. При этом разлагаются белки, образуются путресцин, кадаверин, индол, скатол, меркаптаны, фенолы, аммиак и др. При разложении жиров образуются НЖК (масляная, капроновая и др.), альдегиды, оксикислоты, обладающие неприятным запахом, что ухудшает качество мяса и делает его непригодным для питания. Для предупреждения процессов гниения нужно соблюдать следующие условия: для убоя брать клинически здоровых животных, перед убоем животным обеспечить достаточный отдых, хорошо очищать шкуры и копытца, правильно обескровливать тушу, применять быстрое охлаждение, соблюдать правила созревания и хранения мяса. Полноценная сохранность мяса достигается консервированием, охлаждением, замораживанием, посолом, добавлением ингибиторов, ультрафиолетовым облучением, обработкой озоном и др.
475
472 :: 473 :: 474 :: 475 :: Содержание

475 :: 476 :: Содержание
Вопросы регуляции мясной продуктивности
При регуляции мясной продуктивности учитываются многие факторы, и прежде всего генетический. Генетический фактор предполагает при разведении животных с определенным уклоном (на мясо или на жир) использование соответствующих пород. На количество мяса и жира в туше влияют условия кормления и содержания животных, а также их возраст. Высокий уровень кормления и раннее созревание ускоряют развитие всех частей тела. При плохом кормлении рост и развитие животных замедляются.
475
Для увеличения мясной продуктивности применяют гормональные препараты, например инсулин. Для переориентации обмена веществ на биосинтез жира животных кастрируют.
Контрольные вопросы
1.Какие виды мяса имеются и в чем их питательная ценность?
2.Какие биохимические процессы после убоя животного протекают в мясе
икак они влияют на его качественную характеристику?
476
475 :: 476 :: Содержание

476 :: 477 :: Содержание
ГЛАВА 2
БИОХИМИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ И МОЛОКА
Общая характеристика
Молочная железа - важнейший орган самок млекопитающих, синтезирующий молоко, которое является единственным продуктом питания для их детенышей на первых этапах постнатальной жизни. Наиболее развита она во время беременности и в послеродовой период.
Молочную железу часто называют выменем. Вымя коровы состоит из четырех самостоятельных желез. Каждая железа разделена на доли (их у коровы - 5-20), каждая доля - на дольки. Основной структурной и функциональной единицей железы является альвеола, окутанная густой сетью капилляров (рис. 61).
Рис. 61. Схема строения молочной альвеолы и ее кровообращения (по С.
Поттону): 1 - артериола; 2 - миоэпителиальная клетка; 3 - лактирующая клетка; 4 - капилляр; 5 - венула; 6 - выводной проток
476
Молоко синтезируется в альвеолах, частично - в мелких и средних выводных протоках. Из них оно поступает в крупные выводные протоки, после чего скапливается в молочной цистерне, а из нее через сосковый канал выделяется во внешнюю среду. Молочная железа функционирует в лактационный период, который у коровы длится в среднем 300 дней.
477
476 :: 477 :: Содержание

477 :: Содержание
Физико-химические свойства молока
Молоко - ценнейший продукт питания человека и животных. В него входят белки, липиды, углеводы. Белки молока коровы усваиваются на 96-99%, липиды - на 95, углеводы - на 98 %. Для питания людей обычно используется молоко коров, меньше - коз, овец, кобылиц, верблюдиц, ослиц, буйволиц, самок оленя, зебу, яка.
Молоко - полидисперсная система, состоящая из истинных и коллоидных растворов, суспензий и эмульсии. Молоко коровы представляет собой жидкость белого цвета с желтоватым оттенком сладковатого вкуса и своеобразного запаха.
Плотность молока 1,027-1,033, температура замерзания 0,54-0,57 °C, температура кипения 100,2 °C, осмотическое давление 6,66-6,76 кПа. Реакция среды кислая или близка к нейтральной: рН 6,5-7,0. Титруемая кислотность 1220 °T. Буферная емкость по кислоте 2,5, по щёлочи 1,4.
477
477 :: Содержание

477 :: 478 :: 479 :: 480 :: Содержание
Химический состав молока
В молоке около 200 индивидуальных веществ, которые условно можно разделить на пять основных групп (табл. 18).
Химический состав молока одного и того же вида животного зависит от породы и возраста самки, периода лактации, условий кормления и т. д. Для молока часто выделяют понятие COMO - сухой обезжиренный молока остаток. Установлена закономерность между содержанием в молоке COMO и интенсивностью роста молодняка. Если в молоке кобылы содержится 9,7% COMO масса новорожденного жеребенка
477
18. Химический состав молока, % (по А. И. Ивашуре)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Животное |
|
Вода |
|
Белки |
|
Липиды |
|
Углеводы |
|
Соли |
|
|
|
|
|
|
|
|
|
|||||
|
Корова |
|
88,0 |
|
3,2 |
|
3,5 |
|
4,9 |
|
0,8 |
|
|
|
|
|
|
|
|
|
|||||
|
Коза |
|
86,9 |
|
3,8 |
|
4,1 |
|
4,4 |
|
0,8 |
|
|
|
|
|
|
|
|
|
|||||
|
Овца |
|
83,6 |
|
5,1 |
|
6,2 |
|
4,2 |
|
0,9 |
|
|
|
|
|
|
|
|
|
|||||
|
Буйволица |
|
82,9 |
|
4,6 |
|
7,5 |
|
4,2 |
|
0,8 |
|
|
|
|
|
|
|
|
|
|||||
|
Як |
|
84,0 |
|
5,0 |
|
6,5 |
|
5,6 |
|
0,9 |
|
|
|
|
|
|
|
|
|
|||||
|
Лошадь |
|
90,3 |
|
1,9 |
|
1,0 |
|
6,5 |
|
0,3 |
|
|
|
|
|
|
|
|
|
|||||
|
Верблюд |
|
80,5 |
|
4,0 |
|
3,0 |
|
5,7 |
|
0,8 |
|
|
|
|
|
|
|
|
|
|||||
|
Мул |
|
89,2 |
|
2,6 |
|
1,9 |
|
5,7 |
|
0,6 |
|
|
|
|
|
|
|
|
|
|||||
|
Осел |
|
90,0 |
|
1,9 |
|
1,4 |
|
6,2 |
|
0,5 |
|
|
|
|
|
|
|
|
|
|||||
|
Зебу |
|
86,2 |
|
3,0 |
|
4,8 |
|
5,3 |
|
0,7 |
|
|
|
|
|
|
|
|
|
|||||
|
Лама |
|
86,5 |
|
3,9 |
|
3,2 |
|
5,6 |
|
0,8 |
|
|
|
|
|
|
|
|
|
|||||
|
Олень |
|
67,7 |
|
0,9 |
|
17,1 |
|
2,8 |
|
1,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
удваивается через 60 сут; при наличии в молоке коровы 12,7% COMO масса теленка удваивается через 47 сут и т. д.
Вода. В молоке вода находится в свободном и связанном состояниях. Свободная вода легко удаляется при сгущении, высушивании и других обработках. Связанная вода входит в состав сольватных оболочек коллоидов. В свежем молоке содержится 2,0-3,5% связанной воды, в обезжиренном - 2,13- 2,59, в сливках 20%-ной жирности - 2,5-3,42%, в сгущенном молоке - 11,62%.
Белки. Содержание белков в коровьем молоке достигает 2,9-4,0%. В обезжиренном молоке 45-55% белков составляет α-казеин. Его молекулярная масса - 19-100 тыс. В молоке он образует казеинат-кальций-фосфатный комплекс, участвующий в формировании оболочки жировых шариков.
α-Лактальбумин имеет молекулярную массу 14 437, устойчив к нагреванию, участвует в биосинтезе лактозы из галактозы и глюкозы. β- Лактоглобулин имеет молекулярную массу 36 тыс., денатурирует при рН 7 и нагревании до 70°C; его кристаллы не растворяются в воде и растворяются в разбавленных растворах солей.
Глобулины молока имеют высокую молекулярную массу (150 тыс. - 1 млн), их молекула содержит углеводный компонент, обладают свойствами липооксидаз.
Протеозо-пептонную фракцию представляют простые белки, связанные с углеводными компонентами:
478
гексозами, сиаловыми кислотами и гексозаминами. Фракция содержится в сыворотке молока (образуется после осаждения казеина) и мицеллах.
Кроме этого, в молоке имеются и другие белки -ферменты всех шести классов, красный протеин, лактолин и т. д.
Небелковые азотистые вещества. Из содержание составляет 0,021- 0,036%. Около половины небелкового азота приходится на мочевину, меньше - на аминокислоты, пуриновые основания, креатин и др.
Углеводы. Они находятся в свободной и связанной с белками формах. Свободные углеводы представлены лактозой (в среднем 4,7%), галактозой, глюкозой, фосфорными эфирами моноз, аминосахарами. Связанные углеводы составляют 0,3% молока. Это моносахариды, гексозамины, сиаловые кислоты, лактоза. Больше всего лактозы содержится в молоке носорога - до 36% общей массы.
Липиды. В молоке они представляют собой смесь нейтрального жира, стеринов, стеридов, фосфатидов, гликолипидов и их производных. Содержание их в молоке животных различных видов неодинаково (см. табл. 18).
Основу липидов молока составляют триглицериды (98-99% общей массы). В молочном жире больше всего остатков пальмитиновой, олеиновой, стеариновой и миристиновой кислот.
В молочном жире обнаружены 60-64 жирные кислоты от C4 до С26. Общее содержание ненасыщенных жирных кислот в жире летом достигает 34,45-42%,
зимой - 25,40-33,78%.
Холестерина в молоке 0,012-0,013%. Стерины и стериды концентрируются в оболочках жировых шариков.
Фосфатидов и гликолипидов в молоке 0,032-0,050%. Оболочки жировых шариков на 60% состоят из фосфатидов.

Основные кислоты - олеиновая, стеариновая и пальмитиновая. Молекулы сфингомиелинов и цереброзидов содержат остатки лигноцериновой, бегановой и трикозановой кислот - до 80% общей массы жирных кислот.
Витамины. Коровье молоко богато витаминами, мг/100 г: B 1 - 0,04, B2 - 0,15, PP - 0,1, С - 1,5,
479
A - 0,025, D - 0,05 · 10-3, Ε - 0,09. Иногда его обогащают витаминами. С этой целью животных кормят кормами, богатыми витаминами, вводят концентраты витаминов А и D или же E. Молоко обогащают витаминами биологическим путем, вводя микробы, способные синтезировать определенные витамины. Так, внесение в молоко штаммов молочнокислых бактерий дает возможность повысить в простокваше и кефире содержание витамина С в 2-4 раза, PP - в 5-10, B12 - B 20-50, B2 - B 1,5-2 раза.
Пигменты. Молоко содержит каротины (летом - 0,3-0,6 мг/кг, зимой - 0,05- 0,2 мг/кг), лактофлавин, небольшое количество хлорофиллов. От них зависит окраска молока.
Минеральные вещества. Содержание их в молоке составляет 0,7-1%. Они находятся в свободном и связанном состояниях. Молоко коровы содержит следующие основные минеральные вещества, г/кг: хлориды - 2,01; фосфаты - 3,32; цитраты - 3,21; гидрокарбонат натрия - 0,25; сульфат натрия - 0,18. Молоко богато кальцием (11,2-12,8 мг). 78% его - в фосфатах и цитратах, 22% связано с казеином. Кроме этого, молоко содержит многие микроэлементы - Fe, Cu, Zn, Mn.
Минеральные вещества находятся в виде солей, кислот, ионов, биокомплексов, входят в состав металлоэнзимов и др.
Газы. В свежем молоке содержание газов, находящихся в растворенном состоянии, доходит до 70 мл на 1 л. Больше всего в нем CO2 (50-70% общей массы газов), азота (20-30%) и O2 (20-30%). В молоке, полученном в плохо вентирируемых помещениях, может быть NH3. В процессе хранения содержание газов в молоке уменьшается, а затем остается на одном уровне.
480
477 :: 478 :: 479 :: 480 :: Содержание

480 :: 481 :: 482 :: 483 :: 484 :: 485 :: Содержание
Образование составных частей молока
Между деятельностью молочной железы и кровообращением существует тесная связь. Так, для образования 1 л молока через железу должно проциркулировать около 650 л крови. В начале лактационного периода это соотношение равно 1 :400, несколько позже -
480
1 : 450, в середине - 1 : 650 и в конце - 1 : 1000 и больше. У высокопродуктивных коров такое соотношение более низкое. На функционирование железы расходуется 10% энергии питательных веществ, поступивших с кровью.
Процесс образования молока следующий. Исходные вещества с током крови по наружной срамной и частично промежностной артериям поступают в капиллярную сеть альвеол, из них - в эпителиальный слой. Он обладает избирательной способностью: пропускает через поры лишь те вещества, которые необходимы для образования молока. Часть веществ крови без изменений поступает в альвеолярную полость. Это некоторые белки (иммунные глобулины), небелковые азотистые вещества, глюкоза, жирные кислоты, витамины, гормоны, минеральные соли и др. Большинство составных частей молока (белки, липиды, углеводы) синтезируются из "сырья", которое проникает через базальные мембраны в клетки альвеолярного эпителия.
Химический состав плазмы крови и молока различный, %:
Химическое вещество |
Плазма крови |
Молоко |
Вода |
91,0 |
87,0-88,0 |
Глюкоза |
0,05 |
Следы |
Лактоза |
Следы |
4,8 |
Альбумины |
3,2 |
0,5 |
Глобулины |
4,4 |
0,05 |
Свободные аминокислоты |
0,003 |
Следы |
Казеин |
Следы |
2,9 |
Жир |
0,09 |
3,8 |
Фосфолипиды |
0,20 |
0,04 |
Холестерин |
0,17 |
Следы |
Кальций |
0,009 |
0,12 |
Фосфор |
0,01 |
0,10 |
Натрий |
0,34 |
0,05 |
Калий |
0,03 |
0,15 |
Хлор |
0,34 |
0,11 |
Лимонная кислота |
Следы |
0,20 |
Клетки альвеолярного эпителия обладают хорошо развитым ядром и цитоплазмой, эндоплазматической сетью и комплексом Гольджи, митохондриями и лизосомами (рис. 62). Основной фрагмент молока - жировой шарик. В секреторном цикле клеток альвеолярного эпителия различают пять фаз:
481
Рис. 62. Электронофотограмма
секреторной клетки молочной железы коровы (по П. З. Лагодюку и Г. В. Дронику): я - ядро; м - митохондрии; эс - эндоплазматическая сеть; жг - жировая глобула; бг - белковая гранула (х16 150)
1)поглощение клеткой предшественников молока, поступающих в нее из крови и тканевой жидкости;
2)внутриклеточный синтез сложных молекул секрета;
3)формирование из них гранул или капель;
4)продвижение капель к апикальному краю клетки;
5)выход секрета из клетки в просвет альвеолы и восстановление клеткой исходной структуры.
Эти процессы катализируются оксидоредуктазами (обеспечивают химической энергией), синтетазами (осуществляют биосинтез белков, жиров, лактозы и др. соединений молока) и ферментами других классов. Молокообразование регулируется нейрогуморальным путем.
Во время лактации высокопродуктивная корова ежесуточно дает 15-30 л молока. С молоком ежесуточно выделяется 500-1000 г белка, 600-1200 - жира, 700-1400 г лактозы. У коровы со средней суточной
482
продуктивностью 15 л молока (4500 кг в год) сосуды вымени ежесуточно пропускают около 9 т крови.
Биосинтез белков. Основная масса белков молока синтезируется в молочной железе из аминокислот. Биосинтез белков протекает типично. В клетки эпителия поступают аминокислоты, часть из низ синтезируется аминированием жирных кислот. Аминокислоты под действием специфических ферментов активируются. Аденилат аминокислоты взаимодействует с соответствующей тРНК, транспортируется к полисомам, где и включается в полипептидную цепочку. К молекулам простых белков могут присоединяться простетические группы.
Формируются вторичная, третичная и четвертичная структуры белковой молекулы. Образуются гранулы белка, которые по канальцам комплекса Гольджи направляются к апикальному краю клетки, включаются в состав жировых шариков и выделяются в альвеолярную полость (см. рис. 61).
Биосинтез углеводов. Основной углевод молока - лактоза. 80% ее синтезируется из глюкозы, 20% - из ацетата и пропионата. Образование лактозы протекает в несколько стадий.
Вначале глюкоза под влиянием фосфоглюкокиназы фосфорилируется:
Глюкоза+АТФ → Глюкозо-1-фосфат+АДФ.
Затем глюкозе-1-фосфат взаимодействует с УТФ:
УТФ+Глюкозо-1-фосфат → УДФГ+H2P2О7.
УДФГ под влиянием УДФ-глюкозо-эпимеразы превращается в УДФгалактозу.
Дальше под влиянием лактозосинтетазы в присутствии специфических белков А и В образуется молекула лактозы:
УДФ-галактоза+Глюкозо-1-фосфат → Лактозо-1-фосфат+УДФ; Лактозо-1 -фосфат → Лактоза+Н3РO4;
УДФ+АТФ → АДФ+УТФ.
483
Биосинтез липидов. Основа липидов молока - молочный жир. Биосинтез липидов состоит из двух процессов: образования жирных кислот и глицерина и образования триглицеридов.
Глицерин поступает в альвеолы из циркулирующей крови или синтезируется в клетках альвеолярного эпителия из глюкозы, аминокислот, жирных кислот. Жирные кислоты поступают в молочную железу с током крови.
Часть их образуется в тканях молочной железы из ацетата. У жвачных около 50% уксусной кислоты, которая образуется в пред желудках, идет на синтез жирных кислот молочного жира. Жирные кислоты в основном синтезируются в межальвеолярной ткани вымени, поступают затем в клетки альвеолярного эпителия.
Образование триглицеридов подробно описано на с. 95.
Биосинтез происходит в базальных участках клеток альвеол. Капелька жира окутывается частицами белка и перемещается к апикальному краю клетки, формируясь в жировой шарик (рис. 63).
Рис. 63. Стадии образования жирового шарика (по В. Баргману): 1 - митохондрия клетки молочной альвеолы; 2 - эндоплазматическая сеть; 3 - комплекс Гольджи; 4 - капли жира; 5 - зернышки белка; 6 - вакуоли; 7 - микроворсинки; 8 - базальная мембрана
484
Наряду с молочным жиром в клетках альвеолярного эпителия и выводных протоков синтезируются стерины и стериды, фосфатиды и гликолипиды.
Некоторое количество названных выше соединений поступает в альвеолы молочной железы с током крови,
485
480 :: 481 :: 482 :: 483 :: 484 :: 485 :: Содержание
485 :: 486 :: Содержание
Молозиво
Молозиво - это секрет молочной железы в первые 5-7 сут после родов.
У коровы молозиво представляет собой жидкость желтоватого, иногда желтовато-коричневого, цвета, вязкой консистенции, солоноватую на вкус, со специфическим запахом. Плотность молозива - 1,035-1,082, вязкость - 4,4.
От молока отличается высокой кислотностью. В молозиве коровы содержится 72% воды, до 20% белков, 7,5-8,5% липидов, 3,5% лактозы, 3,5% минеральных солей.
Богато иммунными телами (они обеспечивают пассивный иммунитет у новорожденных на первом этапе жизни), антитоксинами, витаминами, каротином (в 50-100 раз больше, чем в молоке), минеральными веществами и другими соединениями. В молозиве в 2-3 раза больше фосфатидов, чем в обычном молоке.
Видовые отличия молозива животных различных видов приведены в таблице 19.
19. Химический состав молозива в ранний послеродовой период, %
Животное 
 Вода
Вода 
 остатокСухой
остатокСухой 
 Липиды
Липиды
 Общийбелок
Общийбелок 
 Казеин
Казеин
 Альбумины
Альбумины
 Глобулины
Глобулины
 Углеводы
Углеводы
 Зола
Зола
 Плотн
Плотн
|
Корова |
|
66,4 |
|
33,6 |
|
6,5 |
|
22,49 |
|
5,57 |
|
10,45 |
|
6,47 |
|
2,13 |
|
1,37 |
|
1,08 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Овца |
|
69,74 |
|
30,26 |
|
8,85 |
|
17,35 |
|
6,97 |
|
6,24 |
|
4,14 |
|
2,75 |
|
1,29 |
|
1,03 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Коза |
|
71,84 |
|
28,16 |
|
14,70 |
|
8,40 |
|
3,68 |
|
2,84 |
|
1,88 |
|
2,94 |
|
0,99 |
|
1,03 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
Буйволица |
|
70,56 |
|
29,44 |
|
5,50 |
|
20,85 |
|
4,22 |
|
11,30 |
|
5,33 |
|
2,02 |
|
1,07 |
|
1,07 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Кобыла |
|
86,11 |
|
13,89 |
|
2,33 |
|
6,10 |
|
3,66 |
|
2,42 |
|
1,24 |
|
4,49 |
|
0,64 |
|
1,04 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
485 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1.Каковы особенности физико-химических свойств и химического состава молока и молозива различных видов животных?
2.Как и где синтезируются основные химические компоненты молока коровы?
486
485 :: 486 :: Содержание

486 :: 487 :: 488 :: Содержание
ГЛАВА 3
БИОХИМИЯ ПТИЧЬЕГО ЯЙЦА
Строение яйца
Яйцо сельскохозяйственной птицы - ценнейший пищевой продукт. Усвояемость белков яиц составляет 98%, липидов - 96%, калорийность усвояемых веществ в 100 г яйца (без скорлупы) - 630 кДж.
Яйцо птицы представляет собой яйцеклетку, окруженную желтком и белком с их оболочками и скорлупой (рис. 64). Форма и размер яиц зависят от вида и породы птицы, периода яйцекладки и возраста несушки, условий кормления и содержания. Чаще всего форма яйца овальная, почти круглая или продолговатая. В яйце различают следующие составные части.
Скорлупа - защитное образование яйца, предохраняющее его содержимое от неблагоприятных факторов внешней среды. В скорлупе имеется два слоя - наружный (губчатый) и внутренний (сосочковый). Наружный слой покрыт муциновой кутикулой. Толщина скорлупы яиц кур в среднем равна 350 мкм, уток-383, гусей - 535, индеек - 461, цесарок - 549 мкм. Наружный слой составляет 2/3 толщины. Скорлупа пронизана порами диаметром 0,006-0,054 мм. У кур их около 7500. Скорлупа куриного яйца белого цвета с оттенками от соломенно-желтого до светло-кофейного. Толщина кутикулы скорлупы яиц кур равна 0,005-0,01 мм. На скорлупу приходится 10% массы яйца.
Под скорлупой размещаются два листа подскорлуповых оболочек , которые сращены и в области тупого конца расходятся, образуя воздушную камеру - пугу. Пуга появляется после снесения яйца. Ее размер зависит от степени проницаемости скорлупы и продолжительности хранения яйца. Диаметр пуги свежего яйца курицы равен 15-18 мм, высота - 1,3-2,4 мм. В ней содержится 1829% кислорода.
486
Рис. 64. Схема строения куриного
яйца (по А. А. Романову и А. И. Романовой): 1 - наружный жидкий слой белка; 2 - средний плотный слой белка; 3 - средний жидкий слой белка; 4 - внутренний плотный слой белка; 5 - белковая связка; 6, 11 - градинки; 7 - слой темного желтка; 8 - слой цветного желтка; 9 - кутикула; 10 - скорлупа; 12 - воздушная камера; 13 - латебра; 14 - шейка латебры; 15 - ядро Пандера; 16 - желточная оболочка; 17 - бластодиск; 18 - внутренняя подскорлуповая оболочка; 19 - наружная подскорлуповая оболочка
Белок составляет в среднем 60% массы яйца. Желтоватого цвета. Состоит из четырех слоев: наружного жидкого, среднего плотного, среднего жидкого и внутреннего плотного. Четвертый слой называют градинковым слоем - содержит градинки, или халазы. В процессе хранения количество плотного белка уменьшается.
Желток составляет в среднем 30% массы яйца. Имеет шарообразную форму. Покрыт кератиновой желточной оболочкой. Обычно желток куриного яйца состоит из шести светлых и шести темных слоев, причем при медленной овуляции их число может возрастать. Последовательность светлых слоев желтка отражает его ежедневный рост в организме курицы. В центре желтка находится ядро диаметром около 6 мм - латебра. На анимальном полюсе яйца размещается зародышевый диск
487
размером 2 мм. От латебры к нему тянется в виде вазы светлый желток - шейка латебры. Частицы светлых слоев желтка имеют размер 4-75 мкм, темных - 25150 мкм.
488
486 :: 487 :: 488 :: Содержание

488 :: 489 :: 490 :: Содержание
Химический состав яйца
Скорлупа. Скорлупа яйца курицы в среднем содержит 1,6% воды и 98,4% сухого остатка. Сухой остаток состоит из органических (4,9%) и минеральных
(95,1%) веществ.
Органические вещества представляют собой белки и липиды.
Белок можно отнести к альбуминам. Он содержит остатки цистина, глутаминовой кислоты, аргинина, пролина, лизина и других аминокислот. Кутикула скорлупы имеет небольшое количество протеогликанов слизи.
Основой минеральных веществ скорлупы является карбонат кальция98,43%, в скорлупе есть некоторое количество карбоната магния-0,84% и трикальцийфосфата - 0,73%.
Подскорлуповые оболочки. Содержат 8% воды и 92% сухого остатка. В сухой остаток входит 4% минеральных и 88% органических веществ. Почти 28% органических веществ составляют белки. Наружная оболочка преимущественно состоит из кератина, два слоя внутренней оболочки - из кератина и протеогликанов. Кератин оболочек в 1,5-3 раза богаче серой, чем другие белки яйца.
В скорлупе и оболочках содержится пигмент опор-фирин.
Белок. Белок яйца состоит на 85,7% из воды, 12,7 - белков, 0,3 - липидов, 0,7 - углеводов, 0,6% - минеральных веществ.
Белки делятся на простые (овальбумин, овокональбумин, овоглобулин) и сложные (гликопротеиды - овомуцин и овомукоид). Различают пять индивидуальных белков: овальбумин, овомукоид, овомуцин, овокональбумин и овоглобулин. В овальбумин входит много остатков глутаминовой и аспарагиновой кислот, лейцина и аланина. Белок содержит ферменты белкового, липидного, углеводного, энергетического и
488
минерального обменов. Лизоцим придает ему бактерицидные свойства.
Липиды яичного белка - нейтральный жир, стерины, стериды, фосфатиды и гликолипиды - составляют 1% всех липидов яйца.
Углеводы яичного белка находятся в свободном и связанном состояниях. В нем в пересчете на глюкозу содержится 0,41% свободного сахара.
В овальбумине содержится 1,7% маннозы, в овомуцине - 14,9% маннозы и галактозы, в овомукоиде - 9,2% маннозы и галактозы, в овоглобулине - 4,0%
маннозы, овокональбумин содержит 2,8% маннозы и галактозы.
Белок яйца беднее пигментами, чем желток. По химической природе они являются липохромами и лиохромами. В яичном белке есть небелковые азотистые вещества: азот пуриновых и пиримидиновых оснований, аминокислоты, азот аммиака и следы креатинина.
В состав белка входят некоторые минеральные вещества: кальций, фосфор, натрий, калий, магний, сера, железо.
Желток. Средний химический состав желтка курицы, %: вода - 48,7; белки - 16,6; липиды - 32,6; углеводы - 1,0; минеральные вещества - 1,1.
Светлый и темный желток отличаются по химическому составу. Так, в светлом желтке около 85% воды, 4,6 - белков и 3,8% липидов. Темный желток содержит 45% воды, 15 - белков и 32% липидов. В обоих видах желтка одинаковое количество углеводов.
Белки желтка представлены ововителлином (77,4%) и оволиветином (22,6%). Ововителлин - это фосфопротеид, который содержит около 33% фосфора. Оволиветин богат серой. Идентифицирован еще белок желтка - фосфовитин. Белки желтка с фосфатидами образуют липопротеидные комплексы.
В желтке концентрируется около 99% всех липидов яйца: стерины и стериды, жиры, фосфатиды и гликолипиды. В составе жиров преобладают олеиновая, линолевая, линоленовая кислоты. Из насыщенных жирных кислот выделяются пальмитиновая и стеариновая.
Фосфатиды яичного желтка представлены оволецитином, овокефалином, овосфингомиелином и овокуарином. Желток куриного яйца содержит около 1,6% холестерина и некоторое количество цереброзидов.
489
Углеводы в желтке представлены глюкозой и полисахаридами, входящими в глюкопротеидные комплексы. В некоторых видах глюколипидов есть остатки галактозы.
Желток богат минеральными веществами. При его сжигании образуется около 1% золы, которая состоит из кальция, магния, хлора, калия, натрия, серы, железа и фосфора.
В желток входит 0,3-2,5% пигментов: липохромов и лиохромов. Липохромы имеют каротиноидную природу и составляют основную массу желтых, красных и оранжевых пигментов. К лиохромам относится оранжево-желтый пигмент желтка - овофлавин.
Желток богат витаминами A, D, E, B1, B2, B3, B6, B12 и др.

490
488 :: 489 :: 490 :: Содержание

490 :: 491 :: 492 :: Содержание
Биосинтез составных частей яйца
Яйцо образуется в органах размножения. Вначале растет и созревает яйцеклетка. Затем вокруг нее формируются желток, белок, оболочка и скорлупа.
У взрослых самок функционируют только левый яичник и яйцевод (рис. 65). Внешне яичник напоминает гроздь винограда. В нем размещаются яйцеклетки (у курицы - 900-3600 штук, у уток и гусей - 1000 и больше). Зрелая яйцеклетка имеет собственные оболочки, сосудистую и нервную сети и с помощью специальной ножки соединяется с яичником. У курицы-несушки наблюдается строгий порядок в размерах фолликулов и созревании яйцеклеток: от мелких пузырьков до крупных образований, заполненных желтком.
В процессе развития каждая яйцеклетка окружается кольцом фолликулярного эпителия, служащим посредником между ею и сосудистой сетью яичника. Через капиллярную сеть и межклеточную жидкость в яйцеклетку из крови поступают простые вещества, из которых синтезируются составные части яйца. Часть этих веществ используется яйцеклеткой без изменений. В последней фазе развития между яйцеклеткой и фолликулярным эпителием образуется желточная оболочка, состоящая из двух слоев: наружного (фолликулярного происхождения) и внутреннего (синтезируемого овоцитом). С наступлением созревания оболочка фолликула
490
Рис. 65. Органы образования составных частей яйца курицы (по А. А.
Романову и А. И. Романовой) : 1 - ствол яичника; 2 - маленькие яйцеклетки; 3 - созревшие яйцеклетки; 4 - стигма; 5 - отверстие яйцевода; 6 - перешеек с несформированным яйцом; 7- правый рудиментарный яйцевод; 8 - клоака; 9 - пустые фолликулы; 10 - воронка; 11 - шейка воронки; 12 - область секреции белка; 13 - матка; 14 - влагалище
лопается, наступает овуляция, при которой яйцеклетка, окруженная желтком и желточной оболочкой, проходит в воронку яйцевода.
Из нее яйцеклетка поступает в другие отделы органов размножения. При наличии сперматозоидов в воронке происходит оплодотворение. Во время прохождения яйцеклетки через белковую часть яйцевода 12 формируется белок яйца. Он синтезируется клетками трубчатых желез верхнего участка яйцевода из аминокислот и простетических групп. Вначале формируется градинковый слой, а потом средний плотный, внутренний и наружный жидкие слои белка. Образование градинок завершается в перешейке яйцевода и в матке.
Железы перешейка секретируют вещества, из которых вначале образуется внутренняя подскорлупная оболочка, а затем - наружная. Здесь, в железах, синтезируется некоторое количество овопорфирина, придающего оболочкам светло-розовую окраску. Далее яйцо попадает в матку. Оно обволакивается

секретом
491
маточных желез, состоящим из воды, коллагеноподобного протеина, минеральных солей и других веществ. Вначале на подскорлупных оболочках формируется сосочковый слой, затем - губчатый и, наконец, кутикула.
Отложение минеральных солей катализируется ферментными системами. Так, под влиянием карбоангидразы возникает угольная кислота, которая с ионами Ca2+ образует карбонаты кальция. Щелочная фосфатаза осуществляет транспортирование фосфорсодержащих соединений, необходимых для формирования минерального остова скорлупы. В процессе образования скорлупа пропитывается пигментами (в виде крапинок, полос, клякс, пятен). Пигменты имеют гематиновую природу, образуются в печени и секретируются железами матки.
Из матки яйцо поступает во влагалище 14, клоаку 8, где из протеогликанов слизи формируется кутикула, и после этого выделяется во внешнюю среду.
В различных участках органов размножения яйцо находится неодинаковое время (из 23-26 ч, необходимых для его образования, 80% времени - в матке).
492
490 :: 491 :: 492 :: Содержание

492 :: 493 :: Содержание
О направленном воздействии на яйценоскость
Яйценоскость кур равна в среднем 170-190 яиц в год, уток -110-120, гусей - 40-50, индеек - 90-100, цесарок - 70-100. От кур современных яйценоских гибридов получают 300 яиц и более в год. Яйцекладка носит сезонный характер и начинается весной. При промышленном ведении птицеводства сезонность сглаживается и яйцекладка планируется в течение года. У кур она начинается в возрасте 5-6 мес, достигая наибольшей интенсивности к 8-11 мес. На второй год жизни снижается на 10-15%, на третий годна 9-19%. Протекает она без оплодотворения яйцеклетки, что дает возможность хозяйствам содержать кур без петухов. Масса яиц кур - 55-65 г, уток и индеек - 80-100, гусей - 130-160. Курица, снесшая за год 200 яиц со средней массой одного яйца 55 г, производит около 11 кг яичной массы, что в 5-6 раз превышает массу ее тела.
492
На яйценоскость влияют внутренние и внешние факторы. К внешним факторам следует отнести кормление, содержание и др. Учитывая это, можно направленно влиять на продуктивность птицы. В частности, введением в
рационы различных веществ (аминокислот, белков, липидов, углеводов, витаминов, минеральных соединений) можно улучшить качество яиц, увеличить продолжительность яйценоскости и в итоге повысить продуктивность кур. Изменение светового режима содержания птицы позволяет получать яйцо в нужные периоды года, т. е. управлять сезонностью и уровнем продуктивности.
К внутренним факторам управления продуктивностью следует отнести породность, линейность, возраст и другие полезные признаки. Умело используя эти факторы, можно довести среднюю яйценоскость курицы-несушки до 280300 штук и более яиц в год, одновременно снизив затраты на их производство.
Контрольные вопросы
1.Каковы питательная ценность, строение и химический состав различных частей яйца птицы?
2.Как и где происходит биосинтез основных структурных и химических компонентов птичьего яйца? Как можно влиять на эти процессы?
493
492 :: 493 :: Содержание

493 :: 494 :: Содержание
ГЛАВА 4
БИОХИМИЯ КОЖИ И ШЕРСТИ
Кожа - наружный покров тела животных и человека. Она выполняет ряд жизненно важных функций: барьерную, рефлекторную, выделительную, дыхательную, терморегуляторную, биосинтетическую, депо крови и адсорбционную. У крупного рогатого скота на кожу приходится 6-8% общей массы, у овец (без руна) -5-7%. Кожа состоит из эпидермиса, дермы и подкожной клетчатки. В эпидермисе различают четыре слоя: роговой, блестящий, зернистый и производящий. Дерма имеет два слоя: сосочковый и сетчатый. Толщина кожи в различных участках организма неодинакова, что зависит от вида, породы, возраста, условий кормления и содержания животных. В коже коров эпидермис составляет 2,2%, дерма - 88,2, подкожная клетчатка - 9,6% общей массы.
493
Кожа используется в легкой промышленности для изготовления обуви, одежды, галантерейных и шорно-седельных изделий. Среди производных кожи особое место занимает волосяной покров - шерсть, используемая в текстильной промышленности. Ее чаще всего получают от овец, меньше - от коз, кроликов, верблюдов, лам, альпака, викуний, собак и животных других видов.
494
493 :: 494 :: Содержание

494 :: 495 :: 496 :: 497 :: 498 :: 499 :: 500 :: Содержание
Биохимия кожи
Химический состав. В коже в среднем содержится 65-76% воды и 24-35% сухого остатка. Последний состоит из белков, углеводов, липидов, минеральных соединений и других веществ.
Белки. В коже отмечается высокое содержание их - 86% сухого остатка. Основные из них - коллаген (около 95%), эластин, кератин, альбумины, глобулины, ДНП, РНП. Различные участки и слои кожи содержат неодинаковое количество белков. Так, сырая кожа жеребца-тяжеловоза в области спины содержат 26,75% белков, в области бедра - 26,58, брюха - 23,09%.
Основой эпидермиса является кератин. Он составляет 2/3 массы рогового слоя, отличается высокой стойкостью к различным температурным и химическим воздействиям.
Около 99% сухого вещества дермы составляют белки-коллаген (до 93-99%), эластин (0,1-0,9%), альбумины и глобулины (0,4-1,9%) и другие (0,4%).
В коже содержатся ферменты шести классов, принимающие участие в различных видах обмена веществ. Щелочная фосфатаза концентрируется в основном в зернистом слое эпидермиса, волосяных фолликулах и клетках сальных желез, липаза - в подкожной жировой клетчатке и клетках сальных желез.
Н е б е л к о в ы е а з о т и с т ы е в е щ е с т в а. Составляют 17-19%
массы общего азота кожи. Представлены пептидами, аминокислотами, ДНК, РНК, продуктами обмена - мочевиной, мочевой кислотой, креатинином, аммиаком и его солями, пигментами и другими веществами. Так, содержание азота и нуклеиновых кислот в коже овец следующее, мг/100 г в пересчете на сухое вещество (почти весь цифровой материал главы по И. А. Макару, 1977):
|
494 |
|
|
Общий азот |
13,59 |
РНК |
47,36 |
Остаточный азот |
503,72 |
ДНК |
28,55 |
Амминный азот |
100,85 |
|
|
П р и м е ч а н и е . Содержание общего азота выражено в процентах.
Содержание остаточного азота в коже возрастает при различных патологических процессах (дерматитах, травмах, лишаях, экземах и др.).
У г л е в о д ы . В коже содержится 1-2% углеводов. Это моносахариды, гомо- и гетерополисахариды, продукты их метаболизма.
Содержание компонентов углеводного обмена в коже овец следующее,
мг/100 г:
Общий сахар |
971,00 |
Молочная кислота |
429,53 |
Гликоген |
272,20 |
Гексозамины |
209,13 |
Глюкоза |
25,40 |
Глюкуроновая |
|
Пентозы |
181,16 |
кислота |
179,05 |
Пировиноградная кислота |
43,14 |
Гликозаминогликаны |
24,35 |
Кожа - депо углеводов. Содержание их возрастает до 5% сухой массы после кормления животных кормами, богатыми углеводами. В коже травоядных животных углеводов больше, чем у плотоядных. Так, кожа кролика содержит
0,09-0,11% глюкозы, собаки - 0,05-0,06, кошки - 0,06-0,07%.
В коже наблюдается послойная локализация углеводов. Так, больше всего гликогена сосредоточено в эпидермисе (производящий и зернистый слои), клетках сальных и потовых желез, во внешнем эпителиальном влагалище волосяных фолликул. Слои дермы сравнительно бедны гликогеном. Здесь преобладают глико-заминогликаны, составляющие химическую основу соединительнотканных волокон и межклеточного вещества.
Л и п и д ы . Кожа содержит различные группы липидов и продукты их метаболизма. В коже овец их количество, мг/100 г:
Общие липиды |
10860,0 |
Фосфолипиды |
2653,0 |
Общий холестерин |
1275,1 |
Свободный холестерин |
215,5 |
Эфиры холестерина |
1059,2 |
495
15% липидов эпидермиса представлены холестерином, треть холестерина находится в этерифицированном состоянии. Основная масса липидов эпидермиса -фосфатиды, содержание которых в клетках возрастает в направлении от рогового слоя к производящему. В дерме содержится 1-11% фосфатидов в пересчете на сухой остаток ткани, из них 60% составляют лецитины, 15 - кефалины, 7% - сфингомиелины. Липиды подкожной клетчатки в основном представлены триглицеридами. Сальные железы отличаются высоким содержанием липидов, в частности стеринов и стеридов. В коже овец выявлено 33 жирных кислоты, 40% которых приходится на долю пальмитиновой, стеариновой и церотиновой кислот. Липидный состав кожи изменяется при многих кожных болезнях. Так, при псориазе чешуйки эпидермиса содержат 0,5- 2,3% холестерина.
С о д е р ж а н и е в и т а м и н о в. В коже происходит биосинтез витамина
D3, содержание которого достигает 3,3 мкг (120 ME) на 1 г.
Содержание витаминов в коже овец следующее, мкг/г сухого вещества:
Витамин С |
3,0 |
Витамин H |
0,046 |
Витамин B1 |
2,0 |
ПАБК |
24 |
Витамин B2 |
1,9 |
Витамин Bc |
0,11 |
Витамин PP |
15,0 |
Холин |
2471,0 |
Витамин В6 |
0,18-0,66 |
Инозит |
526 |
Витамин B12 |
0,021 |
Витамин А |
2,71 |
П р и м е ч а н и е . |
Содержание |
витамина С выражено |
в миллиграмм- |
процентах. |
|
|
|
С о д е р ж а н и е м и н е р а л ь н ы х в е щ е с т в . В коже содержится около 1% минеральных веществ в пересчете на сухую массу, в эпидермисе - 2%. Кожа - депо натрия, калия, кальция и других химических элементов. Натрий в основном сосредоточен в межклеточной жидкости (в виде хлоридов), калий - в клетках, фосфор - в составе органических соединений (РНК, ДНК, фосфатидов и др.), сера - в молекулах кератина, цистеина, цистина и глутатиона, железо - в митохондриях и т. д.
Содержание минеральных веществ в коже овец следующее, мг/100 г в пересчете на сухое вещество:
|
|
496 |
|
Калий |
322-558 |
Медь |
0,56 |
Натрий |
122-247 |
Цинк |
2,4 |
Кальций |
15-65 |
Железо |
1,0 |
Магний |
18-34 |
Мышьяк |
0,26 |
Фосфор |
351 |
|
|
Обмен веществ в коже. Для кожи типичны общие закономерности обмена веществ, изложенные раньше (см. часть I "Общая биохимия"). Кроме того, для кожи как органа характерны особенности обмена вещества, обусловленные ее многогранными функциями.
О б м е н б е л к о в. В клетках кожи, кроме верхних слоев эпидермиса, верхних слоев волосяных фолликул и центральных участков сальных желез, беспрерывно синтезируются белки. Биосинтез молекулы белка протекает обычным путем, кроме кератина (см. далее).
Основным материалом для биосинтеза белков служат аминокислоты и другие вещества, поступающие сюда с током крови. Часть аминокислот образуется в клетках нижних слоев эпидермиса и слоев дермы за счет продуктов
деятельности метаболических циклов. Часть аминокислот возникает при переаминировании. О наличии этих процессов свидетельствует высокая активность ферментных систем. Так, активность аланинами-нотрансферазы в коже овцы составляет 623 ед/г сухой ткани, а аспартатаминотрансферазы - 17 193.
Для белков кожи характерна высокая степень катаболизма, о чем свидетельствует уровень остаточного и аминного азота и особенно азота мочевины (0,007% массы сырой ткани кожи овцы) и аммиака (0,009 %) Можно полагать, что в коже, особенно в ее потовых железах, функционирует орнитиновый цикл. Так, активность аргиназы составляет 12,84 мкМ мочевины на 1 г сухой ткани кожи овцы, а орнитин-карбамоилтрансферазы - 35,7 мкМ цитруллина на 1 г сухой ткани.
О б м е н у г л е в о д о в. В коже функционируют ферментные системы, синтезирующие гликоген (фосфорилаза, амило-1,6-глюкозидаза). Они выявляются в эпидермисе в первой половине эмбриогенеза. Интенсивность синтеза гликогена здесь уменьшается по мере развития рогового слоя. У взрослых животных синтез и распад гликогена протекают с одинаковой
497
скоростью. Около 5% глюкозы здесь превращается в уридин-5-дифосфатглюкозу - предшественник гликогена. В коже, особенно в слоях дермы, функционируют ферментные системы, под влиянием которых из поступающего с током крови "сырья" и продуктов местного метаболизма в фиброцитах и тучных клетках синтезируются гликозаминогликаны.
Для гликогена и гетерополисахаридов типична высокая скорость метаболизма. Период полураспада молекулы хондроитинсерной кислоты в дерме равен 8 сут. В коже функционируют анаэробный гликолиз и гликогенолиз (особенно в эпидермисе и волосяных фолликулах), ЦТК и пентозофосфатный путь. Некоторая часть гликогена и декстринов расщепляется амилазой и мальтазой.
К о ж н о е д ы х а н и е. В ходе обмена углеводов, липидов и других веществ образуются АТФ и ее аналоги, поглощается кислород и в виде продуктов обмена выделяются углекислый газ, вода и другие соединения. Объем газообмена через кожу у животных невелик - в пределах 1% общего газообмена. У лошадей количество углекислого газа, выделяемого кожей, равно 0,75% от выводимого легкими. Интенсивность кожного дыхания возрастает при повышении температуры среды и мышечной работе. Человек при 30 °C ежесуточно через кожу выделяет 7,0-9,0 г углекислого газа и поглощает 3-4 г кислорода.
О б м е н л и п и д о в. Липиды кожи имеют различное происхождение. Часть из них синтезируется в клетках кожи за счет компонентов липидного обмена, поступающих с током крови (глицерина, холестерина, ВЖК и т. д.).
Часть липидов, в основном триглицериды, поступают для депонирования в подкожной клетчатке в готовом виде. Основная масса липидов синтезируется в липоцитах подкожной клетчатки из компонентов промежуточного обмена углеводов, белков и других веществ, о чем свидетельствует высокая активность лигаз, участвующих в этих реакциях, а также большие концентрации ацетилКоА - основного строительного блока для синтеза ВЖК и холестерина.
Для кожи характерен высокий уровень активности липолитических ферментов. Активность липазы в коже овцы и собаки намного большая, чем у других видов животных. При кератинизации фосфатиды разрушаются и
498
за счет их ВЖК в клетках эпидермиса синтезируется холестерин и его эфиры.
О б м е н в и т а м и н о в. Кожа - орган, наиболее чувствительный к недостатку, отсутствию или избытку отдельных витаминов. В коже происходит биосинтез витамина Ds. Он протекает в два этапа. Вначале под влиянием НАДФ-зависимой 7-дегидрохолестеринредуктазы в ядре холестерина образуется вторая двойная связь и возникает 7-дегидрохолестерин. Затем под влиянием ультрафиолетовых лучей в глубоких слоях кожи образуется еще одна двойная связь и формируется молекула витамина D3 (см. с. 247).
П и г м е н т н ы й о б м е н. Основной пигмент кожи - меланин. Он определяет окраску кожи, волос, шерсти (у птиц - оперения) и защищает организм от избытка ультрафиолетовых лучей. Меланин образуется в меланоцитах. После заполнения пигментом меланосомы отмирают и превращаются в пигментсодержащие гранулы. Меланин образуется из тирозина. Под действием медьсодержащего фермента тирозин окисляется в диоксифенилаланин (ДОФА), который после вторичного окисления и циклизации превращается в индол-5,6-хинон, а он конденсируется в меланин
C27H98O33N14S.
В клинической практике сравнительно часто встречаются злокачественные опухоли, чрезмерно богатые меланином, - меланомы.
В ы д е л и т е л ь н ы е ф у н к ц и и к о ж и. В коже расположены потовые и сальные железы.
Потоотделение - образование пота и выделение его на поверхность кожи потовыми железами. Выражено у человека, обезьян, копытных, почти отсутствует у грызунов, наземных хищников, низших млекопитающих. Обеспечивает стабильную температуру тела и поддерживает на определенном уровне водный и солевой обмены. В потовых железах функционируют ферментные системы, обезвреживающие аммиак. Потоотделение имеет важное значение при заболеваниях почек и печени, так как потовые железы дополняют функции этих органов.

Пот - бесцветная или слегка опалесцирующая жидкость, солоноватого вкуса, у лошади и плотоядных рН пота кислый, у жвачных - слабощелочной. Количество
499
и химический состав пота зависят от вида, возраста, породы, температуры среды, эксплуатации, рациона животного. У человека за сутки выделяется 0,5- 1,0 л пота, у крупных сельскохозяйственных животных (например, у лошадей) в несколько раз больше. В состав пота лошади входит 94,38% воды, 5% минеральных солей (из них 0,3-0,5% NaCl) и 0,6-0,7% органических соединений (мочевины - до 0,1% креатинина, мочевой кислоты и др.). Химический состав пота изменяется при патологических состояниях.
Кожное сало - продукт деятельности сальных желез, выводные протоки которых открываются в волосяные фолликулы или непосредственно на поверхность кожи. Кожное сало предохраняет кожу и ее производные от высыхания и попадания в организм избытка влаги, микроорганизмов, ядовитой пыли и др. В сальных железах интенсивно функционируют ферментные системы, синтезирующие липиды, а также ферменты биосинтеза и расщепления гликогена. Особый интерес представляет смешанный секрет потовых и сальных желез у овец - жиропот. Он защищает шерсть от избытка влаги и загрязнений, делает ее прочной и мягкой, участвует в образовании руна. Его получают после отмывания шерсти. В состав жиропота входит около 32% воды, 50% липидов и 18% других соединений. Из жиропота получают ланолин - основу для приготовления лечебных мазей и косметических средств.
Р е а к ц и я с р е д ы к о ж и. У большинства животных рН дермы равен 7,4-7,6; производящего слоя эпидермиса - 7,0-7,4; зернистого слоя - 7,0-6,7; блестящего - 6,0-5,5; рогового - 5,0-3,0. Подкожная клетчатка имеет рН 6,95- 7,40.
Кожа сгибательной поверхности предплечья у человека имеет рН 5,1, паха - 5,7, подмышки - 5,8. Смещение рН кожи в щелочную сторону способствует возникновению грибных и бактериальных заболеваний.
500
494 :: 495 :: 496 :: 497 :: 498 :: 499 :: 500 :: Содержание

500 :: 501 :: 502 :: 503 :: 504 :: 505 :: Содержание
Биохимия шерсти
Шерсть - волосяной покров кожи млекопитающих. Из всех видов животных, от которых получают шерсть, наибольший интерес представляют овцы. От каждой тонкорунной овцы за год настригают около 5 кг шерсти, из которой можно изготовить 5 м ткани.
500
Отдельные породы овец разводят для получения смушек, меховых изделий и др.
В составе шерсти различают ость, переходной волос и пух. Структурной единицей является волос. Шерсть овец, кроме кроющего волоса на голове, конечностях, животе и мошонке, называют руном. Пучки шерсти, из которых состоит руно, называют штапелями. Руно грубошерстных овец состоит из косиц.
Химический состав шерсти. Элементный состав шерсти овцы - 50% углерода, 21-24 - кислорода, 15-21 - азота, 6-7 - водорода, 2-5 - серы, 1-3% - другие элементы. Он зависит от породы, возраста, сезонных особенностей. Так, шерсть мериносных овец содержит 4% серы, курдючных - 3,3%.
Основой шерсти является кератин (99%), 1% составляют липиды, углеводы, другие органические и минеральные вещества.
В состав кератина входят остатки 20 аминокислот, которые, соединяясь между собой, образуют полипептидную цепь 1. Извиваясь, она формирует α- спираль (рис. 66, а). Три полипептидные цепи, свитые жгутом 2, создают протофибриллу б. И протофибрилл (девять по окружности и две в центре) образуют микрофибриллу б. Микрофибриллы соединяются между собой
Рис. 66. Схема строения кератина
501
аморфным веществом (матриксом) в макрофибриллу - составную часть корковой клетки и шерстного волокна. Полипептидные цепи соединяются между собой дисульфидными мостиками цистинового или моносульфидными мостиками лантионинового остатков. Кератин имеет две фракции: фибриллярную и аморфную. Фибриллярная фракция состоит из тяжелых (мол. масса 50-60 тыс.) белков с умеренным содержанием остатков цистина, а аморфная - из легких пептидов (мол. масса меньше 30 тыс.) с высоким содержанием остатков цистина (до 30%).
Соотношение между аморфной и фибриллярной фракциями 1:3.
Биохимические процессы шерстеобразования. Развитие волос начинается из клеток эктодермы. Они делятся и дифференцируются, что приводит к образованию наружного и внутреннего влагалищ волосяного фолликула, сальных и потовых желез. Эмбриональная соединительная ткань формирует соединительнотканный мешочек и волосяной сосочек, куда от глубокой сосудистой сети основы кожи проникают капилляры, от нервного сплетения - окончания. Первые зачатки волосяных фолликул у овцы появляются на 50-70-е сут эмбриогенеза, а к концу 3-го мес видны зачатки волос. В коже новорожденных ягнят волос 22-30% от общего количества взрослых овец, волосяных фолликул - 47-56%.
Материал для биосинтеза составных частей волоса - вещества, которые поступают с током артериальной крови в волосяной сосочек, затем путем диффузии и осмоса проникают в клетки наружного и внутренного влагалищ, где в клетках волосяных луковиц синтезируются кератин, меланин и другие соединения. Волосяные фолликулы содержат много нуклеиновых кислот, белков, аминокислот, углеводов, а также продуктов их метаболизма.
Основной источник химической энергии для шерстеобразования - жирные кислоты и ацетил-КоА, частично глюкоза. Некоторое количество глюкозы идет на биосинтез гликогена клеток волосяных фолликул, липидов, аминокислот и других соединений. Гликоген депонируется в клетках волосяных фолликул перед началом развития волоса, затем его содержание уменьшается и с прекращением роста волоса исчезает.
502
Расщепление углеводов происходит интенсивно, о чем свидетельствует высокая активность ферментных систем гликолиза, гликогенолиза, ЦТК, пентозного пути и ключевых продуктов углеводного метаболизма.
Биосинтез составных частей волоса начинается в клетках волосяного фолликула (рис. 67). В зоне митоза А клетки начинают интенсивно делиться; по мере продвижения вверх их деление прекращается. В зоне удлинения Б синтезируется кератин. Источником для его биосинтеза служат аминокислоты, концентрация которых здесь более высокая, чем в окружающих тканях. Вначале на тяжелых рибосомах в удлиненных клетках синтезируется фибриллярный
предшественник кератина. В последующих зонах С и D синтезируется аморфный кератин на рибосомах, не связанных с эндоплазматическим ретикулумом. Для него характерно высокое содержание цистеина, имеющего свободные SH-группы. Здесь одновременно формируется структура молекулы кератина путем агрегации полипептидных цепей за счет формирования внутри- и межпептидных связей. Реакция катализируется ионами меди Cu2+. В зоне уплотнения E происходит
Рис. 67. Схема биосинтеза основных составных частей волоса овцы (по И. А Макару и В. В. Гуменюку): 1 - кутикула; 2 - кортекс; 3 - сердцевина; 4 - волос; 5 - эпидермис; 6 - сальная железа; 7 - внутреннее влагалище волосяного фолликула; 8 - наружное влагалище волосяного фолликула; 9 - соединительнотканный мешочек; 10 - базальная мембрана; 11 - сосочек
503
окончательное формирование четвертичной структуры белка, клетки теряют более 50% воды, разрушаются лизосомы, а их ферменты (пептидазы, нуклеазы, кислая фосфатаза и др.) разрушают некератинизированные структуры. Их остатки как бы "смываются" и выталкиваются из клетки. Клетки, содержащие кератин, приобретают устойчивость и формируют слои стержня волоса. В следующей зоне фолликула F происходит слущивание клеток внутреннего корневого влагалища, выполняющего трофическую и транспортную роль. Сформированный волос смазывается в зоне шейки фолликула G секретом
сальной железы 6. Источником энергии для процессов кератинизации служат реакции клеточного дыхания, о чем свидетельствует высокая активность СДГ и ЦХО (зоны В, С, D, E).
Для волосяного фолликула характерен интенсивный липидный обмен. Наружное корневое влагалище богато фосфатидами и стеринами, внутреннее - глицеридами, холестерином, стеридами, ВЖК. Содержание фосфатидов в клетках внутреннего корневого влагалища уменьшается по мере развития в них процесса кератинизации.
Во время смены волос (при линьке) в волосяном сосочке прекращается кровообращение. Это приводит к прекращению размножения клеток в волосяной луковице; она ороговевает и вместе с волосом выпадает. Одновременно развивается новый волосяной фолликул, затем волосяная луковица и новый волос. Различают сезонную, возрастную и компенсаторную линьку. Сроки линьки можно в определенной степени сдвинуть под влиянием факторов кормления, содержания и регулирования продолжительности светового дня.
Направленное воздействие на шерстную продуктивность. Шерстная продуктивность - результат деятельности всего организма. На ее величину можно влиять различными факторами. В частности, учитывая направленность хозяйства, для увеличения шерстной продуктивности подбирают породы, наиболее продуктивные в данной зоне. В значительной степени влияет состав рациона. Добавление к рациону, бедному серой, соответствующих доз сульфата натрия способствует увеличению содержания цистина в пуховых волокнах на 9,5%, в остевых - на 14,2%. Добавление к рациону сульфата меди (8 мг на голову в сутки) и
504
витамина А (3500 ME) повышает настриг шерсти на 14%. Качество шерсти ухудшается при чрезмерном облучении животных ультрафиолетовыми лучами, особенно в высокогорных районах. Так, у животных, которые находились круглый год на горных пастбищах, содержание аминокислот кератина в верхней части штапеля уменьшалось за зимний период с 81,9 до 76,7%. Отсутствие или недостаток в составе кормов некоторых микроэлементов (особенно меди) отрицательно сказывается на шерстной продуктивности. Инъекция препарата соматотропина яркам в течение 60 сут позволяет увеличить рост шерсти на
38,7% (M. T. Таранов, 1976).
Контрольные вопросы
1.Каковы особенности химического состава и обмена веществ в коже животных в связи с ее функциями?
2.Какие биохимические процессы лежат в основе шерстеобразования и как этими процессами можно управлять?

505
500 :: 501 :: 502 :: 503 :: 504 :: 505 :: Содержание

506 :: 507 :: Содержание
ЛИТЕРАТУРА
Биохимия/Кучеренко H. E., Бабенюк Ю. Д., Васильев A. H. и др. - К.: Вища школа, 1988.-432 с.
Биохимия животных/Чечеткин А. В., Головацкий И. Д., Калимая П. А. и
др. - M.: Высшая школа, 1982.-512 с.
Бохински P. Современные воззрения в биохимии.-M.: Мир, 1987.-544 с.
Васильева E. А. Клиническая биохимия сельскохозяйственных животных. - M.: Россельхозиздат, 1982.- 344 с.
Вишняков С. И. Межклеточный обмен в организме животных.-M.: Агропромиздат, 1988. - 158 с.
Всасывание и секреция в тонкой кишке: субмикроскопические аспекты/Морозов И. А., Лысиков Ю. А., Питран В. В. и др. -M.: Медицина, 1988.-224 с.
Георгиевский В. И., Анненков Б. H., Самохин В. T. Минеральное питание животные. - M.: Колос, 1979. - 472 с.
Герасименко В. Г. Биохимия продуктивности и резистентности животных.- К.: Вища школа, 1987. - 224 с.
Де Дюв К. Путешествие в мир живой клетки. - M.: Мир, 1987. - 256 с.
Доис Э. Количественные проблемы биохимии.- M.: Мир, 1983. - 376 с.
Дюга Г., Пенни К. Биоорганическая химия. Химические подходы к механизму действия ферментов. - M.: Мир, 1983. - 512 с.
Кагава Я. Биомембраны. - M.: Высшая школа, 1985.-303 с.
Кассиль Г. H. Внутренняя среда организма. - M.: Наука, 1983. - 227 с.
Кононский А. И. Гистохимия.- К.: Вища школа, 1976.-279 с.
Кононский А. И. Физическая и коллоидная химия. - К.: Вища школа. 1986.-312 с.
Коэн Ф. Регуляция ферментативной активности. - M.: Мир, 1986.-144 с.
Крепс E. M. Липиды клеточных мембран. - Л.: Наука, 1981.-349 с.
Ленинджер А. Основы биохимии.-М.: Мир, 1985.-T. 1-3.
Макар И. А. Биохимические основы шерстной продуктивности овец.-M.:
Колос, 1977.-192 с.
Малахов А. Г., Вишняков С. И. Биохимия сельскохозяйственных животных. - M.: Колос, 1984. - 336 с.
Мецлер Д. Биохимия.- M.: Мир, 1980. - T. 1-3.
Мусил Я. Основы биохимии патологических процессов.-M.: Медицина, 1985.-432 с.
Мусил Я., Новокова О., Кунц E. Современная биохимия в схемах.-M.:
Мир, 1984.-216 с.
Новые методы практической биохимии/Под ред. В. Л. Кретовича, К. Ф.
Шольца.-.М.: Наука, 1988.-264 с.
506
Овчинников А. И., Горбатова К. К. Биохимия молока и молочных продуктов.-Л.: Изд-во ЛГУ, 1974.-258 с.
Овчинников Ю. А. Биоорганическая химия.-M.: Просвещение, 1987.-815 с.
Основы биохимии/Под ред. А. А. Анисимова. - M.: Высшая школа, 1986.- 551 с.
Основы биохимии/А. Уайт, Ф. Хендлер, Э. Смит и др..-M.: Мир, 1981.-T.
1-3.
Палландин А. В. Избранные труды.- К.: Наукова думка, 1975.- 452 с.
Перспективы биохимических исследований/Под ред. Дж. Туза, С.
Прентиса.-M.: Мир, 1987.-192 с.
Практикум по биохимии сельскохозяйственных животных/Чечеткин А.
В., Воронянский В. И., Покусай Г. Г. и др.-M.: Высшая школа, 1980.-304 с.
Райдер К., Тейлор К. Изоферменты.-M.: Мир, 1983.- 107 с.
Розен В. Б. Основы эндокринологии.-M.: Высшая школа, 1980.-344 с.
Рэкэр Э. Биоэнергетические механизмы: новые взгляды. - M.: Мир, 1979. - 216 с.
Серов В. В., Шехтер А. Б. Соединительная ткань, - Медицина, 1981.-312 с.
Скоупс P. Методы очистки белков, - M.: Мир, 1985.-358 с.
Спирин А. С. Молекулярная биология: структура рибосомы и биосинтез

белка. - M.: Высшая школа, 1986.- 303 с.
Стайер Л. Биохимия. - M.: Мир, 1984.-T. 1-3.
Строев E. А. Биологическая химия. - M.: Высшая школа, 1986.-479 с.
Торбенко В. П., Касавина Б. С. Функциональная биохимия костной ткани. - M.: Медицина, 1977.-272 с.
Филиппович Ю. Б. Основы биохимии.- M.: Высшая школа, 1985.-503 с.
Халмурадов А. Г., Тоцкий В. H., Чаговец P. В. Транспорт жирорастворимых витаминов.- К: Наукова думка, 1980.-216 с.
Царенко П. П. Повышение качества продукции птицеводства, пищевые и инкубационные яйца.- Л.: Агропромиздат, 1988.-240 с.
507
506 :: 507 :: Содержание

508 :: 509 :: 510 :: 511 :: 512 :: 513 :: 514 :: 515 :: 516 :: 517 :: 518 :: 519 :: 520 :: 521 :: 522 ::
Содержание
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
A
Авитаминозы 239, 241, 245, 249, 251, 254, 256, 257, 260, 263, 265, 272, 274, 277, 279, 281, 283, 285, 286, 287, 289, 290, 291
Агар-агар 43 Аденилаткиназа 104
Аденин 104, 112, 119
Аденозиндифосфорная кислота (АДФ) 101, 112, 211, 342, 345, 347-349
Аденозинтрифосфорная кислота (АТФ) 26, 54, 60, 61, 67, 96, 99, 112, 211, 343, 346, 348, 414, 418 Адреналин 69, 70, 152, 387-389
Азота баланс 170 Активаторы 305
Активный ацетат, см. Ацетил-КоА
Аланин 147, 181, 188, 190, 445, 448
Аланинаминотрансфераза 329, 497 Аланинрацемаза 332 Алкаптонурия 203 Алкогольдегидрогеназа 326
Аллантоин 135-137, 450, 460, 462
Альбуминурия 465
Альбумины 161, 304, 423, 424, 78, 494
Альдолаза 224, 331
Альдостерон 209, 215, 384, 459 Амилаза 45, 55, 220, 330
Амилоза 35-36 Амилопектин 35-36
Аминоацил-тРНК 183, 184, 333 n-Аминобензойная кислота (ПАБК) 291-292 β-Аминоизомасляная кислота 137
Аминокислот переаминирование (трансаминирование) 189 Аминокислоты 143, 415
-биосинтез 188
-гетероциклические 153
-диаминодикарбоновые 151, 152
-диаминомонокарбоновые 150, 151
-изоциклические 152
-моноаминодикарбоновые 149-150
-моноаминомонокарбоновые 147-149 α-Аминомасляная кислота 148 γ-Аминомасляная кислота 148, 408 Анаболизм 15
Ангиотензин 395, 459
508
Андрогены 106, 377, 381, 384
Андростан 377 Андростерон 378, 464
Ансерин 147, 187, 330 Антивитамины 238, 244, 248, 251, 260, 263, 265, 269, 272, 273, 278, 281, 284, 288, 292 Антикодон 116, 131, 184
Анурия 460 Апофермент 294, 305 L(+)-Арабиноза 26
Арахидиновая кислота 73, 391 Аргиназа 229, 230
Аргинин 150, 181, 193, 200, 305, 414
Аскорбиновая кислота 279-281
Аспарагин 149, 200, 305 Аспарагиновая кислота 124, 149, 188, 190, 305, 488
Аспартатаминотрансфераза 497
АТФ-аза 253, 413, 416, 418
АТФ-фосфогидраза, см. АТФ-аза Ацетальфосфатиды, см. Плазмалогены
Ацетил-КоА 62, 87, 96-98, 100, 106, 315, 328, 397, 398, 469
Ацетил-КоА-гидролаза 330 Ацетилхолин 328, 394, 407
Ацетилхолинэстераза (АХЭ) 217, 318-319, 413, 427 Ацетоацетил-КоА-тиолаза 105 Ацетонемия 71 Ацетоновые тела плазмы 425 Ацетонурия 71, 465
Ацетоуксусная кислота 109, 110, 196, 425
Ацидоз 71, 110, 259
Ацилатденилат 104
Ацил-КоА 98, 100, 104, 105, 264, 289, 290
Ацил-КоА-синтетаза 104 Ацилпероносящий белок (АПБ) 97
Б
Баланс водный 208 Барий 231 Белки 139
-биосинтез 182-187
-классификация 161-169
-коллоидное состояние 140-143
-методы выделения 169
-нервной ткани 401
-обмен 170, 196
-- всасывание 180
-- конечный 198-202
-- патология 203
-- переваривание 171-180
-- промежуточный 182
-- регуляция 202-204
-структура белковой молекулы 154-161
-химический состав 143
Белок Мура 402 -S-100 402
Билирубин 202 Билирубинурия 466 Биосинтез гликогена 51
-гликозаминогликанов 53
-глюкозы 53
-лактозы 53
-нуклеиновых кислот 121
-пептидов 181
-пиримидиновых нуклеотидов 128
-полинуклеотидов ДНК и РНК 127, 128, 129
-пуриновых нуклеотидов 121
-стеринов 98
-стеридов 98
-фосфатов 99
Биотин 70, 97, 313, 454
Бор 226 Брадикинин 395 Бром 225
509
В
Ваготонин 377 Вазопрессин (адиуретин, антидиуретический гормон 155, 209, 223, 361
Валин 148, 170
Ванадий 230 Витаминоподобные вещества 283 Витамины 238
-безазотистые 426
-водорастворимые 257
-- аскорбиновая кислота (витамин С) 279-281
-- биотин (витамин H) 277
-- биофлавоноиды (витамин P) 281-283
-- никотинамид (витамин B5, PP) 265-269
-- пантотеновая кислота (витамин В3) 263-265
-- пиродоксин (витамин B6) 269-272
-- рибофлавин (витамин B1) 260-263
-- тиамин (витамин B1) 257-260
-- фолиевая кислота (витамин Bc) 272-274
-- цианкобаламин (витамин B12) 274-277
-жирорастворимые 240
-- витамин F 254-255
-- кальциферол (витамин D) 245-249
-ретинол (витамин А) 240-245
-токоферол (витамин E) 249-251
-убихинон 256-257
-фарнохинон (витамин K2) 251-254
-филлохинон (витамин K1) 251-254
-классификация 240
-- физическая 240
-- химическая 240
Вода 204
-всасывание 208
-обмен 207
-- конечный 209
-- патология 209
-- промежуточный 208
-- регуляция 209
-свободная 206
-экзогенная 207
-эндогенная 207 Водный баланс 208 Воски 78
-ланолин 78
-пчелиный 78
-растительные 79
-спермацет 78
Высшие жирные кислоты 105
Г
D(+)-Галактоза 29, 49, 83, 168
Галактозамин 168 Галактуроновая кислота 29 Ганглиозиды 84, 107 Гастрин 173, 392 Гексозы 27, 168 Гексокиназа 226, 253, 329
Гем 165, 200, 202, 305, 314, 412
Гематин 165
Гемицеллюлоза 43
Гемоглобин 160, 165, 196, 202, 224, 427
Гемоглобинурия 465
Ген 131-135
-биохимия 129 Гепарин 40, 435
-- сульфат 41 Гептозы 31 Гестагены 380, 381
Гетерополисахариды 39 Гиалуронидаза 283, 336, 459
510
Гиалуроновая кислота 39, 283, 442 Гидрокарбонаты 431-433 Гидрокортизон 138, 384 Гидролаза эфиров глицерина, см. Липаза Гидролазы 329-331
Гипервитаминозы 241, 246, 266, 269 Гипергликемия 70, 425
Гиповитаминозы 241, 245, 249, 251, 254, 256, 257, 260, 263, 265, 269, 272, 274, 277, 279, 281, 283, 285, 286, 287, 289, 290, 291
Гипогликемия 70, 425 Гипоксантин 342 Гипопротеинемия 203
Гиппуровая кислота 103, 230, 264, 463
Гистамин 153, 173, 271, 393, 408 Гистидин 153, 194, 305, 310, 408, 463
Гистоны 162 Гликоген 37
-выделение из тканей печени 9
-гидролитическое расщепление 45
-распад 54
-синтез 397, 402, 415, 419, 452
-строение 37
Гликогенолиз 56, 60, 217, 417, 498
Гликозаминогликаны 39, 54 - нейтральные 42
Гликолиз 56, 57, 217, 226, 229, 397, 417, 498 Гликолипиды 83, 101, 108, 479, 489
Гликонеогенез 51, 452 Гликополисахариды 39
Гликопротеиды 168, 198, 359, 401, 402, 442
Гликохолевая кислота 85 Глиоксиловая кислота 396
Глицеральдегидфосфатдегидрогеназа 327
Глицерин 72, 102, 397, 398, 484
-обмен 103
-образование 95, 396
-фосфорилирование 87
D-Глицериновый альдегид 25 Глицеролкиназа 96 Глицерофосфатдегидрогеназа 95 Глицерофосфатиды 80, 100
-ацетальфосфатиды (плазмалогены) 81
-кардиолипины 82
-кефалины (коламинфосфатиды) 80
-лецитины 80
-серинфосфатиды 81 Глицерофосфорилхолин 89 Глицилглицин-гидролаза 325
Глицин 147, 189, 310, 374, 397, 414, 441, 454
L-Глутаматдегидрогеназа 189 L-Глутамат: НАД-оксидоредуктаза 325
Глутамин 121, 122, 124, 150, 200, 405, 415, 463 Глутаминовая кислота 150, 181, 188, 191, 305, 398, 405, 415, 463, 488
Глутатион 187, 308 Глутелины 163
Глюкагон (гиперглюкемический фактор) 375
D(+)-Глюкоза 28, 29, 46, 53, 168, 356, 357, 402
Глюкозамин 29, 168, 356
Глюкозо-1-фосфат 52, 53, 55, 56, 57 Глюкозо-6-фосфат 49, 52, 56, 57, 65, 69, 70
511
Глюкозо-6-фосфатаза 69 Глюкозурия 465 Глюконовая кислота 29 Глюкополисахариды 42 β-Глюкуронидаза 224
Глюкуроновая кислота 29, 69, 168, 464 Гомополисахариды 35 Гомоцистеин 311, 414 Гормоноиды 389
-пищевого канала 392 Гормоны 349
-вилочковой железы 371
-гипоталамуса 352
-гипофиза 354
-- задней доли 361
-- передней доли 354
-женские половые 380
-исполнители 351
-коры надпочечников 384
-мозгового вещества надпочечников 387
-мужские половые 377
-околоушной железы 37
-паращитовидной железы 369
-поджелудочной железы 373
-пусковые 351
-средней доли гипофиза 360
-тиреоидные 365-368
-щитовидной железы 365
-эпифиза 364
Грамицидин 347 Группа простетическая 305, 308, 311-314, ГТФ-аденилаткиназа 63
Гуанин 114, 132-136
Гуммиарабик 44
Д
Давление онкотическое 421 Дегидроандростерон 378 Дегидрогеназа флавинзависимая 104 Дезоксикортикостерон 209 D(+)-Дезоксирибоза 27, 397
Дезоксирибонуклеиновая кислота (ДНК) 111-115, 117-119, 128-130, 138, 294, 399, 494
Дезоксирибонуклеопротеиды (ДНП) 117, 164, 401, 494 Дезоксихолевая кислота 86 Декстран 44 Дерматан-сульфат 41 Десмостерин 99 Дигидросфингозин 101 Диглицериды 98, 100 Диоксиацетон 25 Дисахариды (биозы) 31
-представители 31-35
-расщепление 48
-тип связи 31
-физико-химические свойства 32
1,3-Дифосфоглицериновая кислота 58
ДНК-аза 118, 153, 154, 296, 305
ДНК-полимераза 128, 355
Ж
Железо 222
- обмен 223 Железопорфириновые комплексы 313 Желчные кислоты 85 Желчь 85
-печеночная 85
-пузырная 85 Жиры 107
-биосинтез 95-97
-нейтральные 72-76, 489
-переваривание 87
-превращения 102-106
-протоплазматические 74
-резервные 74
512
З
Зоостерины 77
И
Изолейцин 149, 170 Изолимонная кислота 62, 63 Изомераза 49, 332 Изоферменты 315 Изоцитратдегидрогеназа 63 Иминокислоты 153 Инвертаза 48
Индол 179, 201 Инозит 82, 106, 283-284, 415
Инозитфосфатиды 82, 100
Инсулин 70, 108, 152, 202, 373
Инулин 37
Й
Йод 221 - обмен 221
К
Кадаверин 178 Кадмий 230
Казеин 148, 149, 152, 166, 478
Калий 218 - обмен 218
Каллидин 395
Кальций 216 - обмен 216
Кальцитонин (тиреокальцитонин) 368 Каприловая кислота 104 Капроновая кислота 72, 104
Карбамид-амидогидролаза, см. Уреаза Карбанион 312 Карбоангидраза 331, 431, 492 Карбогемоглобин 431 Карбоксилаза 96, 230 Кардиолипины 82 Кариес зубов 231, 449
Карнитин (витамин BE) 289-290, 415
Карнозин 147, 187, 415 Каротины 165, 251, 485
Катаболизм 16
Каталаза 165, 222, 327
Катехолины (симпатины) 408 Кафалины 80, 88 Кверцатин 282 Кератан-сульфат 41
Кератин 151, 164, 494, 501 α-Кетоглутаровая кислота 63, 189, 259, 398, 405
Кетоз 71, 110
Кетонурия 465 Кинины 395
Кислоты желчные 85, 86, 92
-жирные 91, 95, 484
Клетчатка 38 Кобальт 224
Код генетический 131-134
Кодон 130, 133, 184
Кожа 494
-белки 494, 497
-биохимия 494-500
-витамины 496, 498
-выделительная функция 499
-липиды 495, 498
-минеральные вещества 496
-небелковые азотистые вещества 494
-обмен веществ 497-499
-углеводы 495, 497
-химический состав 494
Коллаген 150, 153, 154, 163, 413, 441, 443, 444, 494
Кома диабетическая 71 Кома диабетическая 71
Комплексы железопорфириновые 313
Комплементарность 113
513
Копростерин 77, 248 Кортизон 384 Кортикостероиды 106, 384-387 Кортикостерон 384-387
Кортикотропин (адренокортико-тропный гормон, АКТГ) 70, 283, 358-359 Костная ткань 444-449
-- обмен веществ 447
-- органические вещества 445 Кофакторы 305, 311 Кофермент А, см. Коэнзим А
Коферменты 267, 294, 305-311 Коэнзим A (KoA) 70, 104, 264, 308
Коэффициент альбумино-глобулиновый 162
-дыхательный 107
-креатиновый 463
Крахмал 35-37, 45 Креатин 147, 277, 414, 415, 463 Креатинин 414, 463, 494
Креатинурия 463 Креатинфосфат 403, 414 Крови белки 423-424
-биохимия 420
-буферные системы 421-422
-газы 430
-липиды 93-94, 425
-свертывание 435
-углеводы 425
-химический состав 422 Ксантин 342 Ксантиноксидаза 286 D(+)-Ксилоза 27 D(+)-Ксилулоза 27 D-Ксилулозо-5-фосфат 67
Л
Лактаза 48 Лактальбумин 478
Лактатдегидрогеназа 60, 61, 315, 316, 326 L-Лактат.: НАД-оксиредуктаза 325 Лактоглобулин 478
Лактоза 32, 48, 483 - биосинтез 53 Ланостерин 99
Лантионин 152 Лауриновая кислота 72, 79 Лейкоциты 427
Лейцин 149, 170, 181, 488
Лецитины 310 Лиазы 331
Лигазы (синтетазы) 333 Лигноцериновая кислота 83, 84
Лизин 151, 170, 193, 305
Лизолецитин 88
Лизоцим 160, 305, 489 Ликвор 222, 357, 361, 409
Лимонная кислота 62, 370, 398 Лимфоцитстимулирующий гормон (ЛСГ) 372 Линолевая кислота 73, 255, 390 Линоленовая кислота 73, 255, 390
Липаза 87, 172, 253, 293
Липиды биосинтез 95-98
-всасывание 90
-диольные 72, 76
-классификация 72
-липолиз 102-107
-обмен 84, 94, 95, 109
-- конечный 107
-- патология 108, 109
-- переваривание 84-87
-- промежуточный 92-95
-- регуляция 108
-- физико-химические свойства 71
-плазмы крови 425
-простые 72
-ресинтез 92
-сложные 72
514
Липоевая кислота 307, 313, 327, 342 Липокаин 376 Липолиз 376
Липопротеиды 94, 167, 198, 401
Литохолевая кислота 86 Люлиберин 353
Лютропин (лютеинизирующий гормон, ЛГ) 357-358
M
Магний 217 Макроэргические соединения 348
Макроэлементы 216 Малатдегидрогеназа (МДГ) 64, 256, 340 Малонил-КоА 97 Мальтаза 45, 47, 55 Мальтоза 45, 55
D(+)-Манноза 30, 49, 168, 425
Марганец 226 Масляная кислота 73, 91, 104
Мевалоновая кислота 231 Медиаторы 407-408 Медь 224 Меланин 502
Мелано-релизинг-фактор 353 Меланотропин (меланоцитстимулирующий гормон) 35, 360 Меланоцитингибирующий фактор 353 Мелатонин 364-365 Метилтестостерон 378
S-Метилметионинсульфонийхлорид (витамин U) 290-291
Метионин 148, 170, 181, 192, 414
Микостерины 77 Микроэлементы 221 Минеральные вещества 210
-- всасывание 212
-- обмен 210, 211
-- - конечный 214
-- - патология 215
-- - промежуточный 213
-- регуляция 214
-- характеристика 210 Минимум белковый 130
Миоглобин 160, 165-166, 202, 412
Миофибрилл белки 412
-- актин 412
-- актомиозин 413
-- миозин 412
-- тропомиозин 413 Миристиновая кислота 73, 79, 479 Молибден 227 Молозиво 485 Молока белки 478
-витамины 480
-газы 480
-липиды 479
-минеральные вещества 480
-небелковые азотистые вещества 479
-пигменты 480
-физико-химические свойства 474
- химический состав 474
Молочная кислота 47, 174, 303, 340, 415, 425
Молочный жир 483 Моносахариды 25, 50
-представители 25-30
-таутомерия 27
-физико-химические свойства 25 6-Монофосфоглюкон 65 Моча 460
-безазотистые вещества 463
-осадок 464
-физико-химические свойства 460
-химический состав 461-464
Мочевая кислота 108, 135, 462, 466, 494
515
Мочевина 108, 137, 198, 200, 462, 494
Мочеобразование 458-460 Мукоиды 169 Мукополисахариды 39 Мутации 133 Муцины 169 Мышечная ткань 410
-- белки 412
-- биохимия 410
-- минеральные вещества 415
-- обмен веществ 416 Мышечной стромы белки 413
-- - структурные 413
-- - ферментативные 413 Мышьяк 229 Мяса созревание 473-474
-азотистые экстрактивные вещества 471
-безазотистые экстрактивные вещества 471
-белки 470
-биохимические процессы 472-475
-биохимия 468-472
-витамины 472
-минеральные вещества 472
-углеводы 471
H
НАД-оксиредуктаза 325 НАД гНа-цитохром-с-редуктаза 295 Натрий 219 - обмен 219
Нейрогормоны 393-394 Нейрон 406 Нервная ткань 400
-- белки 405
-- - обмен 405
-- дыхание 404
-- обмен веществ 404
-- - липидов 406
-- - углеводов 404
-- содержание липидов 402
-- - углеводов 402
-- химический состав 400 Нервоновая кислота 83 Никель 229
Никотинамидадениндинуклеотид (НАД) 26, 61, 96, 105, 112, 267, 268, 294, 307, 325, 327
Никотинамидадениндинуклеотид-фосфат (НАДФ) 26, 61, 66, 87, 97, 112, 267, 268, 307, 325, 327
Никотинамидметилтрансфераза 328 Норадреналин 69, 387-389 Норлейцин 149
Нуклеиновые кислоты 111, 117, 118, 120, 121, 134-138, 397
Нуклеиновый обмен 138
-- регуляция 138
Нуклеозидфосфаты 309 Нуклеозиды 119, 135
Нуклеопротеиды 117, 118, 119, 401
Нуклеосомы 117
Нуклеотиды 114, 115, 135, 403
О
Обмен веществ 15
-высших кислот 103
-конечный 69
-промежуточный 51, 92 Овальбумин 488 Овоглобин 488 Овокональбумин 488 Овомукоид 488 Овомуцин 488 Овопорфирин 491 Оксигемоглобин 431 Оксиредуктазы 325-328
516
Оксилизин 151, 440
β-Оксимасляная кислота 425 Оксинервоновая кислота 73
Оксипролин 154, 195, 440
Окситоцин 154, 363 2-Оксоглутарат 308 Олеиновая кислота 73, 88, 91, 479 Олигурия 460 Оперон 131
Орнитин 150, 193, 200, 414
L-Орнитин-карбамоилтрансфераза 328 Орнитуровая кислота 467
Оротовая кислота (витамин B13) 126, 285-286 Основания минорные 113
Π
Пальмитил-КоА 101 Пальмитиновая кислота 72, 78, 104, 474
Пальмитиновый альдегид 101, 286-287 Панкреозимин 393 Пантотеновая кислота 147
Паратгормон (паратин) 369-370, 389 Паротин 371 Пектин 43
Пектиновые вещества 42
Пентозный путь, см. Пентозофосфатный путь
Пентозофосфатный путь (Пф-путь) 55, 65-68 Пентозы 25, 67
Пепсин 166, 172, 173
Пероксидаза 317, 327 Печень 450
-азотистый обмен 451
-биохимия 450
-обезвреживающая функция 454
-обмен веществ 451
-- витаминов 454
-- гормонов 454
-- минеральных веществ 453
-углеводный 452
-химический состав 451 Пиридоксальфосфат 313 Пиридоксаминфосфат 313
Пировиноградная кислота 59-62, 188, 195, 303, 315 Пируватдекарбоксилаза 258, 331 Пируваткиназа 59 Плазмалогены 81 Плазменные факторы 433
Полисахариды 31, 490 Полисома 133, 182 Полиурия 71, 460
Пролактин (лактотропный гормон, мамматропин, лактотропин, ПРЛ) 355356
Проламины 153, 163
Пролин 153, 195
Простагландины 390-392 Простетические группы 305, 311 Протамины 162 Протеиды 161, 164 - нервной ткани 401 Протеиноиды 163 Протеинурия 465
Протеины 161-163, 492
Протеогликаны 39, 442 Протеолипиды 401
Протромбин 169, 434, 436
Пуриновые вещества 415 Путресцин 178
P
Рахит 245 Рацемазы 271 Релаксин 381
Реннин (химозин) 172 Репликация 128 Репрессор 131
D(+)-Рибоза 27, 397
D-Рибозо-5-фосфат 67, 121
517
Рибонуклеиновые кислоты (РНК) 111-117, 138, 160, 401, 494
-- информационные 115, 116
-- рибосомальные 115
-- транспортные 115-116 Рибонуклеопротеиды (РНП) 117, 164, 401, 494 D-Рибулозо-5-фосфат 66, 67
Рицинолевая кислота 73
РНК-аза 117, 153, 154, 296, 304, 305
РНК-полимераза 129-132 Родопсин 244 Рутин 282
С
Саркоплазмы белки 412
-актин 412
-актомиозин 413
-глобулин X 412
-миоальбумин 412
-миоген 412
-миоглобин 412
-миозин 412
-тропомиозин 413 Сахар крови 51 Сахараза 48 Сахарная кислота 29 Сахароза 34, 48 Свинец 231 Связь-водородная 156
-гидрофобная 157
-дисульфидная 155
-ионная 156
-макроэргическая 343, 345
-пептидная 154
D-Седогептулозо-7-фосфат 67 Секретин 393 Селен 227 Сера 230
Серин 81, 82, 147, 181, 189, 191, 304, 310
Серинфосфатиды 81, 88 Серотонин (5-окситриптамин) 394,408 Синтетазы, см. Лигазы
Скатол 179, 201
Скорлупа 486 D(+)-Слизевая кислота 29 Сок желудочный 171
-кишечный 47, 176, 177
-поджелудочной железы 47, 176, 177 Соматостатин 353
Соматотропин (гормон роста, СТГ) 138, 163, 202, 354-355, 443 Стеариновая кислота 73, 83, 105, 106, 479
Стериды 76, 77, 88, 98, 99, 106, 107 Стерины 76, 77, 91, 98, 107, 479, 489
Страндин 107 Стронций 229
Субстрат, или окисляемое вещество 338 Сукцинатдегидрогеназа 64 Сукцинил-КоА 63, 348 Сукцинил-КоА-синтетаза 63 Сульфатиды 84, 108
Сфингозин 83, 84, 106, 107
Сфингозинфосфатиды 83, 100 Сфингомиелины 479 Схема клеточного дыхания 338
- Эмбдена - Мейергофа - Парнаса 56 Сывороточный тимусный фактор 372
T
Таллий 232 Таурохолевая кислота 85
Теория активации водорода 337
518
-перекисная биологического окисления 337
-тканевого дыхания 338-342
-ферментативного анализа 317 Терминатор 131 Тестостерон 384
Тетрагидрофолиевая кислота (ТГФК) 310 Тетрозы 25 Тиаминпирофосфат 312 Тиаминфосфаты 312
Тимин 112, 114
Тимозин 371 Тимопоэтин II 372
Тиреоидные гормоны 365-368 Тирозил-тРНК-синтетаза 333
Тирозин 152, 181, 193, 305
Тироксин 208, 437 Тиролиберин 353
Тиротропин (тиротропный гормон, TTT) 169, 359-360 Титан 233 Транскрипция 129, 132 Трансляция 130, 132 Трансферазы 327-329 Трегалоза 33
Треонин 148, 170, 189, 191
Триглицериды 73, 95, 484 Триозы 25 Трипсин 118, 177 Трипсиноген 228
Триптофан 153, 170, 194, 271, 305
Тромбин 253, 434 Тромбопластин 434, 435
Тромбоцитарные факторы 433-444 Тромбоциты 429
У
Убихинон 256, 308 Углеводы 24
-всасывание 48
-классификация 24-25
-обмен 44
-- анаэробное расщепление 56-65
-- конечный 69
-- патология 70
-- переваривание 44-48
-- промежуточный 51
-- регуляция 69
-плазмы крови 425
-энергетические превращения 55 УДФ-галактоза 49 УДФ-глюкоза 49 УДФ-глюкозо-эпимераза 49, 332
Урацил 112, 137 Уреаза 304, 318
Уридин-5-фосфат 126-127
Ф
Факторы свертывания крови 435 Фенацетуровая кислота 103, 463
Фенилаланин 152, 170, 181, 193
Ферментативная кинетика 320 Ферменты 292
-активаторы 300-302
-- неспецифические 300
-- специфические 300
-активность 303
-- единица измерения 302
-- молекулярная 303
-- удельная 303
-- активный центр 317, 318
-биосинтез 294-296
-взаимосвязь 333
-ингибиторы 300-302
-- неспецифические 300
-- специфические 300
-индуцибельные 334
-каталитическая способность 302
-классификация 324-325
519
-клеточная локализация 294-296
-концентрация 303
-методы выделения и очистки 296-297
-механизм действия 303
-обратимость действия 303
-общие свойства 297
-рН-оптимум 298
-природа 297
-простые 304
-регуляторные 334
-сложные 305
-специфичность действия 299-300
-- - групповая 300
-- индивидуальная 300
-термолабильность 298
-флавиновые 165, 262
-химическая природа 303
-энергия активации 316 Ферритин 222, 452
Фибрин 149, 434
Фибриноген 420, 434 Фиброин 164 Фитостерины 77
Флавинадениндинуклеотид (ФАД) 64, 262, 294, 311, 325, 341 Флавинмононуклеотид (ФМН) 262, 311, 325, 341 Флавиннуклеотиды 311 Фолиевая кислота 291, 310, 472
Фоллитропин (фолликулостимулирующий гормон) 169, 356-357
Фосфатазы 49, 224, 492, 494 Фосфатиды 79, 83, 88, 99, 106, 108, 485, 489
Фосфоглицеринальдегиддегидрогеназа 308 2- и 3-Фосфоглицериновая кислота 40
3-Фосфоглицериновый альдегид 58, 67-69, 397
6-Фосфоглюкановая кислота 66 Фосфолипазы 89 Фосфолипиды 425
Фосфопировиноградная кислота 40 Фосфопротеиды 166, 198, 401 Фосфор 217
-обмен 217
Фосфорилаза 271
Фосфорилирование окислительное 217, 227, 253, 263, 342-344, 346, 348
-- теории 345-346
-субстратное 343
D(-)-Фруктоза 30, 425
Фруктозо-1,6-дифосфат 57, 60 Фруктозо-6-фосфат 57, 68
Фтор 221 Фумаровая кислота 64, 341
X
Хиломикроны 93 Хилус 437
Химотрипсин 160, 177, 305, 359
Хитозамин, см. D-Глюкозамин Хлор 220 - обмен 220
Хлорофилл 276 Холановая кислота 86 Холеная кислота 86 Холестериды 77
Холестерин 77, 85, 99, 107, 231, 255, 291, 378, 385, 479
Холецистокинин 393
Холин 74, 80, 81, 89, 148, 287-289
Холин-ацетилтрансфераза 328, 394 Холинфосфат-цитидилтрансфераза 100 Холинэстераза 87, 226 Холофермент 294
Хондрозамин, см. D(+)-Галактозамин
520
Хондроитинсерная кислота 29, 40, 220, 498 Хондроитинсульфаты 443 Хорионический гонадотропин (хорионгонадотропин) 381 Хром 228 Хромопротеиды 164, 196, 201 Хромосомы 117
Ц
цАМФ 70, 112, 348
Целлобиоза 46 Целлюлаза 46, 330 Целлюлоза 38, 46
Цепь дыхательная 256, 268, 312, 314, 340, 341
Церамид 102
Цереброзиды 83, 84, 107, 479, 489
Цереброновая кислота 73, 83, 84 Цикл Кребса 60-65,
-орнитоновый 198
-трикарбоновых кислот (ЦТК) 55, 60-62, 64, 104, 105, 226, 265, 268, 334, 398, 405, 447
Циклопентанпергидрофенантрен 76, 377
Цинк 223 - обмен 223
Цистеин 148, 155, 179, 181, 192, 304 Цистин 151, 179, 192
Цистиноз 203 Цистинурия 204 Цитидин 112
Цитидиндифосфат-холин 100 Цитидинмонофосфат (ЦМФ) 101 Цитидинтрифосфат (ЦТФ) 100 Цитозин 112, 137 Цитохромоксидаза 165, 314, 341
Цитохромы 196, 222, 253, 314, 326, 341, 346
Цитруллин 151
Ч
Число золотое 142
-йодное 75
-кислотное 75
-омыления 75
-Рейхарда-Мейсля 75
-хромосом 130
-- гаплоидное 130
-- диплоидное 130
Ш
Шерсть 500
-биохимия 500-505
-образование 502
-химический состав 501
Щ
Щавелевая кислота 463-464 Щавелевоуксусная кислота (ЩУК) 61, 64, 188, 340, 341, 398 Щавелевоянтарная кислота 63
Э
Эквивалент восстанавливающий 338 Экстрактивные вещества азотистые 413
-- безазотистые 415
-- мышечной ткани 413
Эластин 154, 164, 177, 413, 442, 443, 494
Энзимы, см. Ферменты Энтерогастрин 173

Эпимеразы 332 Эргостерин 78
521
Эридиктиол 282 Эритрозо-4-фосфат 68 Эритроциты 426 Эстрадиол 138, 464 Эстран 380 Эстриол 380, 464 Эстрогены 106, 380 Эстрон 381 Эффект Кребтри 61 - Пастера 61
Я
Яблочная кислота 64 Янтарная кислота 64, 341, 347 Яйцо 487
-белок 487, 489
-желток 487, 489
-химический состав 488
522
508 :: 509 :: 510 :: 511 :: 512 :: 513 :: 514 :: 515 :: 516 :: 517 :: 518 :: 519 :: 520 :: 521 :: 522 ::
Содержание
