
Учеб. пособие для ОЗО Общая химия
.pdfводы через мембрану в противоположных направлениях. Появляющееся избыточное гидростатическое давление в системе является следствием осмоса, поэтому это давление называют осмотическим.
Осмотическое давление (π) - это избыточное гидростатическое
давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул
растворителя сквозь полупроницаемую мембрану.
Величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит от природы растворённого вещества и растворителя. Для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от внешних факторов выражается уравнением Вант-Гоффа:
π = сRT |
(5.3), |
где π – осмотическое давление, кПа (Дж/л); с – молярная концентрация вещества в растворе, моль/л; R = 8,31 Дж/(моль·К)– универсальная газовая постоянная; T – абсолютная температура раствора, К. Для растворов электролитов в данную формулу вводится поправочный изотонический коэффициент i, учитывающий степень диссоциации электролита на ионы: π = iсRT.
Если осмотическое давление у растворов одинаковое, то они называются изотоническими и при контакте между ними происходит равновесный обмен растворителем. В случае контакта двух растворов с разным осмотическим давлением гипертоническим раствором называется тот, у которого осмотическое давление больше, а гипотоническим – раствор с меньшим осмотическим давлением. При осмосе молекулы растворителя преимущественно движутся через мембрану в том направлении, где концентрация растворённых веществ больше. Другими словами, гипертонический раствор «высасывает» растворитель из гипотонического раствора.
Явления осмоса играют очень важную роль в жизни животных и растительных организмов. Оболочки клеток представляют собой мембраны, легко проницаемые для воды, но почти непроницаемые для веществ, растворённых во внутриклеточной жидкости. Когда вода в результате осмоса проникает внутрь клетки, происходит набухание клетки с появлением напряжённого состояния клетки, называемого тургор. В растительном мире тургор помогает растению сохранять вертикальное положение и определённую форму.
71
Особенностью высших животных и человека является постоянство осмотического давления во многих физиологических системах, и, прежде всего, в системе кровообращения. Осмотическое давление человека составляет 740-780 кПа при 37ºС. Оно обусловлено, главным образом, присутствием в крови ионов неорганических солей и в меньшей степени – наличием коллоидных частиц и белков. Присутствие в плазме крови форменных элементов почти не влияет на осмотическое давление. Постоянство осмотического давления в крови регулируется поступлением воды и солей извне, выделением паров воды при дыхании, работой почек, выделением пота и т.д. Изменение осмотического равновесия в организме может быть вызвано нарушением обмена веществ, секреторными процессами, поступлением пищи, физической нагрузкой.
Осмотическому давлению крови человека соответствует концентрация частиц 0,30 моль/л. В медицинской практике изотоническими (физиологическими) называют растворы, характеризующиеся таким же осмотическим давлением, что и плазма крови. Такими растворами являются 0,9% раствор хлористого натрия и 5% раствор глюкозы. При введении лекарственных растворов в кровь необходимо, чтобы осмотическое давление вводимого раствора соответствовало системам организма. В противном случае, это может привести к «осмотическому конфликту».
Если вводимый раствор гипотоничен по отношению к крови, то вследствие поступления воды внутрь клетки может произойти разрыв клеточной мембраны – лизис клетки. Примером является гемолиз эритроцитов с выделением гемоглобина в плазму крови при внутривенном введении гипотонического раствора.
Если клетка оказывается в гипертонической среде, то вода из клетки будет поступать наружу (в плазму) и происходит обезвоживание и сморщивание клетки, называемое плазмолиз.
Решение типовых задач Задача 1. Вычислите массовую долю соли в растворе, полученном
при сливании 150 г 2%-ного и 350 г 4%-ного растворов.
Решение. 1. Вычисляем массы соли, растворённой в 2%-ном (т1) и 4%-ном (т2) растворах по формуле (5.1):
т1 = mраствора1 · ω1 / 100% = 150 г · 0,02 = 3 г т2 = mраствора2 · ω2 / 100% = 350 г · 0,04 = 14 г
72
2. Вычисляем общую массу соли в растворе, полученном при сливании 2%-ного и 4%-ного растворов:
тсоли = т1 + т2 = 3 г + 14 г = 17 г 3. Вычисляем общую массу полученного раствора:
траствора = 150 г + 350 г = 500 г
4.Вычисляем массовую долю соли в полученном растворе:
ω= (тсоли / траствора) · 100% = (17 г /500 г) · 100 % = 3,4 %
Задача 2. К 150 мл 7 %-ного раствора плотностью 1,1 г/мл добавили 200 мл воды (плотность 1 г/мл). Определите массовую долю вещества в полученном растворе.
Решение. 1. Вычисляем массу 7 %-ного раствора:
траствора1 = ρ · V = 1,1г/мл · 150мл = 165 г
2. Вычисляем массу вещества, растворённого в 7%-ном растворе:
тв = mраствора1 · ω1 / 100% = 165г · 0,07 = 11,55 г
3. Вычисляем массу раствора, полученного после разбавления, считая, что масса добавленной воды равна 200 г (так как плотность воды 1 г/мл):
траствора2 = траствора1 + тводы = 165 г + 200 г = 365 г
4. Вычисляем массовую долю вещества в полученном растворе: ω2 = (тв / траствора2) · 100% = (11,55 г /365г) · 100 % = 3,16 %
Задача 3. Сколько граммов хлорида калия KCl потребуется для приготовления 40 мл раствора с концентрацией 2 моль/л (плотность раствора 1,09 г/мл)? Какова процентная концентрация полученного раствора?
Решение. 1. Определяем количество вещества хлорида калия, необходимое для приготовления данного раствора по формуле (5.2):
п(КCl) = с(КCl) · V = 2 моль/л · 0,04 л = 0,08 моль
2. Вычисляем массу хлорида калия по формуле (1.3), учитывая, что молярная масса КCl М(КCl) = 74,5 г/моль:
m(КCl) = n(КCl) · M(КCl) = 0,08 моль · 74,5г/моль = 5,96 г 3. Вычисляем массу раствора:
траствора = ρ · V = 1,09г/мл · 40мл = 43,6 г
4. Определяем массовую долю КCl в полученном растворе: ω= (тКCl / траствора) · 100% = (5,96 г /43,6 г) · 100 % = 13,6 %
73
Задача 4. Определите объём раствора серной кислоты (массовая доля H2SO4 9,3%, плотность 1,05 г/мл), который потребуется для приготовления 0,35 М раствора H2SO4 объёмом 40 мл.
Решение. 1. Рассчитываем количество вещества H2SO4, которое необходимо для приготовления раствора H2SO4 с концентрацией 0,35 М (с2) объёмом 40 мл (V2), по формуле (5.2):
n(H2SO4) = V2 · с2 = 0,04 л · 0,35 моль/л = 0,014 моль
2. Находим массу требуемой серной кислоты по формуле (1.3), учитывая, что молярная масса H2SO4 М(H2SO4) = 98 г/моль:
т(H2SO4) = n(H2SO4) · М(H2SO4) = 0,014 моль · 98 г/моль = 1,372 г
3. Определяем массу раствора с ω1(H2SO4) = 9,3%, в котором будет содержаться H2SO4 массой 1,372 г, по формуле (5.1):
траствора1 = т(H2SO4) · 100 / ω1(H2SO4) = 1,372 г · 100 / 9,3 = 14,75 г. 4. Вычисляем требуемый объём исходного раствора H2SO4 с
плотностью ρ1 =1,05 г/мл:
V1 = траствора1 / ρ1 = 14,75 г / 1,05 г/мл = 14,05 мл
Задача 5. Вычислите осмотическое давление раствора при 20ºС, содержащего 4,6 г этанола в 200 мл раствора (молярная масса этанола 46 г/моль).
Решение. 1. Вычислим молярную концентрацию раствора этанола по формуле (5.2):
с= п / V = т/(М · V) = 4,6 г / (46 г/моль · 0,2 л) = 0,5 моль/л
2.Вычислим осмотическое давление раствора этанола по формуле (5.3), выразив температуру в кельвинах (20ºС = 293 К):
π= сRT = 0,5 моль/л · 8,31 Дж/(моль·К) · 293 К = 1217 Дж/л (кПа)
Глава 6. Растворы электролитов
6.1.Электролитическая диссоциация
Взависимости от поведения веществ при плавлении и при
растворении различают: неэлектролиты и электролиты. Вещества, растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. Эти вещества распадаются при растворении на нейтральные частицы (молекулы). Для неэлектролитов характерны только неполярные или малополярные ковалентные связи. Неэлектролитами являются, например, сера, а также многие органические соединения: бензол, сахар, глюкоза и др.
74
Электролитами называются вещества, растворы и расплавы
которых содержат подвижные ионы и проводят электрический ток.
Наличие ионов в растворах и расплавах электролитов объясняется процессом электролитической диссоциации.
Электролитическая диссоциация – процесс распада
электролитов на ионы в растворах и расплавах.
Идея о распаде некоторых веществ на ионы была впервые высказана шведским учёным С.Аррениусом. В 1887г. он выдвинул
теорию электролитической диссоциации, основные положения которой сводятся к следующему:
1.Электролиты при растворении в воде диссоциируют на положительно и отрицательно заряженные ионы. Ионы могут быть образованы из одного атома – простые ионы и нескольких атомов – сложные ионы. Справа вверху от формулы иона указывается его заряд.
2.Ионы в водном растворе находятся в хаотическом движении. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду (отрицательному электроду), отрицательно заряженные – к аноду (положительному электроду). Поэтому положительно заряженные ионы называются катионами; к ним относятся, например, ионы
водорода (Н+), аммония (NН4+), |
металлов (Na+, Cu+ и др.). |
Отрицательно заряженные ионы |
называются анионами; к ним |
принадлежат гидроксид-ионы (ОН–) и ионы кислотных остатков (Cl─, SO42─, PO4 3– и др.).
3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях диссоциации вместо знака равенства ставят знак обратимости  .
.
Таким образом, Аррениус рассматривал раствор электролита как механическую смесь из ионов и молекул растворителя. Д.И. Менделеев впервые предложил гидратную теорию, согласно которой молекулы вещества при растворении взаимодействуют с молекулами растворителя, образуя непрочные ассоциаты – сольваты (гидраты) (разд. 5.2.1). Это положение было распространено и на ионы в работах И.А. Каблукова – основоположника современной теории растворов электролитов.
Механизм электролитической диссоциации объясняется строением молекул электролитов и воды. Для электролитов характерно наличие ионной связи (NaOH, KOH, NaCl, Na2SO4) или
75

сильнополярной ковалентной связи (HCl, HNO3, H2SO4). Легче всего диссоциируют вещества с ионной связью, например, хлорид натрия NaCl. В таких веществах катионы и анионы существуют в кристалле ещё до растворения. Полярные молекулы воды электростатически притягиваются положительными концами к отрицательным ионам Cl─ в хлориде натрия, а отрицательными концами – к положительным ионам Na+ (рис. 6.1). В результате такого взаимодействия ионов с диполями воды ослабляется связь между ионами кристалла, и они переходят в раствор в виде гидратированных ионов.
Рис. 6.1. Схема диссоциации хлорида натрия в водном растворе.
Гидратации подвергаются все ионы в водных растворах, в том числе ионы водорода, которые могут образовывать химические связи с одной, двумя и большим числом молекул воды. Гидратированные ионы водорода изображают формулой Н3О+ (точнее - Н3О+· nН2О, где n = 0 - 4) и называют ионом гидроксония.
В случае полярной ковалентной связи, например, в молекуле хлороводорода НCl, под воздействием диполей воды сначала происходит ионизация этой связи - связующая электронная пара полностью смещается к атому с большей электроотрицательностью. Затем эта молекула с ионной связью диссоциирует на гидратированные ионы.
Таким образом, гидратация ионов (связывание с молекулами воды) – основная причина диссоциации. Она отчасти затрудняет и обратное соединение ионов.
Вода, которая участвует в гидратации ионов, называется связанной, она образует вокруг ионов гидратную оболочку. Чем больше гидратная оболочка, тем лучше растворимо вещество в воде.
76
В водной системе живого организма бóльшая часть воды находится в связанном состоянии. Содержание «свободной» воды (не участвующующей в гидратации) в межклеточных жидкостях – небольшое, и она используется как резерв для гидратации вновь поступающих веществ в организм и для удаления продуктов обмена. Внутриклеточная вода, в отличие от межклеточной жидкости, практически не содержит «свободной» воды, а представляет собой «связанную» воду гидратных оболочек компонентов клетки (ионов, молекул, мицелл и органелл).
6.2. Диссоциация кислот, оснований и солей. Диссоциация кислот. С точки зрения теории электролитической
диссоциации кислоты – это электролиты, при диссоциации которых
в водных растворах образуются катионы только одного типа - ионы водорода H+ (точнее, ионы гидроксония Н3О+). Так, диссоциацию
соляной кислоты можно изобразить уравнением:
HCl 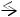 H+ + Cl –
H+ + Cl –
Именно ионы водорода обусловливают важнейшие свойства кислот: кислый вкус, действие на индикаторы, взаимодействие с основаниями и др. Число ионов водорода, которое может образоваться при распаде одной молекулы кислоты, определяет основность кислоты. Так, HCl, HNO3 - одноосновные кислоты, так как образуется один катион водорода; H2S, H2CO3, H2SO4 - двухосновные, а H3PO4 – трёхосновная.
Многоосновные кислоты диссоциируют ступенчато, постепенно отщепляя ионы водорода. Например, диссоциация фосфорной
кислоты протекает в три ступени: |
|
|
|
|
H3PO4 |
H+ + Н2PO4 |
– |
(первая ступень) |
|
H2PO4– |
Н+ + HPO4 |
2– |
(вторая ступень) |
|
HPO42– |
Н+ + PO4 |
3– |
(третья ступень) |
|
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени – по второй и лишь в незначительной степени - по третьей.
Диссоциация оснований. Основания - это электролиты,
которые в водных растворах диссоциируют с образованием анионов только одного типа – гидроксид-ионов ОН─. Например, диссоциацию
гидроксида калия можно изобразить уравнением: КОН 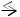 К+ + ОН─
К+ + ОН─
77

С наличием гидроксид-ионов связаны оснóвные свойства: изменение окраски индикатора, взаимодействие с кислотами и др.
Основания, растворимые в воде, называют щелочами. Их немного, это основания щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 и NH4OH. Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (ОН-групп). Например, NaOH – однокислотное основание, Ca(OH)2 – двухкислотное, Fе(OH)3 – трёхкислотное. Многокислотные основания диссоциируют ступенчато, например:
Ca(OH)2 |
Са(ОН)+ + ОН─ (первая ступень) |
Са(ОН)+ |
Са+ + ОН─ (вторая ступень) |
Имеются электролиты, которые при диссоциации одновременно
образуют катионы водорода и гидроксид-ионы – это амфотерные электролиты. Например, вода, гидроксиды цинка, алюминия, хрома
и ряд других веществ. |
Zn2+ + 2OH─ + 2H2O |
[Zn(OH)4]2─ + 2H+ |
Zn(OH)2 + 2H2O |
||
гидроксид цинка |
|
|
Диссоциация солей. Соли – это электролиты, при диссоциации
которых образуются катионы металлов (или катион аммония NН4+) и анионы кислотных остатков. Различают несколько типов солей: средние, кислые и оснóвные. Средние соли диссоциируют практически полностью, например:
NaCl  Na+ + Cl─
Na+ + Cl─
Кислые и оснóвные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Рассмотрим диссоциацию кислой соли на примере гидросульфата калия КНSO4 и диссоциацию оснóвной соли на примере гидроксохлорида магния Mg(OH)Cl:
КНSO4 |
К+ + НSO4─ |
первая ступень |
Mg(OH)Cl |
Mg(OH) + + Cl─ |
НSO4─ |
Н+ + SO42─ |
вторая ступень |
Mg(OH) + |
Mg 2+ + OH ─ |
6.3. Протонная теория кислот и оснований
Теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а свойства оснований – присутствием в их растворах гидроксид-ионов. Однако это объяснение не является общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым
78
теория электролитической диссоциации неприменима. Например, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород реагирует с безводными основаниями.
Изучение подобного рода реакций привело к созданию более общих представлений о кислотах и основаниях. В 1923 г. И. Бренстед
иТ. Лоури предложили протонную (её называют также
протолитической) теорию кислот и оснований.
Согласно этой теории, кислотой является донор протона, т.е. частица (молекула или ион), которая способна отдавать ион водорода Н+ (протон - ядро атома водорода), а основанием – акцептор протона, т.е. частица (молекула или ион), способная присоединять протон. Чем активнее частица отдаёт протон, тем более сильной кислотой она является. В свою очередь, сила основания определяется способностью присоединять протон. Все сильные кислоты и основания в водных растворах являются сильными электролитами (разд. 6.4). Соотношение между кислотой и основанием определяется уравнением:
основание + H+ 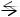 кислота
кислота
Связанные этим соотношением основание и кислота называются
сопряжёнными (сопряжённая кислотно-оснóвная пара). Например, ион HSO4─ является основанием, сопряжённым кислоте H2SO4.
Реакцию между кислотой и основанием протонная теория представляет схемой:
(кислота)1 + (основание)2 |
(кислота)2 + (основание)1 |
||
Например, в реакции HCl + NH3 |
NH4+ |
+ Cl─ |
ион Cl─ – |
основание, сопряжённое кислоте HCl, а ион |
NH4+ - |
кислота, |
|
сопряжённая основанию NH3.
Таким образом, протонная теория является более универсальной теорией кислот и оснований. Эта теория показала, что одно и то же вещество в зависимости от растворителя, а также от природы частиц, с которыми оно взаимодействует, может быть как кислотой, так и основанием.
6.4. Степень диссоциации. Сила электролитов. Константа
диссоциации.
Для количественной характеристики электролитической диссоциации введено понятие степень электролитической
диссоциации (α), которая равна отношению количества
электролита, распавшегося на ионы, к общему количеству
79
растворённого электролита. Значение α в растворах может изменяться в пределах от 0 до 1 (или 0% < α < 100%).
Степень диссоциации зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. При повышении температуры степень диссоциации увеличивается.
В зависимости от степени диссоциации все электролиты подразделяют на сильные, средней силы и слабые.
Сильные электролиты в водных растворах диссоциируют практически полностью. К ним относится большинство солей, многие неорганические кислоты (серная H2SO4, соляная HCl, азотная HNO3 и
др.), основания щелочных и щелочноземельных металлов (щёлочи). Несмотря на практически полную диссоциацию сильных электролитов, значения их степеней диссоциации, определяемые экспериментально, обычно находятся в пределах от 30% и выше. Это связано с процессом ассоциации ионов: ионы противоположных зарядов соединяются друг с другом, образуя ионные пары. Уравнение процесса электролитической диссоциации сильного электролита записывается с указанием его практической необратимости: приводится лишь одна стрелка →, направленная от молекулярной
формы электролита к его ионам: |
|
|
HCl → H+ + Cl─ |
NaОН → Na+ + ОН─ |
NaCl → Na+ + Cl─ |
Электролиты средней силы диссоциируют частично (3% < α < 30%). К ним относятся, например, фосфорная H3PO4, щавелевая, лимонная кислоты, а также слабые электролиты в сильно разбавленных растворах или сильные электролиты в концентрированных растворах.
Слабые электролиты (α < 3%) диссоциируют на ионы в очень малой степени. К ним относятся почти все органические кислоты, некоторые неорганические кислоты (угольная H2СO3, сероводородная H2S, кремниевая H2SiO3, азотистая HNO2 и др.), многие основания металлов (цинка, алюминия, хрома и др.), аммиак NН3, перекись водорода H2O2, вода.
Электролитическая диссоциация электролитов средней силы и слабых записывается с указанием её обратимости: используются две, противоположно направленные стрелки  . Запишем уравнение диссоциации электролита АВ, который при взаимодействии с n моль
. Запишем уравнение диссоциации электролита АВ, который при взаимодействии с n моль
воды диссоциирует с образованием гидратированных ионов А+ и В─: АВ + nН2О  А+· mН2О + В─ · (n – m)Н2О
А+· mН2О + В─ · (n – m)Н2О
80
