
Учеб. пособие для ОЗО Общая химия
.pdf
спаренными и обозначают ↑↓. Одиночный электрон на орбитали называется неспаренным. Свободная ячейка означает свободную орбиталь, которую может занимать электрон при возбуждении. В качестве примера запишем графическую электронную формулу атома азота:
sp
7N 1s22s22p3 п=2 ↑↓ ↑ ↑ ↑
п=1 ↑↓
Третий период так же, как и второй, содержит 8 элементов. В атомах элементов третьего периода формируется третий электронный слой, на котором может находиться до 18 электронов. Вначале заполняется 3s-подуровень, потом 3p-подуровень. Заполнение 3d- подуровня происходит только у элементов четвёртого периода, так как после достижения устойчивой конфигурации пs2пp6 всегда происходит заполнение электронами следующего энергетического уровня (п + 1) (разд. 2.3.1).
11Na 1s22s22p63s1
········································
13Al 1s22s22p63s23p1
········································
18Ar 1s22s22p63s23p6
Ватоме аргона внешний энергетический уровень является завершённым.
Вчетвёртом периоде 18 элементов. У первых двух элементов четвёртого периода начинает заполняться 4s-подуровень, энергия которого ниже энергии 3d-подуровня:
19К |
1s22s22p63s23p63s1 |
20Са 1s22s22p63s23p63s2 |
С элемента скандия начинается заполнение 3d-подуровня, так как его энергия ниже, чем у 4p-подуровня. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка. Поэтому электронное строение 21Sc
соответствует формуле 1s22s22p63s23p63d14s2, а 30Zn - 1s22s22p63s23p63d104s2. В атомах последующих элементов вплоть до
криптона продолжается заполнение 4p-подуровня:
31Ga 1s22s22p63s23p63d104s24p1
························································
36Kr 1s22s22p63s23p63d104s24p6
21
Заполнение энергетических уровней и подуровней атомов элементов 5-го периода, включающего 18 элементов, происходит аналогично заполнению атомов элементов 4-го периода. У десяти элементов от иттрия до кадмия заполняется электронами 4d-
подуровень:
39Y 1s22s22p63s23p63d104s24p64d15s2
·································································
48Cd 1s22s22p63s23p63d104s24p64d105s2 Далее электроны занимают 5p-подуровень:
49Yn 1s22s22p63s23p63d104s24p64d105s25p1
В 6-м периоде содержится 32 элемента, так как кроме 6s-, 6p- и 5d- подуровней происходит заполнение электронами и семи орбиталей 4f-подуровня. Это происходит у атомов элементов лантаноидов (58Ce
– 71Lu). Заполнение электронами энергетических уровней элементов 7-го, незавершённого, периода происходит аналогично 6-му периоду.
У атомов некоторых элементо наблюдается явление «проскока» электрона с внешнего энергетического уровня на предпоследний. «Проскок» электрона происходит у атомов хрома, меди, палладия и некоторых других элементов, например:
24Cr 1s22s22p63s23p63d54s1 29Cu 1s22s22p63s23p63d104s1
46Pd 1s22s22p63s23p63d104s24p64d105s0
2.3.3. Связь электронного строения атома с положением
элемента в периодической системе
Согласно современным представлениям, химические свойства элемента определяются не атомной массой (она может различаться у изотопов одного и того же элемента), а, прежде всего, электронной конфигурацией внешних энергетических уровней атома, зависящей от заряда ядра. Поэтому периодический закон сегодня можно сформулировать следующим образом:
Свойства элементов и их однотипных соединений находятся в
периодической зависимости от заряда атомных ядер элементов.
Структура периодической системы Менделеева связана с периодическим изменением электронной конфигурации атомов элементов, а место элемента в таблице содержит информацию о составе ядра и строении электронной оболочки его атома. Зная местоположение элемента в периодической таблице, можно
22
предсказать химические свойства этого элемента. Для этого необходимо знать следующие закономерности:
1.Порядковый номер элемента определяет число протонов в ядре
иобщее число электронов в атоме.
2.Номер периода указывает на число энергетических уровней в атоме.
3.У элементов главных подгрупп номер группы указывает на число электронов на внешнем энергетическом уровне. У элементов главных подгрупп электроны внешнего энергетического уровня являются валентными, т.е. они участвуют в химическом взаимодействии. У элементов побочных подгрупп III-VII групп, а также у Fe, Ru, Os VIII группы происходит заполнение d-подуровня предыдущего уровня, и общее число электронов на s-подуровне внешнего уровня и d-подуровне предыдущего уровня равно номеру группы. У элементов побочных подгрупп валентными могут быть электроны внешнего энергетического уровня и d-подуровня
предыдущего уровня. У элементов побочных подгрупп I и II групп d- подуровень предпоследнего энергетического уровня завершён (d10), а на внешнем энергетическом уровне число электронов равно номеру группы.
2.4. Периодичность свойств элементов
Такие свойства атомов, как их размер, энергия ионизации, электроотрицательность связаны с электронной конфигурацией атома. С увеличением порядкового номера элемента наблюдается периодичность в изменении перечисленных свойств атомов, что объясняется периодичностью электронных структур атомов элементов.
1. Атомный радиус характеризует размеры атома. Размер атома не может быть точно определён, поскольку электронные орбитали атомов не имеют строго ограниченных контуров. Поэтому в расчётах пользуются эффективными радиусами атомов, то есть размерами данных частиц в кристаллах и молекулах. В периодах с возрастанием заряда ядра атомные радиусы уменьшаются вследствие увеличения числа электронов на внешнем энергетическом уровне и возрастания сил взаимодействия электронов с ядром. В группах атомные радиусы элементов возрастают, как правило, сверху вниз, так как увеличивается число электронных слоёв в атомах элементов.
23
2.Энергия ионизации – это энергия, необходимая для отрыва наиблее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах (эВ). Энергия ионизации характеризует металлические свойства элементов. Металлические свойства элементов обусловлены способностью легко отдавать электроны при химическом взаимодействии. Такие свойства металлов как хорошая электро- и теплопроводность также объясняются подвижностью свободных электронов в кристаллических решётках металлов.
Чем меньше энергия ионизации, тем более типичные металлические свойства проявляет элемент. В главных подгруппах сверху вниз происходит уменьшение энергии ионизации и усиление металлических свойств, что связано с увеличением размера атома и дополнительным экранированием внутренними электронами заряда ядра от внешних электронов. В периодах с возрастанием заряда ядра, т.е. слева направо, энергия ионизации возрастает (соответственно ослабевают металлические и усиливаются неметаллические свойства), что связано с увеличением заряда ядер и уменьшением радиусов атомов в пределах периода. Из всех элементов таблицы Менделеева металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические – у фтора, затем – у кислорода.
3.Относительная электроотрицательность (ОЭО) характеризует способность атома элемента притягивать к себе общие электроны в молекуле. В отличие от энергии ионизации данная характеристика применима не к изолированным атомам, а к атомам, находящимся в соединении, то есть, в молекуле. У благородных газов электроотрицательность отсутствует, так как внешний энергетический уровень в их атомах завершён и устойчив.
За единицу ОЭО принята электроотрицательность атома лития, у фтора этот показатель равен 4. Относительно этих величин рассматриваются электроотрицательности других элементов (приложение 2). В пределах периодов ОЭО элементов увеличивается,
вподгруппах – уменьшается с ростом порядкового номера элемента. Таким образом, чем более типичным металлом является элемент, тем ниже его электроотрицательность. Наибольшее значение ОЭО имеет фтор, наименьшие - характерны для щелочных металлов.
24
Решение типовых задач Задача 1. Определите число протонов и нейтронов в ядре атома
калия (изотоп 39К).
Решение. 1. Калий в периодической системе Д.И. Менделеева имеет порядковый номер 19. Число протонов численно равно заряду ядра (т.е. порядковому номеру элемента), следовательно, число протонов в ядре равно 19: Z(К) = 19.
2. Число нейтронов в ядре равняется разности между массовым числом (атомной массой) и числом протонов. Массовое число атома калия А(К) равно 39. Используя формулу (2.1), вычисляем число нейтронов в ядре атома калия 39К: N(К) = А(К) - Z(К) = 39 – 9 = 20.
Задача 2. Составьте электронную формулу элемента с порядковым номером 16. Покажите распределение электронов по квантовым ячейкам (орбиталям).
Решение. 1. В периодической системе элементов порядковый номер 16 имеет сера S. По порядковому номеру заключаем: электронная оболочка атома серы содержит 16 электронов.
2.Распределяем 16 электронов атома серы по энергетическим уровням и подуровням в соответствии с принципом минимума энергии и принципом Паули (разд. 2.3.1). Порядок заполнения электронами энергетических уровней и подуровней согласно шкале энергии следующий: 1s - 2s - 2p - 3s - 3p - ...
Заполняем подуровни максимально возможным для них числом
электронов (на s – 2, на p – 6 электронов): 1s22s22p63s23p4 (2+2+6+2+4) = 16.
3.Чтобы показать распределение электронов по орбиталям, составляем графическую электронную формулу. При заполнении орбиталей электронами воспользуемся правилом Хунда (разд. 2.3.1.), согласно которому вначале происходит последовательное заполнение всех орбиталей данного подуровня по одному электрону. Причём спины всех этих электронов одинаковы. Только после этого будет происходить окончательное заполнение орбитали двумя электронами.
|
s |
|
p |
|
|
n=3 |
↑↓ |
↑↓ |
↑ |
↑ |
|
16S |
|
|
|
|
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
||
n=2 |
|||||
n=1 |
↑↓ |
|
|
|
|
|
|
|
|
|
25
Задача 3. Напишите электронную формулу элемента, атом которого содержит на 3d-подуровне один электрон.
Решение. В соответствии со шкалой энергии (разд. 2.3.1) 3d- подуровень заполняется после заполнения 4s. Распределяем электроны по энергетическим уровням и подуровням, учитывая
максимальное число электронов на них (на s – 2, на p – 6 электронов): 1s22s22p63s23p63d14s2, или 1s22s22p63s23p64s23d1
Общее число электронов в атоме, которое определяет порядковый номер элемента в периодической системе, - 21. Это – скандий. Из электронной формулы видно, что этот элемент находится в IV периоде, третьей группе.
Задача 4. Напишите электронные формулы ионов Fe3+ и F─. Решение. Если атом отдаёт или принимает электроны, он
превращается в ион. Например, переход железа в состояние Fe3+ связан с отдачей трёх электронов. В первую очередь атом отдаёт электроны с более высокого энергетического уровня и подуровня. Следовательно, электронные формулы атома железа и его иона
можно записать так:
26Fe 1s22s22p63s23p63d64s2 Fe3+ 1s22s22p63s23p63d5
Фтор может легко присоединить один электрон, превращаясь при этом в ион F─. Электронная формула иона фтора F─: 1s22s22p6. Эта формула аналогична электронной структуре атома неона.
Задача 5. Как изменяется величина энергии ионизации в ряду Na, K, Rb, Cs? Какой из элементов – натрий или цезий – обладает более выраженными металлическими свойствами?
Решение. 1. Элементы, представленные в данном ряду (Na, K, Rb, Cs), расположены в главной подгруппе первой группы. Энергия ионизации атомов элементов внутри одной подгруппы уменьшается при возрастании порядкового номера элемента, так как увеличивается атомный радиус (разд. 2.4). Следовательно, в ряду Na, K, Rb, Cs энергия ионизации уменьшается.
2. У атомов данных элементов на внешнем энергетическом уровне находится по одному электрону: пs1. Однако у атома цезия внешний электрон расположен дальше от ядра (на шестом энергетическом уровне, а у натрия – на третьем), и, следовательно, легче отрывается. Поскольку металлические свойства обусловлены способностью отдавать электроны, они сильнее выражены у цезия.
26
Глава 3. Химическая связь
В природе элементы в виде изолированных атомов практически не встречаются. Обычно атомы элемента взаимодействуют либо друг с другом, либо с атомами других элементов, образуя химические связи с возникновением молекул (внутримолекулярные связи). Химические связи также могут возникать и между молекулами, приводя к образованию ассоциатов из молекул – это межмолекулярные связи.
Возникновение химических связей – процесс самопроизвольный, приводящий к уменьшению энергии системы. Следовательно, образование химической связи всегда сопровождается выделением энергии, а разрыв химической связи всегда требует затраты энергии.
Прочность химической связи характеризуется величиной энергии
связи (Есв), т.е. количеством энергии, которое необходимо для разрыва связи. Есв измеряется в килоджоулях, отнесённых к 1 моль вещества (кДж/моль). Внутримолекулярные и межмолекулярные связи резко отличаются по величине энергии: для внутримолекулярных связей энергия составляет 100-1000 кДж/моль, а энергия межмолекулярных связей обычно не превышает 40 кДж/моль.
К общим характеристикам химических связей относится также длина связи. Длина связи – это расстояние между ядерами соединяемых атомов. Химическая связь тем прочнее, чем меньше её длина.
Сущность природы химической связи была объяснена лишь после открытия строения атома. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может вместить (ns2np6), то такой уровень называется завершённым. Завершённые уровни характеризуются большой прочностью. Таковы внешние электронные уровни атомов благородных газов, поэтому благородные газы в природе находятся в атомарном состоянии. Внешние уровни атомов других элементов незавершённые и в процессе химического взаимодействия они завершаются.
В зависимости от природы взаимодействующих элементов это достигается тремя путями: отдачей, или присоединением, или обобществлением электронов атомов этих элементов при образовании между ними химической связи.
Природа химической связи едина и носит электростатический характер, однако в зависимости от способа образования различают три вида химической связи: ковалентную, ионную и металлическую.
27
3.1. Ковалентная связь
Химическая связь, осуществляемая за счёт одной или нескольких
электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью. Ковалентная связь образуется между атомами элементов, электроотрицательности которых одинаковы или различаются не слишком сильно, например:
H2, F2, HF, CH4, CO2, H2S, SO2.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода. Ядро атома водорода окружено сферически симметричным электронным облаком, образованным 1s-электроном. При сближении атомов водорода между их электронами с противоположными спинами происходит сильное обменное взаимодействие, приводящее к появлению общей (поделённой) электронной пары (рис. 3.1, а). При этом увеличивается электронная плотность в межъядерном пространстве, что способствует возрастанию сил притяжения между ядрами и электронным облаком. Благодаря появлению общей электронной пары каждый из атомов водорода достигает электронной конфигурации атома благородного газа гелия.
|
1s1 |
|
1s1 |
1s2 |
||
Н |
↑ |
+ |
↓ |
Н → Н |
↑↓ |
Н (Н2) |
Объяснение механизма образования химической связи за счёт притяжения ядер двух атомов к одной или нескольким общим для них электронным парам лежит в основе метода валентных связей.
Схему образования ковалентной связи можно также показать, обозначив неспаренный электрон внешнего энергетического уровня атома одной точкой, а общую электронную пару - двумя точками.
Н· + ·Н → Н:Н Общую электронную пару или ковалентную связь, часто
обозначают чёрточкой, например, Н─Н.
3.1.1. Сигма- и пи-связи
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Перекрывание орбиталей может осуществляться σ- и π-способом.
Связь, образованная за счёт перекрывания электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется σ-связью. Сигма-связь образуется при слиянии двух s-
28
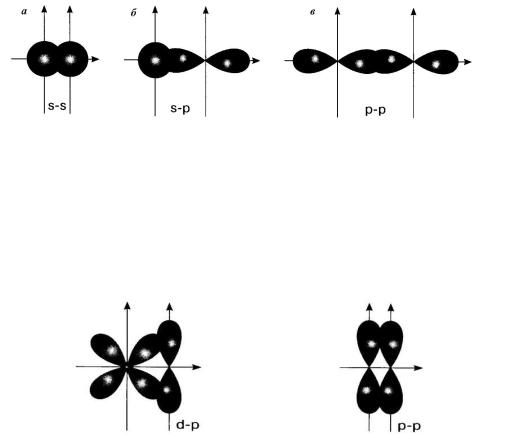
атомных орбиталей (молекула H2), s-орбитали и р-орбитали (молекула НF) или двух р-орбиталей, которые пересекаются по оси симметрии (молекула F2) (рис. 3.1.).
Атом фтора имеет семь электронов на внешнем энергетическом уровне, причём на 2р-подуровне находится один неспаренный электрон. При образовании молекулы НF происходит перекрывание s-орбитали атома водорода и р-орбитали атома фтора (рис. 3.1, б).
Схему образования связи Н ─ F можно представить так: |
|
. . |
. . |
Н · + · .F.: → Н : .F.:
При сближении двух атомов фтора происходит перекрывание 2р- орбиталей с неспаренными электронами (рис. 3.1, в), в результате
формируется общая электронная пара: |
|
||
. . |
. . |
. . . . |
|
: F · + · F : → : F : F : |
или F ─ F |
||
. . |
. . |
. . . . |
|
У каждого атома фтора в молекуле F2 сохраняются три неподелённые (т.е. принадлежащие одному атому) электронные пары.
Рис. 3.1. Схема образования σ-связи в молекулах водорода Н2 (а); фтороводорода НF (б); фтора F2 (в).
После образования между двумя атомами σ-связи для остальных электронных орбиталей остаётся только возможность бокового перекрывания вне линии, соединяющей центры взаимодействующих атомов. Такой тип связи называется π-связью. Пи-связь образуется при слиянии d- и р-орбитали или двух р-орбиталей (рис. 3.2).
Рис. 3.2. Схема образования π-связей.
Общая электронная пара, образующая π-связь, из-за большого удаления от ядер соединяемых атомов слабее взаимодействует с ними, чем в случае σ-связи. Поэтому в соединениях реакционная способность π-связи всегда больше, чем σ-связи.
29

3.1.2.Механизмы возникновения ковалентной связи
1.Обменный механизм. При обменном механизме в образовании общей электронной пары от каждого атома участвуют и атомная орбиталь, и неспаренный электрон, находящийся на этой орбитали. Таким образом, связь образуется за счёт перекрывания одноэлектронных облаков. По обменному механизму ковалентная связь возникает, например, в молекулах H2, F 2, НF.
2.Донороно-акцепторный механизм. Донорно-акцепторный механизм возникновения ковалентной связи наблюдается в тех случаях, когда один атом имеет на атомной орбитали внешнего уровня неподелённую электронную пару, а другой атом – свободную орбиталь. В этом случае химическая связь возникает за счёт объединения двухэлектронного облака одного атома и свободной орбитали другого атома. Атом, предоставляющий неподелённую электронную пару, называется донором, а атом, принимающий её (т.е. предоставляющий свободную орбиталь), называется акцептором.
Примером донорно-акцепторного взаимодействия является реакция между ионом водорода H+(имеет свободную 1s-орбиталь) и
молекулой аммиака (имеет неподелённую пару электронов у атома азота). При образовании иона аммония NH4+ двухэлектронное облако азота становится общим для атомов азота и водорода:
Н |
Н |
+ |
. . |
. . |
|
Н : N : + Н+ → Н : N : Н |
|
|
. . |
. . |
|
Н |
Н |
|
Связь, образованную по донорно-акцепторному механизму, часто называют донорно-акцепторной или координационной связью. Однако, это не особый вид связи, а лишь иной механизм образования ковалентной связи. Так, образовавшаяся четвёртая ковалентная связь N-H в ионе NH4+ по своей энергии и длине ничем не отличается от остальных трёх N-H связей.
3.1.3. Свойства ковалентной связи.
Кроме характеристик, общих для любой химической связи (энергия и длина связи), ковалентная связь имеет дополнительные свойства – кратность, насыщаемость, направленность, полярность.
1. Кратность – число электронных пар, участвующих в образовании связи. При наличии одной общей электронной пары между соединяемыми атомами говорят о простой (одинарной)
30
