
Учеб. пособие для ОЗО Общая химия
.pdf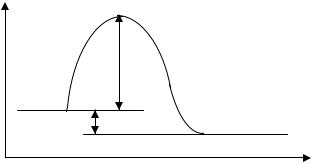
где γ – температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10°С; v2, v1 – скорости реакции при температуре T2 и T1 соответственно.
Правило Вант-Гоффа является приближённым и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Влияние температуры на скорость реакции объясняет
теория активации (теория активных столкновений). Согласно этой теории, не каждое столкновение частиц приводит к химическому взаимодействию. В химическое взаимодействие вступают только активные частицы, обладающие энергией, достаточной для осуществления данной реакции (энергией активации). При этом в момент соударения они должны быть определённым образом
сориентированы относительно друг друга. |
|
|
|||
Энергия |
активации |
– |
это |
минимальная |
энергия |
взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию. Её определяют опытным путём, обозначают Еа и обычно выражают в кДж/моль.
Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ (рис. 4.1). В обычных условиях лишь небольшая доля молекул обладает необходимой кинетической энергией для преодоления энергетического барьера.
А + В → D + F |
|
|
Энергия |
[А···В] |
|
|
|
|
|
Еа |
|
А + В |
|
|
Нисх. |
∆Нр |
D + F |
|
|
Нкон. |
|
Течение реакции |
|
Рис. 4.1. Энергетический профиль течения реакции. А, В – исходные вещества; [А···В] – переходный активированный комплекс; D, F – продукты реакции; Нисх - энергия исходного состояния; Нкон - энергия конечного состояния; ∆Нр - тепловой эффект реакции; Еа - энергия активации реакции.
51
Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или ослабления связей между атомами в молекулах исходных веществ (А и В). При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние
называется переходным активированным комплексом ([А···В]). Именно для его образования и необходима энергия активации. Неустойчивый активированный комплекс существует очень короткое время. Он распадается с образованием продуктов реакции D и F.
Энергия активации зависит от природы реагирующих веществ и служит энергетической характеристикой каждой реакции. Если энергия активации мала (< 50 кДж/моль), то значительная часть столкновений между частицами реагирующих веществ приводит к реакции. Такие реакции при комнатной температуре идут с высокой скоростью. Это характерно для реакций с участием радикалов и ионов (радикалы – частицы, имеющие неспаренный электрон, обозначаемый точкой; они возникают под действием нагревания, света, радиоактивного излучения). Например, практически мгновенно протекают следующие реакции:
H· +Cl· = HCl |
H+ +Cl─ = HCl |
Если энергия активации велика (Еа > 100кДж/моль), то скорость реакции при 25°С неизмеримо мала. Это обычно наблюдается в том случае, когда реагирующими частицами являются молекулы, например:
H2 +Cl2 = 2HCl
Взаимосвязь энергии активации с константой скорости реакции выражается уравнением Аррениуса:
_ Еа |
|
k = А · e RT |
(4.6), |
где k – константа скорости реакции при температуре Т; А – коэффициент Аррениуса, учитывающий частоту столкновения частиц, ориентированных определённым образом; e – основание натурального логарифма; Еа – энергия активации реакции; R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции.
52

4.3.3. Катализ
Увеличить скорость реакции можно с помощью катализаторов – веществ, не расходующихся в результате протекания реакции, но влияющих на её скорость. Явление изменения скорости реакции под действием таких веществ называется катализом, а реакции с участием катализаторов - каталитическими.
Влияние катализатора на скорость химической реакции в основном заключается в его участии в этой реакции и изменении её механизма. Катализатор (Кат) образует с реагентами промежуточные активированные комплексы, которые в дальнейшем превращаются в продукты реакции и свободный катализатор:
|
Еа |
|
А + В → D |
Еа' |
Еа'' |
А + Кат → [АКат] |
В + [АКат] → D |
Таким образом, в присутствии катализатора изменяется механизм реакции, и она направляется по пути с меньшими значениями энергии активации каждой стадии (Еа' < Еа; Еа'' < Еа), что и приводит к возрастанию скорости реакции (рис. 4.2). Кроме того, катализатор может способствовать определённой ориентации молекул в пространстве, удобной для данного химического взаимодействия.
Энергия |
[А···В] |
|
[А···Кат] |
||
|
||
Еа |
[АКат···В] |
|
|
||
Еа' |
Еа'' |
|
А + В |
||
|
||
А + В + Кат |
D |
D + Кат
Течение реакции
Рис. 4.2. Энергетический профиль течения реакции без катализатора и с катализатором. А, В – исходные вещества; D – продукт реакции; Кат – катализатор; [А···В] – переходный активированный комплекс без катализатора; [А···Кат], [АКат···В] – промежуточные активированные комплексы с участием катализатора; Еа - энергия активации реакции без катализатора; Еа', Еа'' - энергии активации отдельных стадий реакции с участием катализатора.
На скорость реакции в ряде случаев также влияет присутствие в системе ингибитора – вещества, уменьшающего скорость реакции.
53
Механизм действия ингибиторов не связан с повышением энергии активации. Ингибиторы обычно препятствуют обычному течению реакции, вступая во взаимодействие с каким-либо промежуточным веществом, тем самым, удаляя его из реакционной смеси.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую. При гетерогенном катализе катализатор находится в системе в виде самостоятельной фазы (катализатор обычно - твёрдое вещество, а реагирующие вещества – газы или жидкости).
Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора, хотя его количество в системе невелико.
При гетерогенном катализе скорость реакции сильно зависит от площади и состояния поверхности катализатора, так как реакция происходит не на всей поверхности, а только на её активных центрах.
Особую роль играют биологические катализаторы – ферменты. При их участии протекают сложные химические процессы в растительных и животных организмах.
4.4. Химическое равновесие
Химические реакции бывают необратимые и обратимые.
Необратимыми называются реакции, которые протекают только в одном направлении до полного израсходования одного из
реагирующих веществ.
Однако в природе необратимых реакций меньше, чем обратимых.
Обратимыми называются реакции, которые одновременно
протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
3H2 + N2  2NH3
2NH3
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия.
Химическое равновесие - это такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой.
54

В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. И поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ – как исходных, так и образующихся - остаются строго постоянными.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключёнными в квадратные скобки, например [Н2], [N2], [NH3], тогда как неравновесные концентрации обозначают так: c(Н2), c(N2), c(NH3).
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Она
равна отношению константы скорости прямой реакции к
константе скорости обратной реакции: |
|
|
Кравн = k1 / k2 |
|
(4.7) |
Выведем, чему равна Кравн процесса aA + bB |
dD + fF. |
|
v1 = k1[A]a · [B]b |
|
|
v2 = k2[D]d · [F]f |
|
|
В состоянии химического равновесия v1 = v2, поэтому |
|
|
k1[A]a · [B]b = k2[D]d · [F]f |
|
|
Кравн = k1 / k2 = [D]d · [F]f / ([A]a · [B]b) |
(4.8) |
|
Константа химического равновесия обратимой реакции равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведённых в степени, равные коэффициентам при
формулах соответствующих веществ в уравнении химической реакции. Так формулируется закон действия масс для обратимых
процессов.
Константа химического равновесия, как и константа скорости реакции, зависит от природы реагирующих веществ и температуры, но не зависит от концентраций реагирующих веществ и давления в системе.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечёт за собой изменение концентрации всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
55
4.5. Смещение химического равновесия
Состояние химического равновесия в неизменных условиях может сохраняться сколь угодно долго. Если же условия изменяются, равновесие нарушается, так как при этом в разной степени изменяются скорости противоположных реакций. Концентрации всех реагирующих веществ будут изменяться до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому, называется смещением (сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Влияние изменения условий на химическое равновесия определяется принципом подвижного равновесия или принципом
Ле-Шателье:
Если на систему, находящуюся в равновесии, производится какоелибо внешнее воздействие (изменяется концентрация, температура, давление), то равновесие смещается в направлении той реакции,
протекание которой ослабляет это воздействие.
Влияние концентрации реагентов. Увеличение концентрации исходных веществ вызывает смещение равновесия в сторону образования конечных продуктов. В то же время увеличение концентрации конечных продуктов вызывает смещение равновесия в сторону исходных веществ. Это вытекает из выражения для константы равновесия.
Влияние температуры. Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции (∆Н>0), а понижение температуры – в сторону экзотермической реакции (∆Н<0). Изменение температуры изменяет константы скоростей прямой и обратной реакций, причём в разной степени.
Влияние давления. Давление в системе изменяет концентрацию только газообразных веществ, что вызывает смещение равновесия. Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул газообразных веществ в левой и правой частях уравнения. Повышение давления смещает химическое равновесие в направлении реакции, идущей с образованием меньшего числа молекул газообразного вещества, т.е. в
56
сторону уменьшения объёма. Очевидно, уменьшение давления в системе вызывает сдвиг равновесия в противоположную сторону.
Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например, N2 + O2 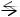 2 NO, то изменение давления не вызовет сдвига химического равновесия.
2 NO, то изменение давления не вызовет сдвига химического равновесия.
Влияние катализаторов. Все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывают, а только способствуют более быстрому его достижению.
Решение типовых задач Задача 1. При сгорании магния массой 3 г в кислороде
выделилась теплота в количестве 75 кДж. Составьте термохимическое уравнение реакции.
Решение. Термохимическими называются уравнения, в которых указывается тепловой эффект процесса (стандартная энтальпия реакции ∆Нº).
1.Рассчитываем количество вещества, содержащегося в 3 г магния по формуле (1.3), учитывая, что молярная масса магния М(Mg) = 24 г/моль:
n(Mg) = m(Mg)/M(Mg) = 3г /24г/моль = 0,125 моль Таким образом, при сгорании 0,125 моль магния выделяется 75 кДж.
2.Составляем уравнение реакции горения магния в кислороде:
2Mg + O2 = 2MgO
Согласно уравнению, в реакции участвуют 2 моля магния. Тепловой эффект процесса относят к тому числу молей реагентов, которое определено уравнением реакции. Вычисляем количество теплоты, которая выделилась бы при сгорании 2 моль магния. Составляем пропорцию:
0,125 моль Mg – 75кДж
2 моль Mg – х кДж Решаем пропорцию: х = 75 · 2 / 0,125 = 1200 (кДж).
3. Записываем термохимическое уравнение реакции, учитывая, что знак теплового эффекта считается отрицательным, если теплота выделяется:
2Mg (т) + O2 (г) = 2MgO (т); ∆Нº= -1200кДж
57
Задача 2. Какое количество теплоты выделится при сгорании в кислороде 12 г водорода? Термохимическое уравнение горения водорода:
2Н2 (г) + О2 (г) = 2Н2О (г); ∆Нº= - 483,6 кДж Решение. 1. Данное термохимическое уравнение означает, что при
взаимодействии 2 моль водорода Н2 с 1 моль кислорода О2 образуется 2 моль паров воды и выделяется 483,6 кДж теплоты. Вычисляем количество вещества, содержащегося в 12 г водорода по формуле (1.3), учитывая, что молярная масса водорода М(Н2) = 2 г/моль:
п(Н2) = т(Н2)/М(Н2) = 12/2 = 6 (моль)
2. Вычисляем количество теплоты, которая выделилась бы при сгорании 6 моль водорода. Составляем пропорцию:
2 моль Н2 – 483,6 кДж
6 моль Н2 – х кДж Решаем пропорцию: х = 483,6 · 6 / 2 = 1450,8 (кДж)
При сгорании в кислороде 12г водорода выделится 1450,8 кДж.
Задача 3. Реакционный сосуд вместимостью 10 л содержит 0,5 моль оксида серы SO2 и кислород. Через 8 с количество вещества SO2 стало равным 0,46 моль. Определите среднюю скорость реакции.
Решение. Средняя скорость реакции рассчитывается по формуле
(4.2.): |
|∆С| |
|∆п| |
|п2 – п1| |
|
v = ── |
= ── |
= ──── |
|
∆t |
V∆t |
V( t2 – t1) |
Промежуток времени, для которого определяется средняя
скорость: ∆t = t2 – t1 = 8 – 0 = 8 (сек).
Изменение количества вещества SO2 за данный промежуток времени: |∆п| = |п2 – п1| = |0,46 – 0,5| = 0,04 (моль).
Объём системы V = 10 л.
Подставляем в формулу имеющиеся данные и вычисляем среднюю скорость: v = 0,04/(10 · 8) = 0,0005 моль/(л·сек).
Задача 4. Как изменится скорость реакции 2СО + О2 = 2СО2 при увеличении концентрации СО в 2 раза?
Решение. 1. В соответствии с основным законом химической кинетики (разд. 4.3.1) записываем выражения для скорости реакции при исходной концентрации угарного газа (v1) и скорости реакции (v2), когда концентрация СО увеличилась:
v1 =k · CСО2 · CО2 v2 = k · (2 · CСО)2 · CО2
2. Определяем, во сколько раз увеличилась скорость реакции:
58
v2 |
k ·(2·CСО)2· CО2 |
─ = ───────── = 22 = 4 |
|
v1 |
k · CСО2· CО2 |
Скорость реакции увеличится в 4 раза.
Задача 5. Как изменится скорость химической реакции Н2 (г) + I2 (г) = 2НI (г) при увеличении давления в 2 раза?
Решение. 1. При увеличении давления в 2 раза происходит сжатие газов, и их объём уменьшается вдвое при неизменном количестве частиц. Следовательно, концентрации реагирующих газообразных веществ увеличатся в 2 раза. Записываем выражения для скоростей реакции до (v1) и после (v2) увеличения давления:
v1 = k · CН2 · CI2 |
v2 = k · 2 CН2 · 2 CI2 |
2. Определяем, во сколько раз увеличилась скорость реакции:
v2 / v1 = (k · 2 CН2 · 2 CI2) / (k · CН2 · CI2) = 2 · 2 = 4
Cкорость реакции увеличится в 4 раза.
Задача 6. Химическая реакция с температурным коэффициентом, равным 3, при температуре 50º протекает за 3 мин 20 сек. Сколько времени потребуется для протекания этой реакции при 100ºС?
Решение. Используя формулу (4.5), вычисляем, во сколько раз возрастёт скорость реакции при увеличении температуры от 50 до 100ºС:
T2 –T1
v2 = v1 · γ 10 = v1· γ(100-50)/10 = v1 ·35 = v1 ·243
Таким образом, скорость реакции возрастёт в 243 раза. Скорость реакции связана со временем протекания реакции обратным соотношением: v = 1/t, поэтому время протекания реакции уменьшится в 243 раза. Если при 50ºС реакция заканчивается за 3 мин 20сек (200 сек), то при 100ºС она закончится за 200/243 = 0,82 сек.
Задача 7. Какова величина температурного коэффициента, если при повышении температуры от 10ºС до 40ºС скорость реакции увеличилась в 27 раз?
Решение. Преобразуем формулу (4.5) и подставим в неё известные данные:
v2 / v1 = |
γ(T 2 - T 1)/10 |
27 = γ(40 - 10) /10 = γ3 |
γ = 3√27 = 3 |
Температурный коэффициент γ равен 3.
59
Задача 8. В системе А (г) + В (г)  С (г), ∆Н < 0, установилось равновесие. Какое влияние на состояние равновесия окажут увеличение давления и температуры?
С (г), ∆Н < 0, установилось равновесие. Какое влияние на состояние равновесия окажут увеличение давления и температуры?
Решение. 1. В ходе прямой реакции общее число молекул газообразных веществ уменьшается с 2 до 1. В соответствии с принципом Ле-Шателье (разд. 4.5) повышение давления приведёт к смещению равновесия в сторону меньшего числа молей газообразных веществ (т.е. в сторону продуктов реакции).
2. Так как ∆Н < 0, то прямая реакция экзотермическая (тепло выделяется). Обратная реакция будет эндотермической. Повышение температуры благоприятствует протеканию реакции, идущей с поглощением теплоты, т.е. обратной реакции. Равновесие сместится в сторону исходных веществ.
Задача 9. Как повлияет увеличение давления в 2 раза на химическое равновесие в обратимой системе
S (т) + Н2 (г)  Н2S (г)
Н2S (г)
Решение. Основной закон химической кинетики (разд. 4.3.1) не учитывает концентраций твёрдых веществ, так как они реагируют только на поверхности и их концентрация всегда остаётся постоянной. Скорости прямой и обратной реакции зависят только от концентрации газообразных реагентов:
v пр= kпр ·[Н2] v обр= kобр ·[Н2S]
Поскольку в ходе реакции число молекул в газовой фазе не меняется, то давление не влияет на положение равновесия: при увеличении давления в 2 раза в такое же число раз увеличится концентрация Н2 и Н2S, равновесие в системе не сместится.
Глава 5. Вода. Растворы
5.1.Вода
5.1.1.Содержание и распределение воды в организме человека.
Вода Н2О – одно из самых замечательных веществ по своим
уникальным физико-химическим свойствам и значению для жизнедеятельности организмов. В теле человека вода составляет в среднем 60% массы тела, колеблясь от 45% (у тучных пожилых людей) до 75% (у новорожденных). Чем моложе организм, тем выше в нём содержание воды. У молодых людей содержание воды в организме составляет примерно 40-45 литров.
60
