
Учеб. пособие для ОЗО Общая химия
.pdfковалентной связи. Все одинарные связи являются σ-связями. Существуют молекулы, в которых между атомами возникают две или три общие электронные пары. Такие ковалентные связи называют двойными и тройными, а общее их название – кратные связи. При этом одна связь – обязательно σ-связь, остальные - π-связи. Двойная связь изображается двумя чёрточками, тройная – тремя.
N≡N |
O = C = O |
Cl ─ Cl |
тройная (σ+π +π) |
двойная (σ+π) |
одинарная (σ) |
С увеличением кратности связи суммарная прочность связи увеличивается, а её длина уменьшается.
2. Насыщаемость - способность атомов образовывать определённое количество ковалентных связей. Вследствие насыщаемости связей молекулы имеют определённый состав: Н2, СН4 и т.д.
Число связей, которые образует данный атом с другими атомами в молекуле, называется валентностью элемента. Электроны, которые участвуют в образовании химических связей между атомами, называют валентными. Это наиболее слабо связанные с ядром электроны: прежде всего, электроны внешних незавершённых уровней.
Число возможных ковалентных связей, образуемых данным атомом, зависит при обменном механизме от числа неспаренных электронов на внешних энергетических уровнях у атомов в основном и возбуждённом состояниях. Например, атом водорода, имеющий один неспаренный электрон, образует одну связь.
Атом углерода в основном состоянии имеет два неспаренных электрона и может образовывать две ковалентные связи. Однако углерод в соединениях чаще образует четыре связи. Это объясняется тем, что в возбуждённом состоянии происходит переход одного электрона с 2s-орбитали на свободную 2р-орбиталь с появлением четырёх неспаренных электронов.
Валентными могут быть не только электроны внешних незавершённых уровней, но и электроны второго и третьего снаружи уровня (d- и f-подуровней). Начиная с третьего периода у атомов р- элементов при возбуждении электроны внешних s- и р-подуровней могут переходить на свободный d-подуровень этого слоя, что приводит к увеличению числа возможных связей. Именно этим объясняется способность атома фосфора образовывать в соединениях пять связей, атомов серы – четыре или шесть, а атомов хлора – три, пять и даже семь связей. Для элементов с переменной валентностью
31

принято в скобках римскими цифрами указывать валентность, например, Fe(III), Fe(II).
Однако и при насыщенных ковалентных связях могут образоваться более сложные молекулы по донорно-акцепторному механизму. В этом случае число возможных ковалентных связей будет зависеть не только от числа неспаренных электронов, а также и от числа свободных атомных орбиталей на внешних уровнях. Так, катионы d-металлов обычно могут предоставлять 2, 4 или 6 свободных атомных орбиталей разного типа (s, p, d), что значительно расширяет их возможность образовывать ковалентные связи в так называемых комплексных соединениях: [Ag(NH3)2]+; [Fe(CN)6]3- и др.
3. Направленность ковалентных связей определяет пространственную структуру (геометрию) молекул, состоящих более чем из двух атомов.
Направленность ковалентной связи является результатом стремления атомов к образованию более прочной связи за счёт максимального перекрывания атомных орбиталей взаимодействующих атомов. Атомные орбитали, участвующие в образовании химических связей, имеют различную форму и ориентацию в пространстве. Например, в молекуле метана СН4 в образовании связей с водородом участвуют один s- и три p-электрона атома углерода. Казалось бы, связи, образованные атомом за счёт орбиталей с различным значением орбитального квантового числа должны быть энергетически неравноценными. Однако это не подтверждается экспериментально. Опыт показывает, что все четыре связи в молекуле метана равнозначны. В подобных случаях пользуются представлением о гибридизации атомных орбиталей, предложенным Л. Полингом.
Гибридизацией называется процесс смешения близких по энергии атомных орбиталей различного типа с возникновением такого же количества новых (гибридных) орбиталей, одинаковых по энергии и
форме.
Гибридные орбитали имеют форму несимметричной восьмёрки, сильно вытянутой в одну сторону от ядра:
+ |
→ |
|
+ |
s |
p |
sp |
sp |
Такая форма обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов и приводит к
32
образованию более прочных связей. Поэтому энергия, затрачиваемая на гибридизацию, с избытком компенсируется выделением энергии за счёт образования более прочных связей с участием гибридных атомных орбиталей.
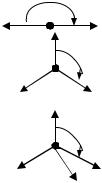
Название гибридных орбиталей определяется числом и типом участвующих орбиталей: sp-, sp2-, sp3-гибридизация (табл. 3.1). Направленность гибридных атомных орбиталей в пространстве, а, следовательно, и пространственная форма молекул зависят от типа гибридизации. Так, правильная тетраэдрическая форма молекулы метана объясняется тем, что атом углерода в СН4 предоставляет для связывания с атомами водорода не одну s- и три p-орбитали, а четыре одинаковые sp3-гибридные орбитали.
|
|
|
|
|
|
Таблица 3.1 |
|
|
Типы гибридизации |
|
|||
|
|
|
|
|
|
|
Орбитали, |
Тип |
Расположение осей |
|
Пространственная |
|
|
участвующие в |
гибриди- |
гибридных орбита- |
|
Примеры |
||
|
форма молекул |
|||||
гибридизации |
зации |
лей в пространстве |
|
|
||
|
|
|
||||
s, p |
sp |
180° |
|
|
линейная |
СО2, BeCl2, C2H2 |
|
|
|
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
треугольная |
SO3, BF3, C2H4 |
|
|
120° |
|
|||
s, p, p |
sp |
|
|
|
|
|
|
|
|
|
угловая |
О3, SO2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
тетраэдрическая |
CH4, ССl4 |
|
|
|
109° |
|
||
|
|
|
|
|
|
|
|
sp3 |
|
|
|
|
|
s, p, p, p |
|
|
|
пирамидальная |
NH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
угловая |
Н2О |
|
|
|
|
|
|
|
4. Полярность характеризует степень смещения общей электронной пары к более электроотрицательному атому. Неполярная ковалентная связь образуется между атомами элементов, имеющих одинаковую электроотрицательность. В этом случае электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов. Неполярная связь имеет место в молекулах простых веществ: H2, О2, N2, а также между одинаковыми атомами в симметричных молекулах
(Н3С─СН3, Н2С═СН2).
Полярная ковалентная связь образуется между атомами разных элементов, отличающихся электроотрицательностью. Например,
33

полярная связь имеет место в молекулах HCl, H2O, H2S, NH3. В этом случае электронная плотность общей электронной пары смещена к элементу с большей электроотрицательностью. В результате на атоме этого элемента появляется частично отрицательный заряд δ- («дельта минус»), а на другом атоме – частично положительный заряд δ+ («дельта плюс»). Например, в молекуле HCl электронная пара смещена к атому хлора, так как относительная электроотрицательность атома хлора (3,1) больше, чем атома водорода (2,2). В результате смещения электронной пары в молекуле HCl возникает диполь. Диполь – это система из двух зарядов, равных
по абсолютной величине, но противоположных по знаку.
Нδ+ l :Clδ-
+─
µ
Мерой полярности связи служит дипольный момент µ = δ · l, где δ
– заряд полюса диполя, а l – длина диполя. Единицей измерения полярности связи является Дебай (Д). 1 Д = 3,3·10-30 Кл·м.
3.2. Ионная связь
При взаимодействии двух атомов, резко различающихся электроотрицательностью, общая пара электронов может быть практически полностью смещена к более электроотрицательному атому, превращая его в отрицательный ион, при этом другой атом превращается в положительный ион. Между этими ионами действует электростатическое притяжение, т. е. ионная связь.
Химическая связь между ионами, осуществляемая
электростатическим притяжением, называется ионной связью.
Ионная связь наблюдается только в соединениях атомов типичных металлов с типичными неметаллами, например, в CsF, KBr, NaCl и др., и только в твёрдом состоянии.
Ионную связь рассмотрим на примере образования хлорида натрия NaCl. Атомы натрия и хлора резко различаются по электроотрицательности: для атома натрия она равна 0,9, а для атома хлора – 3,1. Внешние электронные уровни у обоих атомов являются не завершёнными. При этом натрию для завершения внешнего уровня легче отдать 1 электрон, чем присоединить 7, а атому хлора легче присоединить 1 электрон, чем отдать 7. При взаимодействии атома натрия с атомом хлора происходят следующие процессы:
34
Na – ē = Na+
Cl + ē = Cl─
Электронная оболочка атома натрия приобретает устойчивую конфигурацию инертного газа неона, а оболочка атома хлора – оболочку инертного газа аргона. Между ионами Na+ и Cl─ возникают силы электростатического притяжения, в результате чего образуется NaCl.
Электрическое поле иона имеет сферическую симметрию и равномерно распределено в пространстве во всех направлениях, вследствие чего ионная связь, в отличие от ковалентной, не обладает направленностью и насыщаемостью. Действительно, говорить о связи между каким-либо катионом (положительным ионом) и одним определённым анионом (отрицательным ионом) нельзя – всегда любой катион будет взаимодействовать со всеми анионами, находящимися поблизости. Соединения, состоящие из ионов, представляют собой твёрдые тела с ионной кристаллической решёткой. Ионный кристалл не содержит молекул, его можно считать громадной молекулой, так как все соседние ионы в нём связаны одинаковыми силами.
Вмеханизме возникновения ионной связи, полярной ковалентной связи и неполярной ковалентной связи нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Ионную связь можно рассматривать как предельный случай сильнополярной ковалентной связи.
Вдействительности связи не бывают ионными на 100%. Поэтому говорят о степени ионности связи. Степень ионности тем выше, чем больше разность относительных электроотрицательностей соединяемых атомов. Химическая связь между атомами считается ионной при ∆ОЭО ≥ 2; при ∆ОЭО = 0 – это связь неполярная ковалентная; в промежуточных случаях – полярная ковалентная.
Вследствие ненасыщаемости ионных связей для характеристики соединений с ионным типом связи понятие валентности, как числа ковалентных связей, не применимо. Поэтому используют понятие степени окисления, при определении которого условно предполагают, что в соединении связующие электроны переходят к более электроотрицательным атомам, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления – это условный заряд атома в соединении,
вычисленный исходя из предположения, что оно состоит только из ионов.
35
Степень окисления может иметь отрицательное, положительное и нулевое значение, которое обычно выражают арабскими цифрами со знаками + или – и ставят над символом элемента.
Отрицательное значение степени окисления имеют атомы, которые приняли электроны от других атомов (например, атом фтора во всех его соединениях имеет степень окисления -1).
Положительное значение степени окисления имеют атомы, отдающие свои электроны другим атомам. Например, степень окисления щелочных металлов равна +1, щелочноземельных +2.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ, например, H2, Cl2, N2, так как в этом случае электронное облако в равной мере принадлежит обоим атомам. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю.
3.3. Металлическая связь
Атомы большинства металлов на внешнем электронном уровне содержат небольшое количество электронов: 1, 2, реже 3. У металлов имеется избыток валентных орбиталей и недостаток электронов, которые к тому же слабо удерживаются в атоме. При сближении атомов в результате образования кристаллической решётки орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Металлы имеют кристаллическую решётку, в узлах которой находятся как атомы, так и катионы металла, а между ними – так называемый «электронный газ».
Химическая связь, обусловленная взаимодействием положительных ионов кристаллической решётки металла и
свободных электронов, перемещающихся в пределах кристаллической решётки металла называется металлической связью.
Металлическая связь не обладает направленностью, так как общие электроны равномерно распределены по всему кристаллу. Эти особенности строения металлов определяют их высокую теплопроводность и электропроводность, а также ковкость и особый металлический блеск. Металлическая связь характерна для металлов в твёрдом и расплавленном состоянии. В газообразном состоянии атомы металлов в молекулах связаны между собой ковалентной связью.
36
3.4. Межмолекулярные взаимодействия
Термином «межмолекулярные взаимодействия» пользуются для описания всех типов взаимодействий между частицами, приводящих к образованию из них ассоциатов (объединений) с достаточно определённой структурой. К межмолекулярным относятся также связи, возникающие между отдельными группами в молекулах биополимеров (белках, нуклеиновых кислотах, полисахаридах) и обеспечивающие их пространственную структуру.
Все межмолекулярные взаимодействия имеют в основе электрическую природу, согласно которой разноимённые заряды притягиваются, а одноимённые отталкиваются. В зависимости от природы взаимодействующих частиц различают следующие типы межмолекулярных взаимодействий: ион-ионные; ион-дипольные; ванде-ваальсовы силы притяжения; водородные связи.
1.Ион-ионное взаимодействие характерно для противоположно заряженных ионов. Оно наблюдается не только в веществах с ионной
кристаллической решёткой, но также в белках и нуклеиновых кислотах. Например, в белках ионизированные группы –NH3+ и –СОО- взаимодействуют между собой; фосфатные группы нуклеиновых кислот взаимодействуют с катионами металлов (Na+, K+, Mg2+, Ca2+). В организме ион-ионные взаимодействия участвуют в стабилизации определённой структуры биомолекул, в образовании ассоциатов с различными веществами.
2.Ион-дипольное взаимодействие наблюдается между ионом и полярной молекулой (диполем). Когда ион взаимодействует с диполем, то к нему притягивается полюс диполя, несущий заряд, противоположный по знаку заряду иона. Ион-дипольные силы играют особо важную роль при растворении в воде веществ, имеющих ионную кристаллическую решётку: распад молекул электролитов на ионы обеспечивается взаимодействием образующихся ионов с полярными молекулами воды (разд. 6.1).
3.Вандерваальсовы силы притяжения. Представление о них впервые было введено голландским учёным Я.Д. Ван-дер-Ваальсом. Наиболее важной и отличительной чертой этих сил является универсальность, так как они действуют между любыми нейтральными частицами. Вандерваальсовы силы проявляются на очень малых расстояниях между частицами, и их энергия резко уменьшается с увеличением этого расстояния. Термин «вандерваальсовы силы» принято распространять на все слабые
37

межмолекулярные взаимодействия, включающие ориентационное, индукционное и дисперсионное взаимодействия.
Ориентационное взаимодействие осуществляется между молекулами c полярными ковалентными связями. Полярные молекулы взаимно ориентируются таким образом, что отрицательный полюс одного диполя располагается вблизи положительного полюса другого диполя, что обеспечивает их взаимное притяжение.
─ + 
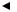 ─ +
─ +
Индукционное взаимодействие наблюдается между полярными и некоторыми неполярными молекулами. Под действием электрического поля полярной молекулы электронное облако неполярной молекулы деформируется, т.е. в ней индуцируется диполь. Примером индукционного взаимодействия является растворимость неполярных молекул йода I2 в воде, молекулы которой полярны.
─ + + |
─ + ─ + |
Самым слабым изо всех видов межмолекулярных взаимодействий является дисперсионное взаимодействие. Оно возникает между неполярными молекулами. Постоянное движение электронов в молекуле, а также колебание ядер вызывают появление в молекуле мгновенного диполя, под действием которого в соседней молекуле индуцируется также мгновенный диполь. Результатом является слабое взаимное притяжение этих частиц. При этом, чем больше размеры атомов и молекул, тем слабее связаны внешние электроны с ядром атомов, следовательно, тем выше деформируемость молекул и сильнее дисперсионные взаимодействия.
4. Водородная связь возникает между молекулами, в состав которых входят атомы водорода, связанные ковалентной связью с сильно электроотрицательным атомом (фтор, кислород, азот, реже – хлор, сера). Происходит сильное смещение общей электронной пары от водорода к атому электроотрицательного элемента. Таким образом, молекулы, образованные этими элементами, представляют собой диполи. Например, такой молекулой является HF: Нδ+ → Fδ-. Диполи двух или нескольких полярных молекул взаимодействуют друг с другом, образуя водородные связи (они обозначаются
точками):
Нδ+ → F δ-··· Нδ+ → F δ-
38

Связь в молекуле HF сильно полярна; можно считать, что у атома водорода практически полностью освобождается орбиталь (т.е. он превращается в ион). На эту свободную орбиталь попадает неподелённая электронная пара атома электроотрицательного
элемента: |
. . |
. . |
. . |
. . |
|
||||
|
Н : F : + Н : F : → Н : F |
: Н : F : |
||
|
. . |
. . |
. . |
. . |
Таким образом, возникновение водородной связи нельзя сводить только к электростатическому притяжению, в её образование вносит вклад и донорно-акцепторный механизм. Для этой связи характерны направленность в пространстве и насыщаемость.
Энергия водородной связи (10–100 кДж/моль) меньше, чем ковалентной, ионной или металлической, но больше, чем энергия вандерваальсовых взаимодействий.
Благодаря водородным связям молекулы объединяются в ассоциаты. Например, структура фтороводорода соответствует формуле (HF)п, где = 2÷6. Водородные связи могут возникать между молекулами воды, многих органических соединений, а также между отдельными группами атомов внутри одной молекулы. Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Наличие межмолекулярных водородных связей отражается на физических свойствах веществ (температуре плавления и кипения, вязкости, плотности, растворимости). Именно водородными связями объясняются такие свойства воды как большая плотность и вязкость, высокая температура плавления и кипения по сравнению с водородными соединениями элементов подгруппы кислорода (H2S, H2Se, H2Te). В случае воды надо затратить дополнительную энергию на разрыв водородных связей.
3.5.Агрегатные состояния вещества
Взависимости от температуры и давления вещества могут
существовать в нескольких агрегатных состояниях: твёрдом, жидком, газообразном и плазменном. Выделяют также промежуточные агрегатные состояния, например, жидкокристаллическое.
Переход из одного агрегатного состояния в другое называется фазовым переходом (разд. 4.2.). Фазовые переходы характеризуются определённой температурой, при которой совершается данный процесс.
39
Переход вещества из твёрдого состояния в жидкое называется
плавлением и характеризуется температурой плавления (Тпл). Переход вещества из жидкого в газообразное состояние называется
испарением и характеризуется температурой кипения (Ткип). Для некоторых веществ с небольшой молекулярной массой и слабым межмолекулярным взаимодействием возможен непосредственный переход из твёрдого состояния в газообразное, минуя жидкое. Такой переход называется сублимацией. Плавление, испарение и сублимация являются эндотермическими процессами, т.е. сопровождаются поглощением тепла (разд. 4.1).
Все перечисленные процессы могут протекать в обратном направлении: тогда их называют замерзанием, конденсацией и десублимацией. Данные процессы являются экзотермическими, т.е. протекают с выделением тепла.
3.5.1. Плазменное, газообразное и жидкое состояния Плазменное состояние достигается при высоких температурах
(свыше 104 - 105 градусов), когда вещества испаряются, распадаются на атомы, которые превращаются в ионы. Таким образом, плазма – это ионизированный газ. В таком состоянии образуются и мгновенно распадаются короткоживущие разнообразные объединения атомов, ионов и электронов. Плазменное состояние – самое распространённое состояние вещества во Вселенной. В таком состоянии находится около 99% материи. Земля относится к редкому исключению.
Газообразное состояние. В газах расстояния между частицами – молекулами и атомами - большие. Вследствие этого газообразное состояние характеризуется слабым взаимодействием частиц и неупорядоченным их расположением. В газообразном состоянии вещества энергия межмолекулярного взаимодействия частиц меньше их кинетической энергии:
Евзм < Ек
Поэтому молекулы (атомы) газа не удерживаются вместе, а свободно перемещаются в объёме, значительно превышающем объём самих частиц. При сжатии газов, когда происходит значительное увеличение их плотности, силы межмолекулярного взаимодействия становятся всё более ощутимыми. Это приводит к созданию условий для образования из молекул различных ассоциатов – групп молекул или атомов, которые постоянно образуются и разрушаются. Такое состояние, которое характеризуется присутствием в системе не
40
