
Учеб. пособие для ОЗО Общая химия
.pdfЗадача 2. Определите объём 0,1 М раствора нитрата бария, необходимый для осаждения сульфат-ионов из 100 мл 0,2 М раствора серной кислоты.
Решение. 1. Определим количество молей сульфат-ионов в 100 мл 0,2 М раствора серной кислоты по формуле (5.2):
п(H2SO4) = с(H2SO4) · V(H2SO4) = 0,2 моль/л · 0,1 л = 0,02 моль 2. Составим уравнение реакции:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
Из уравнения реакции следует, что 1 моль H2SO4 взаимодействуют с 1 моль Ba(NO3)2, т.е. для осаждения 0,02 моль сульфат-ионов потребуется 0,02 моль нитрата бария:
п(Ba(NO3)2) = п(H2SO4) = 0,02 моль 3. Определим объём 0,1 М раствора нитрата бария:
V(Ba(NO3)2) = п(Ba(NO3)2) / с(Ba(NO3)2) = 0,02моль / 0,1 моль/л= 0,2 л
Задача 3. Найдите молярную концентрацию ионов водорода и гидроксила в растворе с рН=10.
Решение. Так как рН= - lg [Н+], то молярная концентрация ионов водорода [Н+] = 10─рН = 10─10 (моль/л).
Концентрацию гидроксид-ионов [ОН-] можно вычислить, если воспользоваться формулой (6.5):
рН + рОН = 14, откуда рОН = 14 – рН = 4 Так как рОН= - lg [ОН-], то [ОН-] = 10─рОН = 10─4 (моль/л)
Задача 4. Считая диссоциацию гидроксида натрия в воде полной, вычислите рН 0,1 М раствора NаОН.
Решение. Поскольку гидроксид натрия – сильный электролит и полностью диссоциирует на ионы, то концентрация гидроксид-ионов будет равна молярной концентрации NаОН:
NаОН → Nа+ + ОН─ [ОН-] = с(NаОН) = 0,1моль/л
Рассчитываем по формуле (6.4) рОН:
рОН = - lg [ОН-] = - lg 0,1 = (- lg10-1) = 1 Вычисляем рН, воспользовавшись формулой (6.5):
рН + рОН = 14, откуда рН = 14 – рОН = 14 – 1 = 13
91
Глава 7. Дисперсные системы
Дисперсной системой называется гетерогенная система, в
которой одна из фаз представлена мелкими частицами, равномерно
распределёнными в объёме другой однородной фазы. Дисперсную фазу составляют мелкораздробленные частицы, равномерно распределённые в дисперсной системе. Дисперсионную среду составляет однородная непрерывная фаза, в которой распределены частицы дисперсной фазы.
7.1.Классификация дисперсных систем
Воснове существующих классификаций лежат различные
свойства дисперсных систем: размер частиц дисперсной фазы, агрегатное состояние дисперсной фазы и дисперсионной среды, характер взаимодействия дисперсной фазы со средой, структурномеханические и другие свойства.
По размеру частиц дисперсной фазы:
Размер частиц, м |
|
Название систем |
|
|
|
||
|
|
|
|
|
|
|
|
10-6 – 10-4 |
Грубодисперсные (микрогетерогенные): суспензии, |
||||||
|
|
эмульсии, пены, аэрозоли |
|
|
|
|
|
10-9 – 10-6 |
Высокодисперсные (ультрамикрогетерогенные): |
||||||
|
|
коллоидные растворы |
|
|
|
|
|
10-10 – 10-9 |
Молекулярно-дисперсные: истинные растворы |
||||||
|
|
низкомолекулярных веществ |
|
|
|
||
По агрегатному состоянию дисперсной фазы и дисперсионной среды: |
|||||||
Дисперсная |
|
Дисперсионная |
Обозна- |
|
Название |
|
|
фаза |
|
среда |
чение |
|
|
||
|
|
|
|
|
|||
жидкая |
|
газ |
ж/г |
туманы |
|
аэрозоли |
|
твёрдая |
|
газ |
т/г |
дымы, пыли |
|
|
|
|
|
|
|
||||
твёрдая |
|
жидкая |
т/ж |
суспензии (взвеси), |
|
||
|
коллоидные растворы (золи) |
|
|||||
|
|
|
|
|
|||
жидкая |
|
жидкая |
ж/ж |
эмульсии |
|
|
|
газ |
|
жидкая |
г/ж |
пены |
|
|
|
7.2. Коллоидные растворы
Термин «коллоиды» означает «клееподобные» (от греч. «колла» - клей и «еидос» - вид). Коллоидные растворы в зависимости от характера взаимодействия дисперсной фазы с дисперсионной средой
92
могу быть лиофобными и лиофильными. Обычно все коллоидные растворы называют золями (от лат. solutio - раствор).
Структурными единицами частиц дисперсной фазы коллоидных растворов являются мицеллы – микроструктуры, образующиеся при
взаимодействии компонентов дисперсной фазы и дисперсионной среды. Мицеллы в лиофобных и лиофильных коллоидных растворах имеют различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах.
Коллоидные растворы отличаются от истинных растворов молекулярно-кинетические свойствами. К ним относятся свойства, связанные с тепловым движением частиц: броуновское движение, диффузия, осмос. Броуновским движением называется беспорядочное, хаотичное движение частиц дисперсной фазы. С увеличением размеров частиц интенсивность броуновского движения и скорость диффузии уменьшается. Для коллоидных растворов характерно слабое броуновское движение частиц дисперсной фазы и малая скорость диффузии. Коллоидные растворы, как и истинные растворы, проходят через бумажные фильтры, но, в отличие от молекул и ионов, не проходят через поры животных и растительных мембран. Это используется для очистки коллоидных растворов от истинно растворённых веществ путём диализа – диффузии низкомолекулярных примесей из коллоидного раствора в чистый растворитель сквозь полупроницаемую мембрану. Этот метод применяется для очистки крови в аппарате «искусственная почка», в случае острой почечной недостаточности.
Истинные растворы прозрачны и оптически пусты (направленный луч света в них не виден). Специфическим свойством коллоидных растворов является их способность рассеивать свет. Это обусловлено гетерогенностью дисперсных систем и размерами коллоидных частиц. Рассеяние света можно наблюдать при боковом освещении коллоидного раствора – в виде голубоватой опалесценции раствора.
7.2.1.Лиофобные коллоидные растворы
Кним относят коллоидные растворы металлов, их оксидов,
гидроксидов, некоторых солей. Для лиофобных коллоидных растворов характерно слабое взаимодействие между дисперсной фазой и дисперсионной средой. Для образования лиофобных коллоидных растворов необходимо соблюдение следующих условий:
93
-малая растворимость дисперсной фазы;
-определённые размеры частиц дисперсной фазы;
-присутствие в системе стабилизатора.
Любое вещество может быть получено в коллоидном состоянии, нужно лишь создать соответствующие условия. Например, при растворении хлорида натрия в воде самопроизвольно получается истинный раствор. При растворении этой же соли в органическом растворителе (керосине или бензоле) в присутствии стабилизатора можно получить коллоидный раствор.
Коллоидные растворы по размеру частиц дисперсной фазы занимают промежуточное положение между грубодисперсными системами и истинными растворами. Поэтому коллоидные растворы можно получить двумя путями:
1)дисперсионным методом – диспергированием (измельчением) крупных частиц до размеров коллоидных в присутствии стабилизатора;
2)конденсационным методом - объединением молекул и ионов в истинных растворах в более крупные коллоидные частицы. Этот метод состоит в получении нерастворимых соединений путём химических реакций. Проводя эти реакции в сильно разбавленных растворах и в присутвии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы. Избыток одного из компонентов играет роль стабилизатора.
Рассмотрим образование мицеллы коллоидного раствора йодида
серебра при взаимодействии разбавленных водных растворов иодида калия и нитрата серебра, взятого в избытке (рис. 7.1). Ионы NO3─ и Ag+ играют роль стабилизатора. Реакция протекает по уравнению:
(т + п)AgNO3 + тKI → тAgI · пAg+ + пNO3─ + тKNO3
Знаком  обозначаются микрокристаллы малорастворимого вещества. При сливании разбавленных растворов электролитов образуются незаметные для глаз микрокристаллы, каждый из которых представляет собой агрегат, состоящий из некоторого числа т молекул AgI. На поверхности кристаллика AgI будут избирательно адсорбироваться ионы Ag+. Они сообщают ядру электрический заряд и называются потенциалопределяющими ионами. Вместе с микрокристаллом AgI они образуют ядро мицеллы. Вблизи заряженной поверхности ядра вследствие электростатического притяжения группируются противоположно заряженные ионы
обозначаются микрокристаллы малорастворимого вещества. При сливании разбавленных растворов электролитов образуются незаметные для глаз микрокристаллы, каждый из которых представляет собой агрегат, состоящий из некоторого числа т молекул AgI. На поверхности кристаллика AgI будут избирательно адсорбироваться ионы Ag+. Они сообщают ядру электрический заряд и называются потенциалопределяющими ионами. Вместе с микрокристаллом AgI они образуют ядро мицеллы. Вблизи заряженной поверхности ядра вследствие электростатического притяжения группируются противоположно заряженные ионы
94
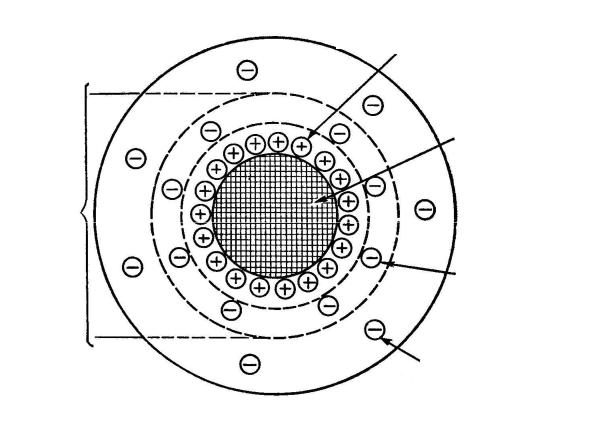
стабилизатора, т.е. ионы NO3─. Они называются противоионами. Часть противоионов благодаря адсорбционным и электростатическим силам плотно прилегает к поверхности ядра мицеллы, частично компенсируя его заряд. Эти противоионы входят в состав плотного адсорбционного слоя и вместе с ядром составляют гранулу.
Адсорбционный слой ионов
(потенциалопределяющих)
Ядро
Гранула
Адсорбционный
слой
противоионов
Диффузионный
слой
противоионов
Рис. 7.1. Схема строения мицеллы лиофобного коллоидного раствора.
Гранула имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов, но величина его меньше, чем величина заряда ядра мицеллы. От величины заряда гранулы зависит устойчивость коллоидной системы и скорость движения коллоидных частиц в электрическом поле. Часть противоионов благодаря диффузии располагаются вокруг гранулы более рыхло, диффузно. Эти противоионы образуют диффузный слой. Гранула вместе с окружающим её диффузным слоем составляет мицеллу. В отличие от гранулы мицелла не имеет строго определённых размеров и заряда.
Таким образом, ионный стабилизатор создаёт на поверхности коллоидной частицы «рыхлую» ионную атмосферу из противоионов, которая препятствует слипанию коллоидных частиц (из-за электростатического отталкивания одноимённо заряженных
95
противоионов). Под влиянием внешних воздействий коллоидные растворы могут потерять устойчивость, происходит коагуляция коллоидных растворов, которая приводит к их разрушению. Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов. В результате коагуляции укрупнённые частицы дисперсной фазы легко седиментируют, и происходит расслоение системы. Седиментацией называется свободное оседание частиц в вязкой среде под действием силы тяжести. Коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита, концентрированием коллоидного раствора, изменением температуры, рН раствора, действием ультразвука и др.
7.2.2. Лиофильные коллоидные растворы
Для лиофильных коллоидных растворов характерно сильное взаимодействие дисперсной фазы и дисперсионной среды. Такие растворы образуются самопроизвольно, они устойчивы и не требуют присутствия стабилизатора. К лиофильным коллоидным растворам относятся растворы поверхностно-активных веществ и высокомолекулярных соединений.
Коллоидные растворы поверхностно-активных веществ.
Поверхностно-активными (ПАВ) называются вещества, снижающие удельное поверхностное натяжение на границе раздела фаз. Удельное поверхностное натяжение характеризует энергию межфазного взаимодействия единицы площади поверхности раздела фаз. Чем больше энергия межмолекулярного взаимодействия в одной из фаз по сравнению с другой, тем больше поверхностное натяжение.
Характерной особенностью строения ПАВ, является дифильность (амфифильность) их молекул, т.е. наличие в молекуле гидрофильного и гидрофобного фрагмента (разд. 5.2.1). Дифильные молекулы изображают в виде «головастика» ○~~~~, у которого головка ○ соответствует полярному, а хвост – гидрофобному фрагменту молекулы. При растворении в воде дифильных веществ происходит такая взаимная ориентация их молекул, которая исключает контакт гидрофобного фрагмента с молекулами воды. В случае низких концентраций таких веществ в растворе это достигается за счёт сосредоточения молекул только в поверхностном слое раствора, где образуется из них мономолекулярный слой, в котором гидрофобные фрагменты выступают над поверхностью воды, а полярные группы
96

находятся в воде (рис. 7.2). С увеличением концентрации раствора ПАВ до определённого значения, их молекулы, взаимодействуя между собой, объединяются в крупные стойкие ассоциаты - мицеллы, которые составляют новую фазу. При этом образуется лиофильный коллоидный раствор.
Если дисперсионная среда является полярной (вода), то в мицеллах гидрофобные фрагменты спрятаны внутрь и образуют ядро мицеллы. На поверхности мицеллы будут расположены полярные группы. Полярная оболочка мицелл эффективно гидратируется, что способствует стабилизации этих частиц в коллоидных растворах.
Образование лиофильных коллоидных растворов характерно для водных растворов моющих веществ, например, мыла - C17H35COONa (стеарат натрия), белков, фосфолипидов, солей желчных кислот.
Коллоидные растворы высокомолекулярных соединений.
К высокомолекулярным соединениям (ВМС) относят природные и синтетические вещества с молекулярной массой от 10 тыс. до нескольких миллионов. В основном, они представляют собой полимеры, молекулы которых характеризуются многократным повторением повторяющихся группировок атомов. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называются макромолекулами. К природным ВМС относятся белки, полисахариды, нуклеиновые кислоты.
Для получения раствора ВМС достаточно добавить к сухому веществу подходящий растворитель. Растворение происходит через стадию набухания, что является характерной особенностью веществ этого типа. При набухании молекулы растворителя проникают в полимер и раздвигают его макромолекулы. Внешне это проявляется как увеличение объёма полимера. Если полимеры имеют трёхмерную структуру, в которой все атомы соединены ковалентными связями, то такой полимер не переходит в раствор (ограниченное набухание). В случае неограниченного набухания макромолекулы постепенно отрываются от твёрдой фазы и переходят в раствор.
97
Разбавленные растворы высокомолекулярных соединений – это истинные растворы. При повышении концентрации ВМС в растворе их молекулы образуют мицеллы. Образование мицелл в водных растворах ВМС подчиняется тем же правилам, что и в растворах ПАВ. При этом макромолекула, изгибаясь, принимает такую пространственную форму, при которой гидрофобные фрагменты образуют ядро мицеллы, а гидрофильные фрагменты обращены к воде и сильно гидратированы.
Коллоидные растворы ВМС имеют значительную вязкость. При определённой концентрации ВМС в растворе происходит самопроизвольное объединение мицелл с возникновением сплошной пространственной сетки (каркаса) полимера, в ячейках которой заключён растворитель. Такая структура придаёт дисперсной системе способность сохранять форму. Подобные связнодисперсные коллоидные системы называют гелями (от лат. gelo – застываю) или студнями. Сильно вытянутая и плёночно-листочковая форма дисперсных частиц повышает вероятность контактов между ними и благоприятствует образованию гелей.
Переход из коллоидного раствора в гель возможен при понижении температуры раствора, увеличении его концентрации, добавлении электролита, изменении рН среды. Гель также может образоваться из сухого вещества в процессе ограниченного набухания.
Образование геля с участием водной среды характерно для всех биополимеров организма. Примером перехода из раствора в гель является свёртывание крови. Из геля в раствор переходят мышечные белки при сокращении мышц. Этот процесс стимулируется повышением температуры во время разминки.
98
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1.Ахметов Н.С. Общая и неорганическая химия: учебник для вузов. – 7-е изд.; стереотипное / Н.С.Ахметов. – М. : Высшая школа, 2009. – 743 с.
2.Волков Н.И. Химия: учеб. пособие для вузов / Н.И. Волков, М.А. Мелихова – М.: Изд. Центр «Академия», 2007. – 336 с.
3.Глинка Н.Л. Общая химия: учебное пособие для вузов / Под ред. А.И. Ермакова. – изд. 30-е исправленное – М. : Интеграл-пресс, 2004. – 728 с.
4.Елфимов В.И. Основы общей химии: учеб. пособие / В.И. Елфимов, А.И. Бережной. –– 247 с.
5.Зайцев О.С. Химия: учебник для вузов / О.С. Зайцев. – М. : Изд. Центр «Академия», 2008. – 544 с.
6.Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. Для поступающих в вузы. – М.: Высшая школа, 2002. – 416 с.
7.Кузьменко Н.Е., Еремин В.В. Сборник задач и упражнений по химии. – М. : Экзамен, 2002. – 544 с.
8.Слесарев В.И. Основы химии живого: Учебник для вузов. – СПб : Химиздат, 2000. – 768 с.
9.Суворов А.В., Никольский А.Б. Общая химия: Учебник для вузов. – СПб. : Химиздат, 2007. – 624 с.
10.Хомченко И.Г. Общая химия: Учебник. – 2-е изд, испр. и доп. - М.: Новая волна, 2005. – 464 с.
11.Хомченко И.Г. Общая химия. Сборник задач и упражнений: Учеб. пособие. – М.: Новая Волна, 2006. – 256 с.
12.Хомченко Г.П. Пособие по химии для поступающих в вузы. – М. : Новая волна, 2002. – 480 с.
99
Приложение 1.ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
|
|
|
А I |
В |
|
А II В |
|
А III В |
А IV В |
|
А V |
В |
|
|
|
А VI В |
А VII В |
|
|
|
А |
|
VIII |
|
|
|
|
|
В |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
1 |
|
He |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химический |
Порядковый |
|
||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,001 |
|
|
|
|
4,003 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ВОДОРОД |
|
ГЕЛИЙ |
|
|
знак |
|
|
|
|
|
|
|
номер |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U |
92 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
Li |
|
3 |
|
Be |
4 |
|
|
B |
|
5 |
C |
|
6 |
|
|
N |
7 |
|
|
|
|
O |
8 |
F |
|
9 |
|
Ne |
10 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
238,029 |
|
|
|
|
|||||||||||||||||||||||
|
|
2 |
|
|
6,941 |
|
|
9,013 |
|
|
10,811 |
|
|
12,011 |
14,007 |
|
|
|
15,999 |
|
|
|
18,998 |
|
|
|
|
20,179 |
|
|
УРАН |
|
|
|
|
|
|
|
||||||||||
|
|
|
ЛИТИЙ |
|
|
БЕРИЛЛИЙ |
|
БОР |
|
|
УГЛЕРОД |
|
|
АЗОТ |
|
|
|
|
|
КИСЛОРОД |
ФТОР |
|
НЕОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Название |
|
|
|
Атомная |
|
|||||
|
|
|
Na |
|
11 |
|
Mg |
12 |
|
|
Al |
|
13 |
Si |
|
14 |
|
|
P |
15 |
|
|
|
|
S |
16 |
Cl |
|
17 |
|
Ar |
18 |
|
|
|
|
|
|||||||||||
|
|
3 |
|
22,990 |
|
|
24,305 |
|
|
26,981 |
|
|
28,085 |
30,974 |
|
|
СЕРА |
30,066 |
|
|
|
35,453 |
|
АРГОН |
39,948 |
элемента |
|
|
|
масса |
|
|||||||||||||||||
|
|
|
НАТРИЙ |
|
МАГНИЙ |
|
АЛЮМИНИЙ |
КРЕМНИЙ |
|
|
ФОСФОР |
|
|
|
|
ХЛОР |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
K |
|
19 |
|
Ca |
20 |
|
|
21 |
|
|
Sc |
22 |
|
Ti |
|
23 |
V |
|
|
|
24 |
Cr |
25 |
|
|
Mn |
|
|
26 |
Fe |
|
27 |
|
|
Co |
|
|
28 |
|
Ni |
|||||
|
|
|
|
39,098 |
|
|
40,078 |
44,956 |
|
|
47,88 |
|
50,941 |
|
|
|
|
|
51,996 |
|
54,938 |
|
55,847 |
|
|
58,933 |
|
|
|
|
58,693 |
|
|
|||||||||||||||
|
|
4 |
КАЛИЙ |
|
|
КАЛЬЦИЙ |
|
|
СКАНДИЙ |
|
|
ТИТАН |
|
ВАНАДИЙ |
|
|
|
ХРОМ |
МАРГАНЕЦ |
|
|
|
ЖЕЛЕЗО |
|
КОБАЛЬТ |
|
|
|
НИКЕЛЬ |
|||||||||||||||||||
|
|
29 |
Cu |
|
30 |
Zn |
|
Ga |
31 |
Ge |
|
32 |
|
|
As |
33 |
|
|
|
|
Se |
34 |
Br |
|
35 |
|
Kr |
36 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
63,546 |
|
|
65,39 |
|
|
|
|
|
69,723 |
|
|
72,59 |
74,922 |
|
|
|
78,96 |
|
|
|
79,904 |
|
|
|
|
83,8 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
МЕДЬ |
|
|
ЦИНК |
ГАЛЛИЙ |
ГЕРМАНИЙ |
|
МЫШЬЯК |
|
|
|
СЕЛЕН |
БРОМ |
|
КРИПТОН |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
Rb |
|
37 |
|
Sr |
38 |
|
|
39 |
|
|
Y |
40 |
|
Zr |
|
41 |
Nb |
|
|
|
42 |
Mo |
43 |
|
|
Tc |
|
|
44 |
Ru |
|
45 |
|
|
Rh |
|
|
46 |
|
Pd |
|||||
|
|
|
|
85,468 |
|
|
87,62 |
88,906 |
|
|
91,224 |
|
92,906 |
|
|
|
|
|
95,94 |
|
97,907 |
|
101,07 |
|
|
102,906 |
|
|
|
106,42 |
|
|
||||||||||||||||
|
|
5 |
РУБИДИЙ |
|
СТРОНЦИЙ |
|
|
ИТТРИЙ |
ЦИРКОНИЙ |
|
НИОБИЙ |
|
|
МОЛИБДЕН |
ТЕХНЕЦИЙ |
|
|
|
РУТЕНИЙ |
|
|
РОДИЙ |
|
ПАЛЛАДИЙ |
||||||||||||||||||||||||
|
|
47 |
Ag |
|
48 |
Cd |
|
In |
49 |
Sn |
|
50 |
|
Sb |
51 |
|
|
|
Te |
52 |
I |
|
53 |
|
|
|
Xe |
54 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
107,868 |
|
|
112,41 |
|
|
|
|
|
114,82 |
|
|
118,71 |
121,75 |
|
|
|
127,6 |
|
|
|
126,905 |
|
|
|
|
131,29 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
СЕРЕБРО |
|
КАДМИЙ |
ИНДИЙ |
ОЛОВО |
|
|
СУРЬМА |
|
|
|
ТЕЛЛУР |
ИОД |
|
|
КСЕНОН |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
Cs |
|
55 |
|
Ba |
56 |
|
|
57 |
|
La* |
72 |
|
Hf |
|
73 |
Ta |
|
|
|
74 |
W |
75 |
|
|
Re |
|
|
76 |
Os |
|
77 |
|
|
Ir |
|
|
78 |
|
Pt |
||||||
|
|
|
|
132,905 |
|
|
137,33 |
138,906 |
|
178,49 |
|
180,948 |
|
|
|
|
|
183,85 |
|
186,207 |
|
190,2 |
|
|
192,22 |
|
|
|
|
195,08 |
|
|
||||||||||||||||
|
|
6 |
ЦЕЗИЙ |
|
|
БАРИЙ |
|
|
ЛАНТАН |
|
ГАФНИЙ |
|
ТАНТАЛ |
|
|
ВОЛЬФРАМ |
|
|
|
РЕНИЙ |
|
|
|
ОСМИЙ |
|
ИРИДИЙ |
|
ПЛАТИНА |
||||||||||||||||||||
|
|
79 |
Au |
|
80 |
Hg |
|
Tl |
81 |
Pb |
|
82 |
|
Bi |
83 |
|
|
Po |
84 |
At |
85 |
|
|
|
Rn |
86 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
196,967 |
|
|
200,59 |
|
|
|
|
204,383 |
|
|
207,2 |
208,980 |
|
|
208,982 |
|
|
|
209,987 |
|
|
|
|
222,018 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
ЗОЛОТО |
|
|
РТУТЬ |
ТАЛЛИЙ |
СВИНЕЦ |
|
|
ВИСМУТ |
|
|
|
ПОЛОНИЙ |
АСТАТ |
|
РАДОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
Fr |
|
87 |
|
Ra |
88 |
|
|
89 |
Ac** |
104 |
|
Rf |
|
105 |
Db |
|
|
|
106 |
Sg |
107 |
|
Bh |
|
108 |
Hs |
|
109 |
|
Mt |
|
|
|
|
|
|
|
||||||||
|
|
7 |
|
223,020 |
|
226,025 |
227,028 |
|
[261] |
|
|
[262] |
|
|
|
|
|
[263] |
|
[262] |
|
|
[265] |
|
|
[266] |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
ФРАНЦИЙ |
|
РАДИЙ |
|
|
АКТИНИЙ |
РЕЗЕРФОРДИЙ |
|
ДУБНИЙ |
|
|
СИБОРГИЙ |
|
|
|
БОРИЙ |
|
|
|
ХАССИЙ |
МЕЙТНЕРИЙ |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*ЛАНТАНОИДЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Ce |
58 |
Pr |
59 |
|
Nd |
60 |
|
Pm |
61 |
|
Sm |
62 |
|
Eu |
63 |
|
Gd |
64 |
|
Tb |
65 |
Dy |
66 |
|
Ho |
67 |
|
Er |
68 |
Tm |
69 |
Yb |
|
70 |
|
Lu |
71 |
|||||||||
|
|
140.12 |
140,908 |
144,24 |
|
|
144,913 |
|
150,36 |
|
151,96 |
|
157,25 |
|
|
158,925 |
152,5 |
|
|
164,93 |
167,26 |
|
168,934 |
|
173,04 |
|
|
174,97 |
||||||||||||||||||||
|
|
ЦЕРИЙ |
ПРАЗЕОДИМ |
НЕОДИМ |
|
ПРОМЕТИЙ |
|
САМАРИЙ |
|
ЕВРОПИЙ |
|
ГАДОЛИНИЙ |
|
ТЕРБИЙ |
ДИСПРОЗИЙ |
|
ГОЛЬМИЙ |
|
|
|
ЭРБИЙ |
ТУЛИЙ |
|
|
ИТТЕРБИЙ |
ЛЮТЕЦИЙ |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
**АКТИНОИДЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Th |
90 |
Pa |
91 |
|
U |
92 |
|
Np |
93 |
|
Pu |
94 |
Am |
95 |
|
Cm |
96 |
|
Bk |
97 |
Cf |
98 |
|
|
Es |
99 |
|
Fm |
100 |
Md |
101 |
No |
|
102 |
|
Lr |
103 |
|||||||||
|
|
232,038 |
231,036 |
|
238,029 |
|
|
237,048 |
|
244,064 |
|
243,06 |
|
247,07 |
|
|
247,07 |
251,08 |
|
|
252,083 |
|
257,095 |
|
258,1 |
259,101 |
|
260,105 |
||||||||||||||||||||
|
|
ТОРИЙ |
ПРОТАКТИНИЙ |
УРАН |
|
|
НЕПТУНИЙ |
ПЛУТОНИЙ |
АМЕРИЦИЙ |
|
КЮРИЙ |
|
|
БЕРКЛИЙ |
КАЛИФОРНИЙ |
ЭЙНШТЕЙНИЙ |
|
ФЕРМИЙ |
МЕНДЕЛЕЕВИЙ |
НОБЕЛИЙ |
ЛОУРЕНСИЙ |
|||||||||||||||||||||||||||
