
- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Способы получения
Способы получения алканов можно разделить на следующие группы:
I. Промышленные способы.
Выделение из природных источников: природного и попутного газа, нефти, каменного угля, сланцев. В зависимости от месторождения того или иного полезного ископаемого, состав алканов сильно колеблется. Природный газ состоит, в основном, из метана (97-98 %); в некоторых месторождениях встречаются его гомологи с числом углеродных атомов С3–С5. Нефть состоит из смеси алканов, начиная с С5 (пентаны) до высших, содержащих несколько десятков атомов углерода, а также примесей циклоалканов и ароматических углеводородов.
II. Лабораторные способы получения.
1) Из синтез-газа:
![]()
2) Реакция Вюрца (действие металлического Na на галогенопроизводные). Общая схема:
![]()
Лучше всего по реакции Вюрца получать симметричные углеводороды, например:
![]()
Если используются галогенопроизводные с разным числом атомов углерода в цепочке, то образуется смесь алканов:

Реакционная способность галогенопроизводных убывает в ряду: R–I > R–Br > R–Cl.
3) Реакция Кольбе (электролиз солей карбоновых кислот) используется для получения алканов с четным числом атомов углерода в молекуле:
электролиз
на аноде
на катоде
электролиз
натриевая соль пропановой кислоты
бутан
4) Декарбоксилирование солей карбоновых кислот (сплавление солей карбоновых кислот со щелочами):
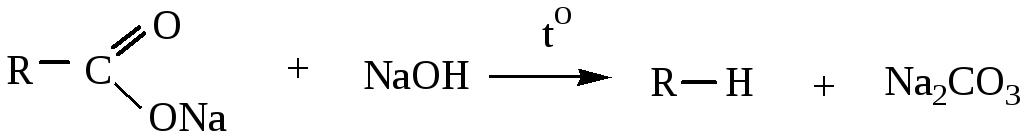
бутан![]()
натриевая соль пентановой кислоты
В результате получаются алканы с длиной углеродной цепи меньше на один атом углерода, чем в исходном соединении.
5) Реакция восстановления может использоваться для получения алканов из непредельных соединений с тем же числом атомов углерода в исходной молекуле действием на них водорода в присутствии катализаторов:

Ni, Pt, Pd – катализаторы реакции гидрирования кратных связей.
1-пропен
пропан![]()
ацетилен
этан![]()
6) Восстановление галогенопроизводных предельных углеводородов может быть проведено водородом в момент выделения (при взаимодействии металла с кислотой), либо HJ при нагревании в случае йодпроизводных.
пропан
2-йодпропан
пропан
2-бромпропан
Физические свойства.
Алканы с числом углеродных атомов в цепочке С1–С4 – газы, С5–С16 – жидкости; с С17 – твердые вещества.
Для нормальных алканов по мере роста молекулярной массы (Мr) увеличиваются температура плавления (tпл,), температура кипения (tкип), плотность (ρ). Алканы с разветвленной цепью кипят при более низких температурах, чем нормальные алканы. Чем сильнее разветвлен алкан, тем ниже его температура кипения. Температура кипения циклоалканов несколько выше, чем у соответствующих алканов.
Все алканы легче воды, их плотность ρ < 0,8 г/см3. Они практически нерастворимы в воде, но хорошо растворяются в органических растворителях. Метан, этан и высшие гомологи не имеют запаха. Средние гомологи имеют запах бензина.
ХИМИЧЕСКИЕ СВОЙСТВА
Так как в молекулах алканов содержится только σ-связь, которая трудно поляризуется и практически неполярна, для алканов характерны реакции, идущие по радикальному типу – реакции замещения (SR). Реакции присоединения не характерны, поскольку все связи в молекулах алканов насыщены.
Наиболее легко замещается водород у третичного углеродного атома, труднее – у вторичного, еще труднее – у первичного, затем – у метильного. Наиболее характерно эта закономерность проявляется, если реакция проводится при максимально возмодной температуре.
1) Галогенирование.
Активность галогенов убывает в ряду F2>Cl2>Br2>I2.
Со фтором реакция идет со взрывом, с йодом реакция не идет из-за обратимости процесса. Для получения фторпроизвоных используют реакцию с CoF3:
![]()
Галогенирование алканов протекает на свету, при нагревании (250-400 оС) или в присутствии катализаторов (хлориды меди, олова, сурьмы).
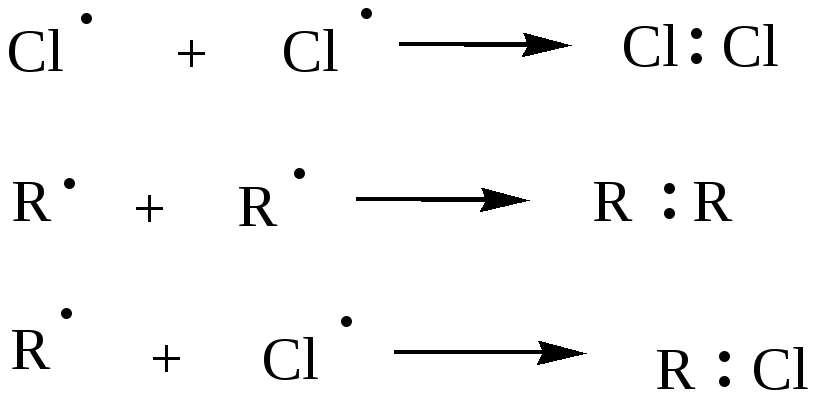
С хлором реакция идет более энергично, но менее избирательно. Механизм реакции радикально-цепной:
![]()
продолжение цепи
Обрыв цепи:
С бромом реакция идет менее энергично, но более избирательно.
изобутан
1-бром-2-метилпропан
2-бром-2-метилпропан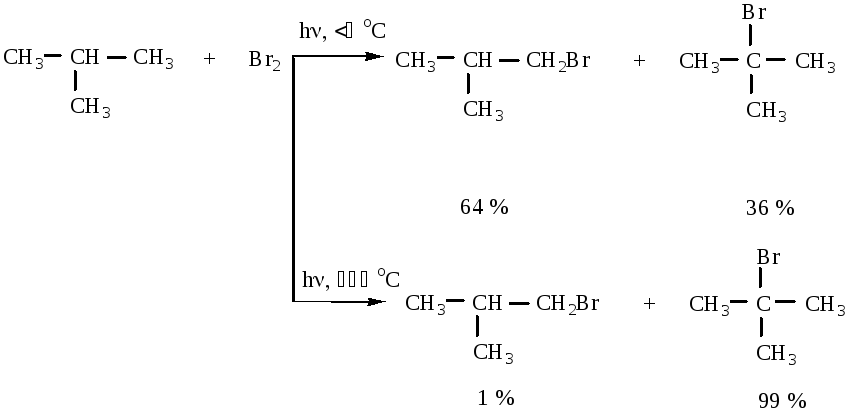
2) Нитрование по Коновалову проводится действием разбавленной азотной кислоты HNO3 (13-15 %), давлении и температуры t=100-150 оС. Легче всего водород замещается у третичного углеродного атома. Механизм реакции – радикального замещения (SR).

При повышенной температуре концентрированная азотная кислота окисляет алканы до карбоновых кислот.
3) Сульфирование алканов проводится только олеумом, реакция идет по вторичному или первичному углеродному атому, по третичному не идет из-за пространственных затруднений.

4) Сульфохлорирование проводится на свету при комнатной температуре. При этом через жидкие алканы барботируется смесь газов SO2 и Cl2. Преимущественно, из-за большого объема группы SO2Cl получаются вторичные алкансульфохлориды. Труднее замещается водород у первичного атома углерода и практически не участвует в реакции третичный углеродный атом из-за пространственных затруднений. Механизм реакции SR.
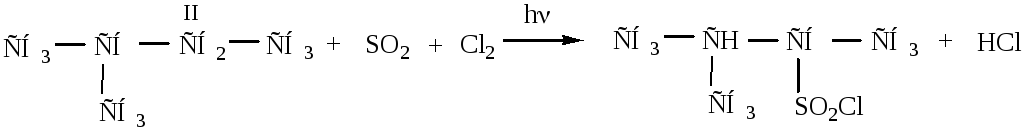
2-метилбутан
5) Сульфоокисление – действие смеси SO2 + O2 в присутствии перекисей, реакция протекает также, преимущественно у вторичных углеродных атомов по механизму SR.
![]()
2-бутансульфокислота
бутан
6) Окисление.
Полное окисление – горение (окисление кислородом воздуха при повышенной температуре) выражается суммарным уравнением:
![]()
Неполное окисление (окисление при tср или в газообразной фазе чистым кислородом – аутоокисление) в присутствии MnO2 позволяет получить спирты, альдегиды, кетоны или кислоты.
алкан
спирт
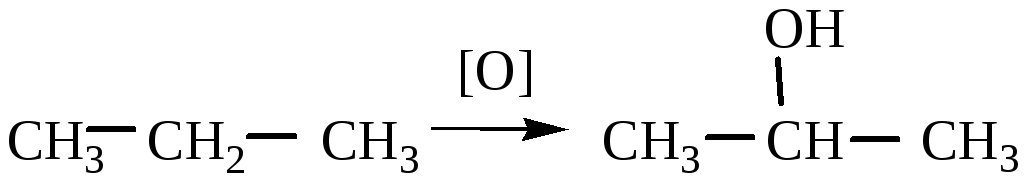
пропан
2-пропанол
Неполное окисление – цепной радикальный процесс с вырожденным разветвлением.
алкилгидропе-рекись
Алкилгидроперекись частично распадается, инициируя новую цепь
и т.д.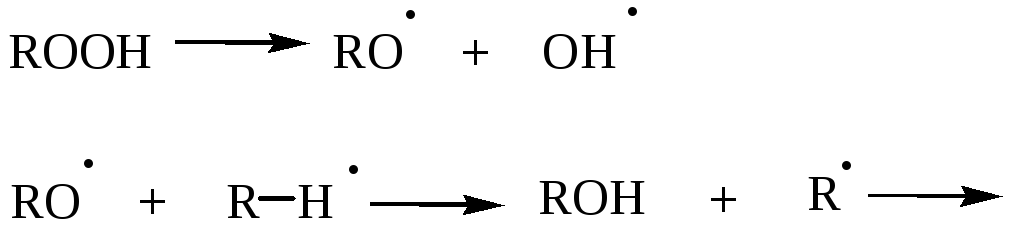
Для получения необходимых соединений подбираются соответствующие условия.
7) Термическое разложение.
При действии на алканы повышенной температуры может происходить либо крекинг, либо пиролиз углеводородов.
Крекинг бывает термический (при t=500-600 oC) и каталитический (при t=400-500 oC в присутствии катализаторов). При температуре более 700 оС происходит пиролиз.
![]()
пропан
этилен
Исходная молекула может распадаться по любой связи С-С или С-Н с образованием радикала, который потом претерпевает дальнейшие превращения с образованием разнообразных продуктов (алканов, алкенов, алкинов) с меньшим числом атомов углерода (алкины) или с тем же числом атомов углерода (появляются кратные связи). При этом должно соблюдаться правило:
ΣСисх=ΣСкон
ΣСисх – количество атомов углерода в исходном соединении
ΣСкон – суммарное количество атомов углерода в конечных продуктах
