- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Гидроксикислоты
Гидроксикислоты – органические соединения, содержащие в молекуле 2 функциональные группы: –ОН (гидроксильную) и –СООН (карбоксильную).
В зависимости от количества карбоксильных групп различают одно-, двух-, трех- и многоосновные кислоты; по количеству гидроксильных групп (включая гидроксильную группу, входящую в карбоксил) – двух, трех- и многоатомные гидроксикислоты.
По строению углеводородного радикала гидроксикислоты делятся на алифатические (насыщенные и ненасыщенные), ароматические, гетероциклические.

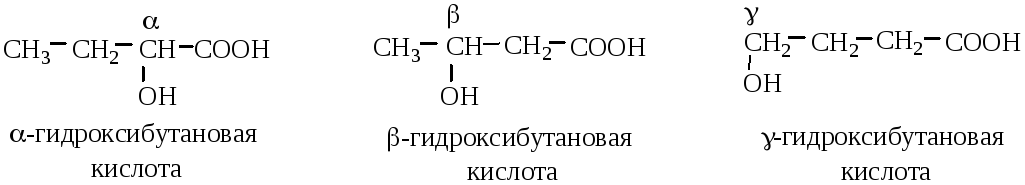
Структурная изомерия определяется строением углеводородного радикала, положением функциональных групп и их взаимным расположением. Различают α-, β–, γ– и т.д. гидроксикислоты:
![]()
Для гидроксикислот, содержащих хотя бы один асимметрический атом углерода (С*), характерна оптическая изомерия.
Атом углерода является асимметрическим, если он связан с четырьмя различными заместителями:

Большинство веществ, имеющих асимметрический атом углерода, способны поворачивать плоскость плоскополяризованного света при прохождении его через свежеприготовленные растворы этих веществ вправо или влево. Эта способность называется оптической активностью и характеризуется удельным вращением:
![]()
![]()
где
![]()
![]()
![]() – угол удельного вращения при длине
волны
– угол удельного вращения при длине
волны![]() и температуре
и температуре
![]() ;
;
![]() –угол вращения
раствора вещества;
–угол вращения
раствора вещества;
![]() –концентрация
вещества;
–концентрация
вещества;
![]() –длина кюветы.
–длина кюветы.
Перестановкой любых двух заместителей в пространстве можно получить оптические изомеры данного вещества. При наличии в молекуле одного асимметрического (хирального, от греческого “хирос” – рука) атома углерода существуют 2 стереоизомера, являющихся как бы зеркальным изображением друг друга. Такие изомеры называются энантиомерами или оптическими антиподами:

С* – асимметрический атом. Один из них вращает плоскополяризованный свет вправо: (+)-форма; другой – влево на точно такой же угол: (–)-форма. Большинство других физических и химических свойств у антиподов одинаковы.
Эквимолярная смесь оптических антиподов не обладает оптической активностью (правовращающие антиподы полностью компенсируются левовращающими), и называется рацематом (например, виноградная кислота с (+) и (–)-винными кислотами).
Если в молекуле несколько асимметрических атомов углерода, то количество стереоизомеров определяется по формуле:
N=2n, где N – количество стереоизомеров; n – число асимметрических атомов углерода.
Так, для 2,3-дигидроксибутановой кислоты существует 4 стереоизомера (n=2, N=22=4):

Для каждого изомера существует только 1 антипод (зеркальное отображение), все остальные называются диастереомерами.
При наличии в молекуле плоскости симметрии:

количество стереоизомеров оказывается меньше, чем это определяется по вышеприведенной формуле. Такая молекула является внутримолекулярным рацематом и не обладает оптической активностью (вещества а, б). Этот стереоизомер не имеет антипода и называется мезо-формой.
Оптические изомеры, у которых предпоследний гидроксил расположен справа, называют D-конфигурацией, слева – L-конфигурацией:

СПОСОБЫ ПОЛУЧЕНИЯ
Гидроксикислоты могут быть получены из спиртов введением карбоксильной группы, либо из карбоновых кислот введением гидроксильной группировки.
1) Гидролиз галогенозамещенных кислот проводится водным раствором щелочи.
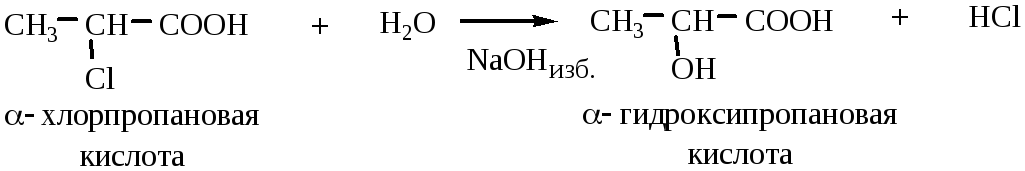
Необходимо брать избыток щелочи, чтобы нейтрализовать карбоксильную группу.
2) Гидратация непредельных кислот (присоединение Н2О по двойной связи) протекает против правила Марковникова.

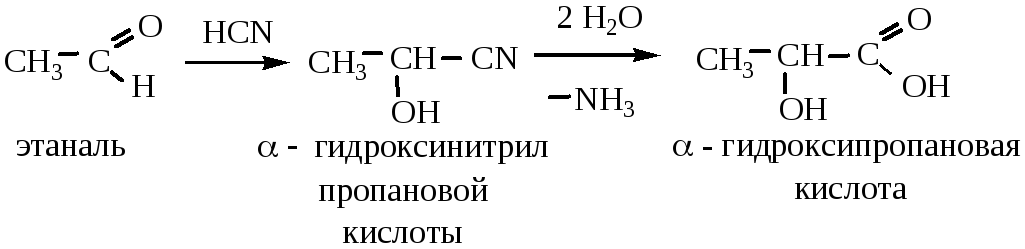
3) Оксинитрильный синтез позволяет получать гидроксикислоты из альдегидов и кетонов.
4) Окисление двух и многоатомных спиртов. При использовании строго рассчитанного количества окислителя можно получить соответствующую спиртокислоту.
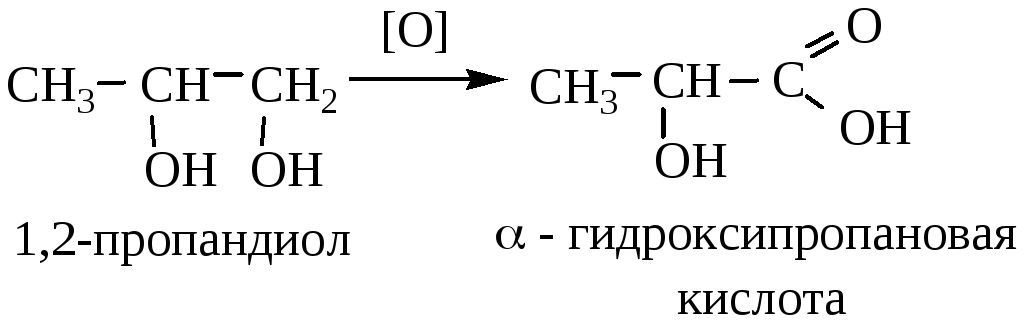
ФИЗИЧЕСКИЕ СВОЙСТВА.
Гидроксикислоты – бесцветные, вязкие жидкости или кристаллические вещества. Низшие – хорошо растворимы в воде, с увеличением молекулярной массы растворимость уменьшается.
ХИМИЧЕСКИЕ СВОЙСТВА
Химическое поведение гидроксикислот определяется их бифункциональностью (т.е. наличием двух функциональных группировок), они могут проявлять практически все химические свойства, характерные для карбоновых кислот по карбоксильной группе, и свойства, характерные для спиртов, по гидроксильной. Гидроксикислоты являются более сильными кислотами, чем обычные карбоновые.
Отличие в поведении α-, β- и γ-гидроксикислот.
При нагревании гидроксикислоты ведут себя по-разному.
1) α-гидроксикислоты образуют циклический сложный эфир-лактид:
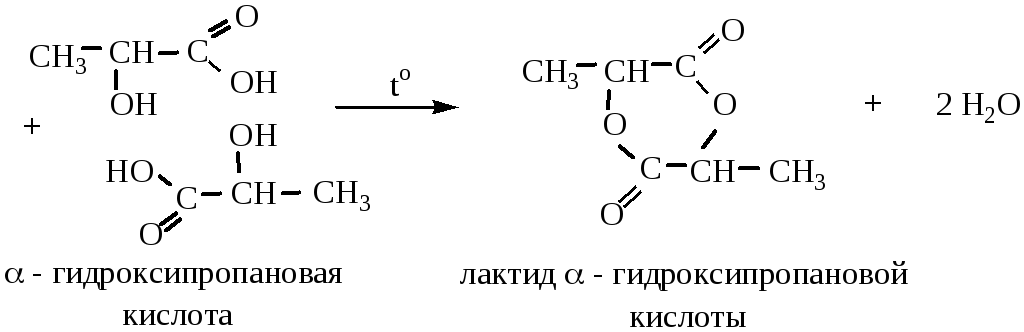
2) β-гидроксикислоты при нагревании отщепляют воду внутримолекулярно с образованием непредельных карбоновых кислот:
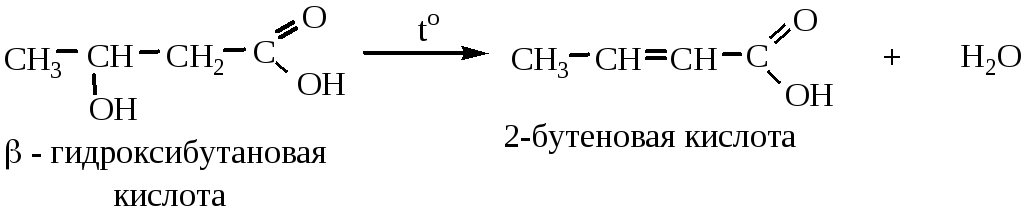
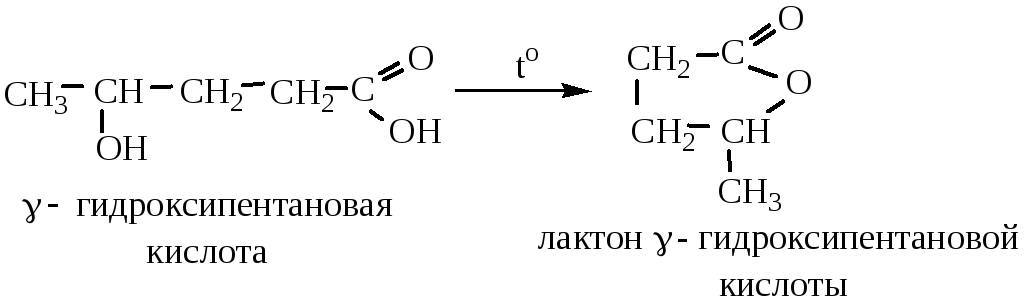
3) γ- и δ-гидроксикислоты при нагревании образуют внутренние сложные эфиры-лактоны: