
- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Одноосновные ненасыщенные кислоты
Если в молекуле
карбоновой кислоты имеется одна или
несколько связей ![]() или
или ![]() ,
то такие кислоты являются ненасыщенными:
,
то такие кислоты являются ненасыщенными:

Структурная изомерия одноосновных ненасыщенных кислот связана со строением углеродного скелета и положением двойной связи. Для ненасыщенных кислот существует пространственная изомерия (цис- и транс-):

СПОСОБЫ ПОЛУЧЕНИЯ
Для получения ненасыщенных кислот обычно используют соединение, уже содержащее одну из функциональных групп (карбоксильную группу или двойную связь).
1) Высшие карбоновые кислоты (содержащие от 12 до 22 атомов углерода), получают гидролизом жиров (липидов). Метод был рассмотрен ранее.
2) Из α-галогенкарбоновых кислот. Кратная связь образуется под действием спиртовых растворов щелочей или твердой щелочи.

3) Дегалогенирование дигалогенозамещенных карбоновых кислот, содержащих галогены у соседних атомов углерода. Образование кратной связи происходит под действием цинковой пыли.
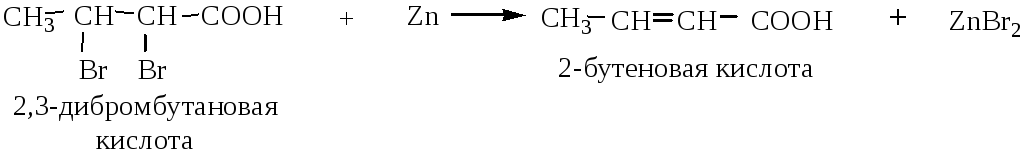
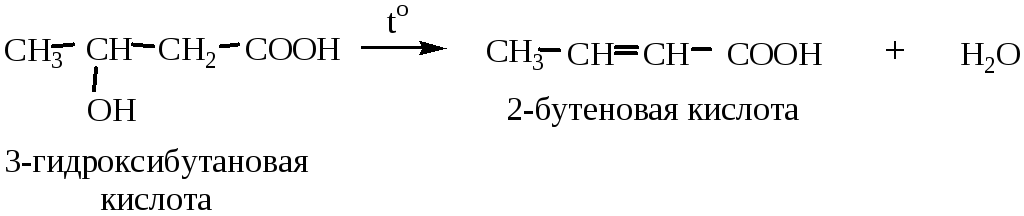
4) Дегидратация β-гидроксикислот (при нагревании они легко отщепляют воду с образованием двойной связи):
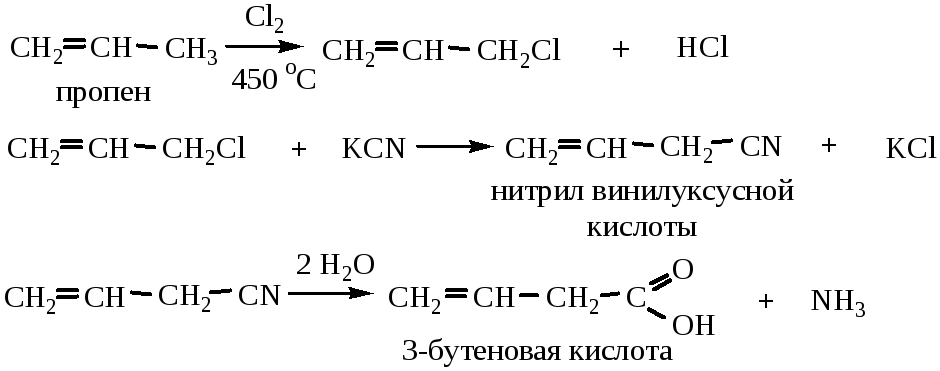
5) Окисление непредельных альдегидов:

6) Получение непредельных карбоновых кислот из алкенов:
Физические свойства.
Ненасыщенные одноосновные кислоты – жидкости или твердые вещества, низшие – со специфическим запахом, растворимы в воде; высшие – без запаха и нерастворимы в воде.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства определяются наличием двух функциональных группировок: карбоксильной группы и двойной связи. Они вступают во все реакции, характерные для карбоновых кислот, а по двойной связи – в реакции присоединения, окисления, полимеризации.
Введение в молекулу двойной связи увеличивает силу кислоты. Влияние двойной связи снижается по мере удаления ее от карбоксильной группы. Кислоты, в которых двойная связь находится между вторым и третьим атомом углерода, отличаются некоторыми особенностями поведения из-за сопряжения между двойной связью и карбоксильной группой. Например, присоединение галогеноводородов, Н2О и H2SO4 происходит по типу 1,4 (водород присоединяется к наименее гидрогенизированному атому углерода, т.е. против правила Марковникова):
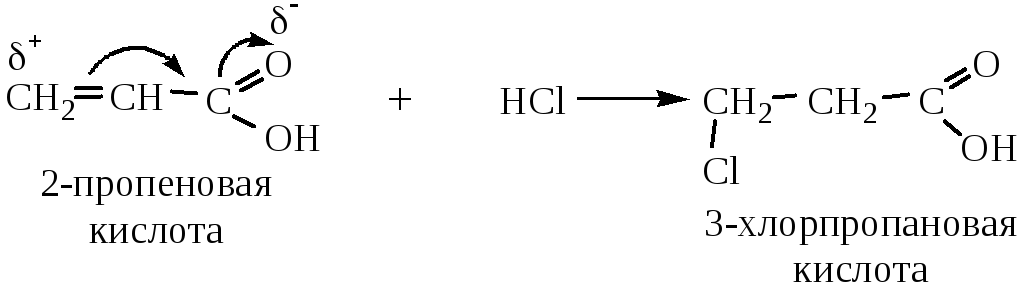
Применение.
Акриловая кислота – ее эфиры применяют для получения ценных полимерных материалов (органического стекла).
Сорбиновая кислота – антисептик, применяется для консервирования мясных и рыбных изделий, сыра, соков, овощей и др.
Олеиновая кислота – широко распространена в природе, входит в состав практически всех жиров. Является не только важнейшим компонентом пищи, но и широко применяется в технике, для производства пластмасс, мыла и т.д.
Двухосновные кислоты
Двухосновные карбоновые кислоты – это соединения, в молекулах которых содержатся две карбоксильные группы.
В зависимости от строения углеводородного радикала различают насыщенные, ненасыщенные, ароматические двухосновные карбоновые кислоты.
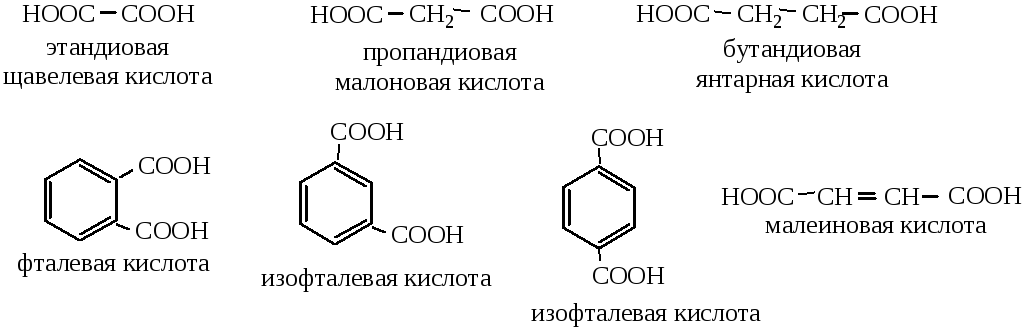
Структурная изомерия насыщенных алифатических двухосновных кислот обусловлена строением углеводородного радикала, ненасыщенных – строением радикала и положением двойных связей. У ненасыщенных кислот появляется также геометрическая (цис-, транс-) изомерия.

У ароматических кислот изомерия связана с взаимным расположением карбоксильных групп.
ФИЗИЧЕСКИЕ СВОЙСТВА.
Двухосновные кислоты – твердые вещества, без запаха, растворимы в воде и нерастворимы в углеводородах. Растворимость уменьшается с увеличением числа атомов углерода.
СПОСОБЫ ПОЛУЧЕНИЯ.
Большинство двухосновных кислот имеют специфические способы получения.
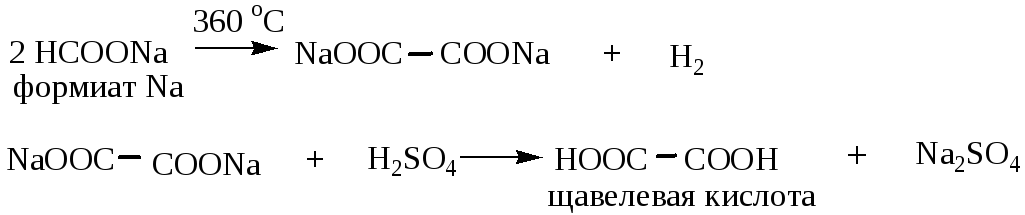
1) Получение щавелевой кислоты из формиата натрия:
2) Получение малоновой кислоты из монохлоруксусной:
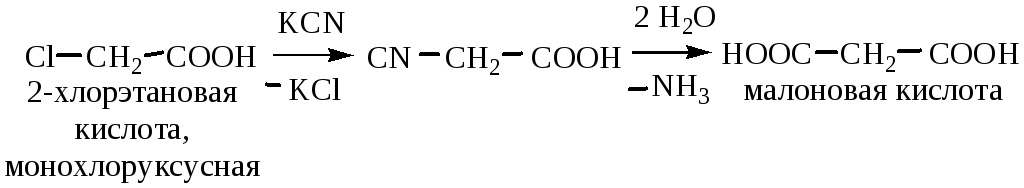
3) Получение фталевой кислоты окислением о-ксилола:

ХИМИЧЕСКИЕ СВОЙСТВА.
Двухосновные кислоты – сильнее одноосновных, т.к. вторая карбоксильная группа, выступая в качестве акцептора электронов, инициирует ионизацию первой карбоксильной группы. В водных растворах двухосновные кислоты диссоциируют на ионы:
![]()
Двухосновные кислоты вступают во все реакции, характерные для одноосновных кислот, либо одной или обеими карбоксильными группами. Кислоты алифатического ряда с количеством атомов углерода С2 – С5 обладают рядом особенностей, связанных с расположением карбоксильных групп относительно друг друга.
1) Декарбоксилирование двухосновных карбоновых кислот. Кислоты с близко расположенными карбоксильными группами легко отщепляют карбоксильную группировку с образованием одноосновных кислот:

Дикарбоновые кислоты, у которых карбоксильные группы находятся в положении 1,4 и 1,5 при нагревании образуют циклические ангидриды:

Двухосновные кислоты, содержащие непредельные связи или ароматическое кольцо, вступают в реакции, характерные для алкенов и производных бензола.
