- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
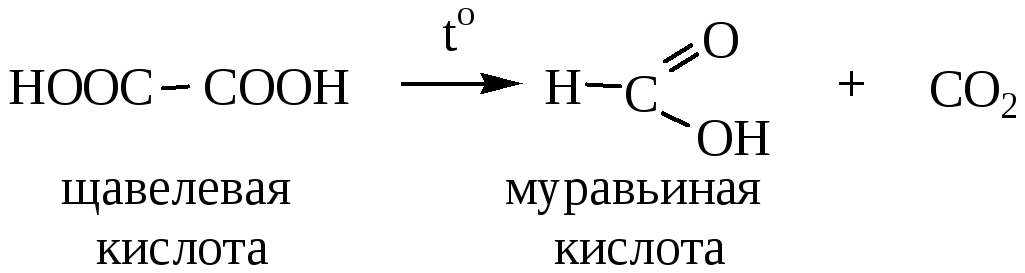
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Применение.
Формальдегид используется для синтеза разнообразных органических веществ, при производстве полимерных материалов, мономеров каучука, диолов, фармацевтических препаратов.
Этаналь (уксусный альдегид) – для получения пластмасс, уксусной кислоты, уксусного ангидрида, молочной кислоты и других продуктов.
Бензальдегид – для синтеза красителей.
Ацетон – как органический растворитель, а также для синтеза многих органических веществ.
Метилфенилкетон – для ароматизации мыла.
Ванилин
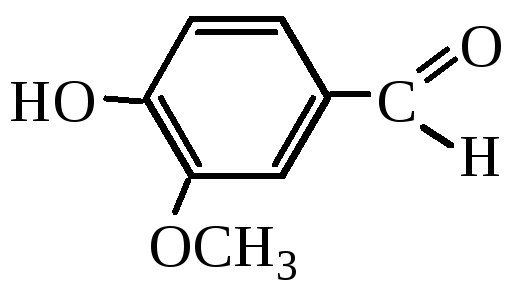 – в качестве
ароматизатора в пищевой промышленности.
– в качестве
ароматизатора в пищевой промышленности.
Карбоновые кислоты
Карбоновыми кислотами называются органические соединения, содержащие карбоксильную группировку –СООН, которая определяет основность кислоты.
В зависимости от количества карбоксильных групп различают:
а) одноосновные (предельные, непредельные, ароматические):

б) двухосновные
![]()
в) многоосновные кислоты

Одноосновные кислоты (насыщенные и ароматические)
Имеют общую формулу:
 Изомерия
определяется строением радикала и
положением карбоксильной группы.
Названия кислот применяются либо
тривиальные (уксусная, муравьиная), либо
используются названия по номенклатуре
IUPAC
с добавлением к корню слова соответствующего
суффикса –овая, или –карбоновая кислота.
Изомерия
определяется строением радикала и
положением карбоксильной группы.
Названия кислот применяются либо
тривиальные (уксусная, муравьиная), либо
используются названия по номенклатуре
IUPAC
с добавлением к корню слова соответствующего
суффикса –овая, или –карбоновая кислота.
Способы получения
1) Окисление алканов, алкенов, алкинов, спиртов, альдегидов, кетонов – было рассмотрено ранее.
2) Оксосинтез – взаимодействие алкенов с СО и H2O:

Реакцию ведут при t=50-100 oC, p=10·105 Па, катализаторы – сильные кислоты H2SO4 и H3PO4.
3) Гидролиз нитрилов.
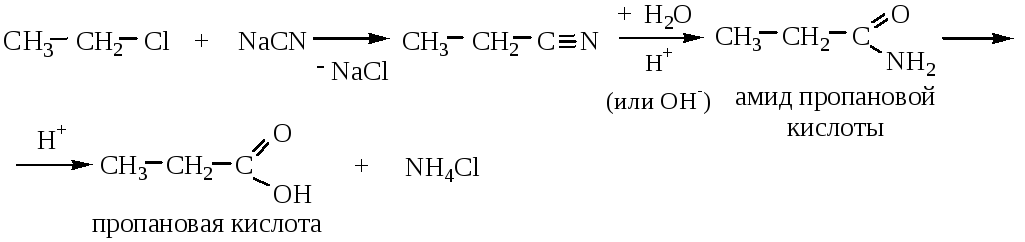
Реакцию ведут при нагревании с водными растворами щелочей или кислот.
4) Гидролиз геминальных тригалогенопроизводных

5) Металлорганический синтез позволяет получить из галогенопроизводных кислоты любых классов:

Кроме Mg, возможно использование Li или Al.
6) Гидролиз сложных эфиров. В основном используется для получения высших карбоновых кислот (С14–С22) из триглицеридов (жиров):

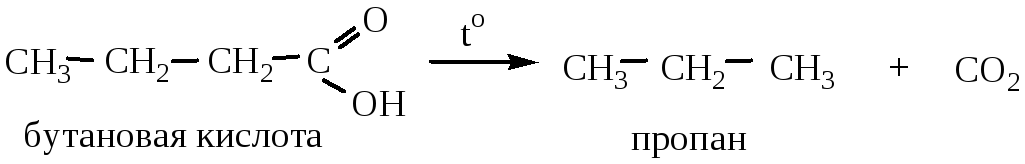
7) Декарбоксилирование (отщепление карбоксильной группы) двухосновных кислот. Реакция идет при нагревании до t=140-150 oC.
8) Синтезы с помощью малонового эфира. Диэтиловый эфир малоновой кислоты способен вступать в реакцию с этилатом Na, при этом происходит замещение водорода в α-положении (у центрального атома углерода) на натрий:
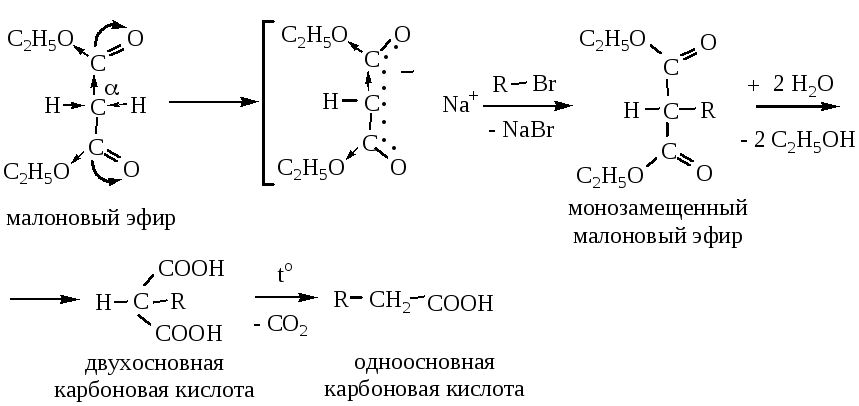
Второй атом водорода в α-положении малонового эфира также можно постадийно заместить с образованием дизамещенного эфира. Малоновый эфир вносит в синтезируемую кислоту остаток уксусной кислоты, вся остальная часть молекулы вносится галогенопроизводными.
Физические свойства.
Первые 3 кислоты (С1–С3) – жидкости с резким запахом, начиная с С4 (масляная кислота) – маслянистые жидкости с неприятным запахом; с С10 – твердые вещества без цвета и запаха. Низкомолекулярные кислоты хорошо растворимы в воде, с увеличением молекулярной массы растворимость кислот уменьшается. tкип. и tпл. в гомологическом ряду имеют обычные, ранее рассмотренные закономерности. По сравнению с остальными классами органических соединений, карбоновые кислоты имеют более высокие tкип. и tпл. из-за их способности образовывать линейные и циклические ассоциаты за счет водородных связей:

ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства карбоновых кислот обусловлены наличием карбоксильной группы и строением углеводородного радикала.
Электронное
строение карбоксильной группы таково,
что карбонильный кислород ![]() сильно смещает
плотность π-связи в свою сторону. У атома
углерода создается недостаток электронной
плотности, и он, в свою очередь, смещает
к себе плотность от кислорода группы
–ОН, а тот – плотность атома водорода
из гидроксила. Этот водород становится
подвижным и легко отщепляется в виде
протона Н+.
сильно смещает
плотность π-связи в свою сторону. У атома
углерода создается недостаток электронной
плотности, и он, в свою очередь, смещает
к себе плотность от кислорода группы
–ОН, а тот – плотность атома водорода
из гидроксила. Этот водород становится
подвижным и легко отщепляется в виде
протона Н+.

Водород, стоящий в α-положении по отношению к карбоксильной группе из-за смещения электронной плотности к карбонильному кислороду также подвижен и может быть замещен под действием определенных реагентов.
В водном растворе карбоновые кислоты диссоциируют с образованием карбоксилат-аниона и иона гидроксония:
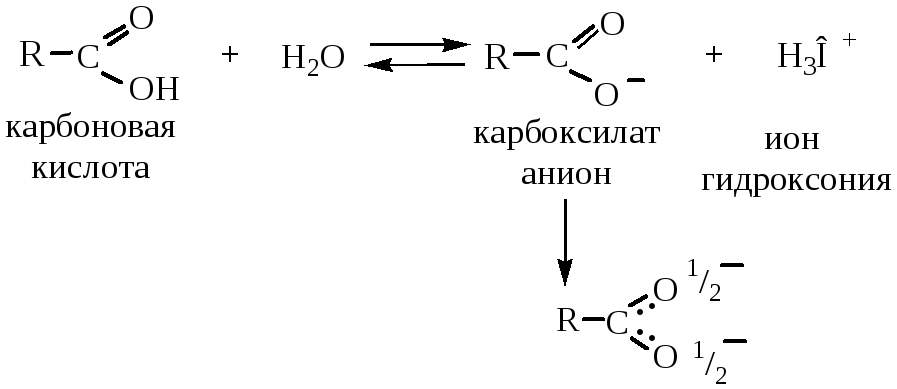
В образовавшемся карбоксилат-анионе заряд делокализуется, и электронная плотность равномерно распределяется между обоими атомами кислорода (образуется мезомерный ион).
Степень диссоциации одноосновных кислот (за исключением муравьиной) невелика (рКа ≈ 4,7-5) и зависит от строения радикала, связанного с карбоксильной группой. Алкильные радикалы, обладающие +I-эффектом снижают кислотность; электроноакцепторные группы (–I-эффект) повышают:

Карбоновые кислоты могут проявлять свои кислотные свойства с образованием солей; отщеплять группу –ОН с образованием разнообразных функциональных производных карбоновых кислот, а также восстанавливаться до альдегидов или спиртов и декарбоксилироваться. В химические реакции также может вступать радикал карбоновой кислоты.
1. Кислотные свойства карбоновых кислот. Образование солей.
При взаимодействии с металлами, гидроксидами металлов, оксидами и карбонатами, а также аммиаком карбоновые кислоты дают соответствующие соли.
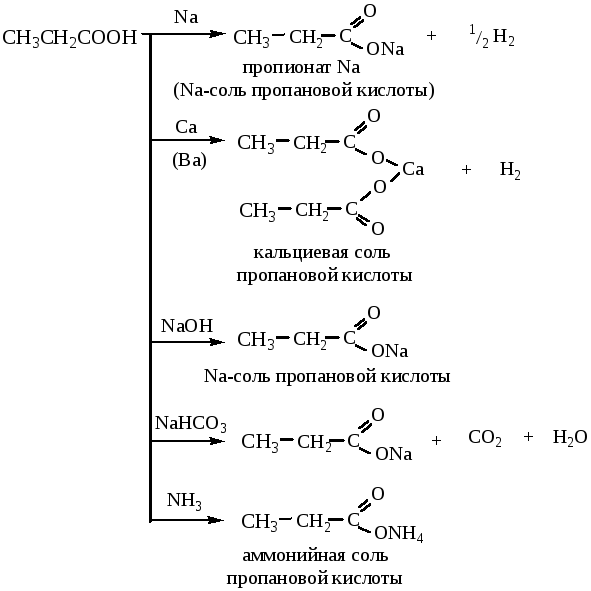
Соли карбоновых кислот легко гидролизуются с образованием исходных кислот.
2. Образование сложных эфиров (реакция этерификации). При взаимодействии карбоновых кислот со спиртами в присутствии сильных минеральных кислот образуются сложные эфиры. Реакция обратима.
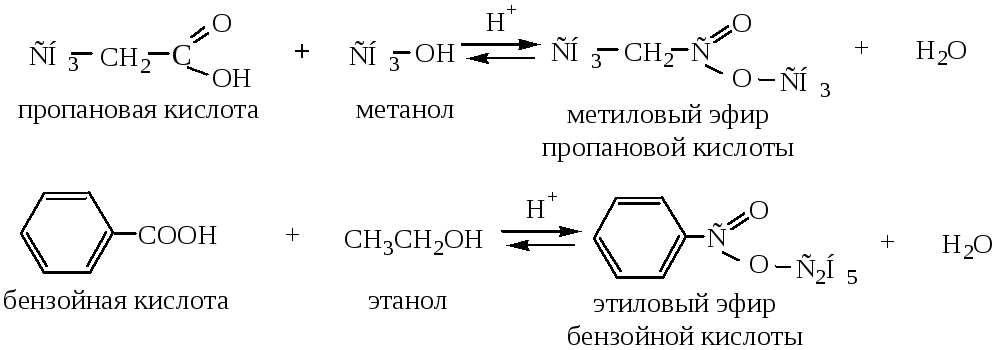
Скорость реакции зависит от строения спирта и силы кислоты и уменьшается с увеличением размеров углеводородных радикалов.
3. Образование ангидридов происходит при нагревании кислот в присутствии сильных водоотнимающих средств (кроме муравьиной кислоты, т.к. она разлагается на СО2 и Н2О).
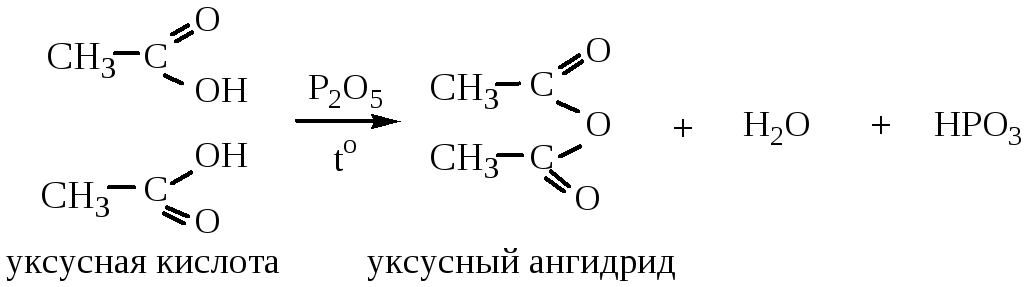
4. Образование хлорангидридов происходит при действии на кислоты PCl3, PCl5 или SOCl2.
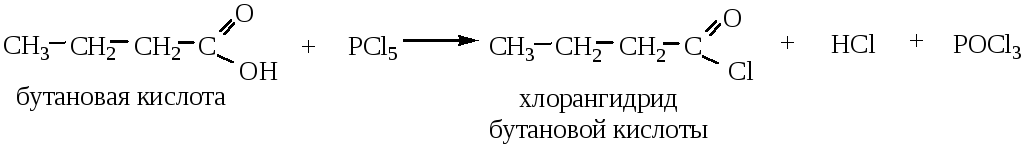
Галогенангидрид муравьиной кислоты получить невозможно, т.к. она разлагается на СО и НСl.
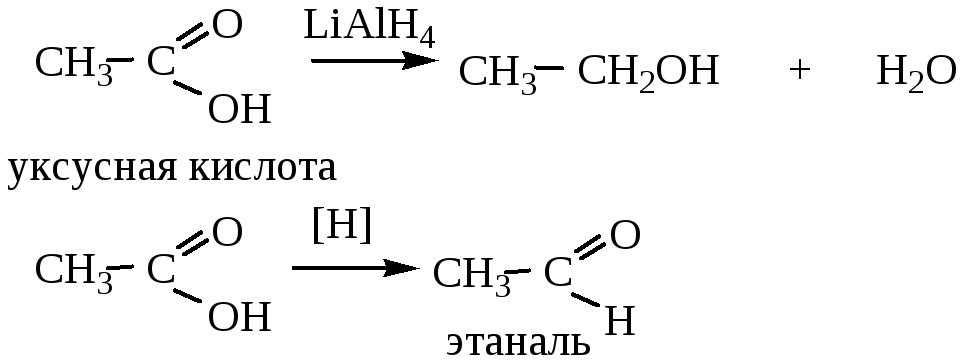
5. Восстановление карбоновых кислот (под действием LiAlH4; либо действием Na в спирте) позволяет получить альдегиды или спирты в зависимости от условий реакции.
6. Реакции углеводородного радикала.
6.1 Галогенирование алифатических кислот в α-положение
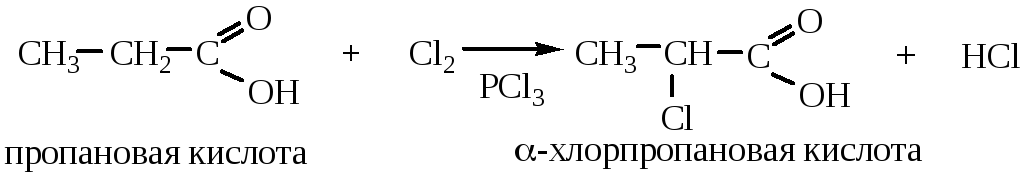
Реакция протекает как с Cl2, так и с Br2 по ионному механизму.
6.2 Окисление карбоновых кислот. В биологических системах под действием ферментов (оксидазы) окисляется β-углеродный атом:
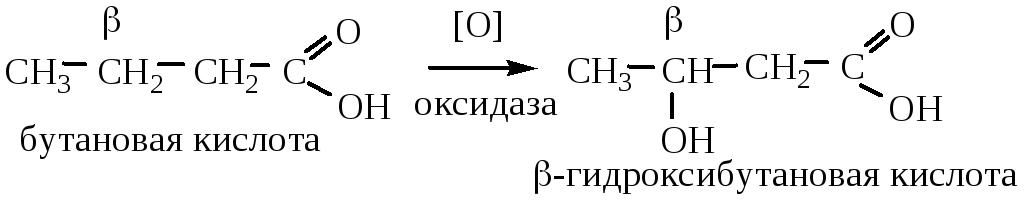
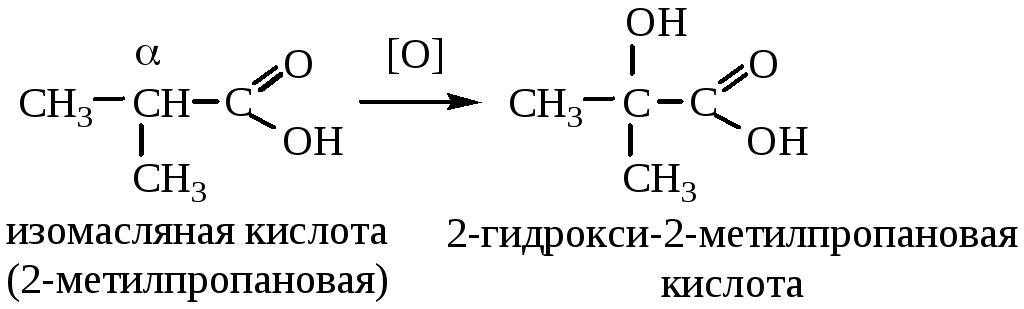
Если в α-положении карбоновой кислоты есть третичный атом углерода, то окислению подвергается он:
6.3 Замещение атома водорода в ароматических кислотах. Ароматические кислоты вступают во все реакции электрофильного замещения, характерные для гомологов бензола (группа СООН – заместитель II-рода, ориентирует в м-положение электрофильные реагенты):

7. Декарбоксилирование карбоновых кислот протекает в жестких условиях при повышенных температурах. Реакция облегчается при использовании солей карбоновых кислот (рассмотрено ранее как способ получения алканов).