
- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Применение.
Этиленгликоль применяется в текстильной, табачной, косметической промышленности в качестве гигроскопичного вещества. Водные растворы этиленгликоля замерзают при пониженной температуре (50 %-ный раствор – при -37 оС), поэтому их используют для изготовления антифризов.
Глицерин используется в химической, пищевой (для приготовления безалкогольных напитков, ликеров и т.д.), бумажной, кожевенной, косметической промышленности (как смягчающее средство). Водные растворы глицерина применяют в качестве антифризов (67 %-ный раствор замерзает при -46,5 оС).
Ксилит НОСН2(СНОН)3СН2ОН – применяют в пищевой промышленности как заменитель сахара, для приготовления разнообразных напитков, кондитерских и др. изделий.
Сорбит СН2ОН(СНОН)4СН2ОН – такая же области применения, как у ксилита.
Фенолы, нафтолы
Если гидроксильная группа связана с ароматическим ядром, то такие кислородсодержащие функциональные производные называются фенолами или нафтолами. По количеству групп –ОН различают:
одноатомные

двухатомные
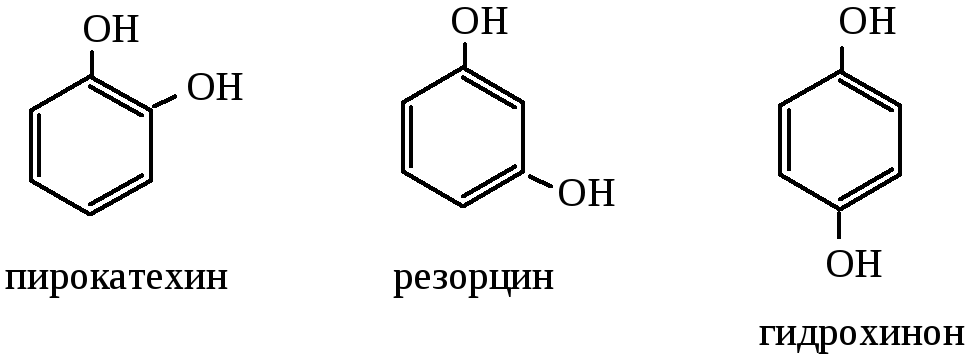
трехатомные
 и т.д.
и т.д.
Изомерия фенолов и нафтолов связана с различным положением гидроксильных групп и заместителей в ядре.
СПОСОБЫ ПОЛУЧЕНИЯ
1) Гидролиз галогенопроизводных идет в более жестких условиях, чем при получении спиртов (т.е. при нагревании и повышенном давлении) под действием водных растворов щелочей:
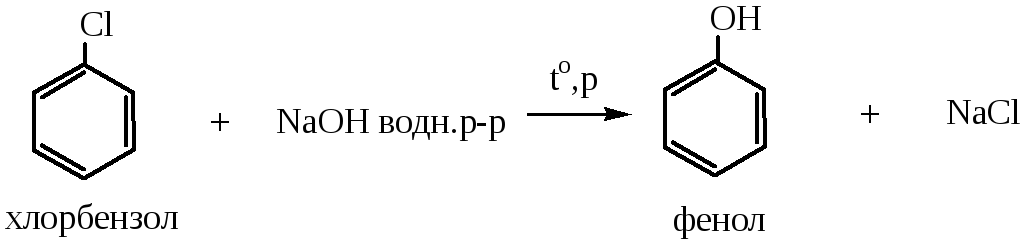
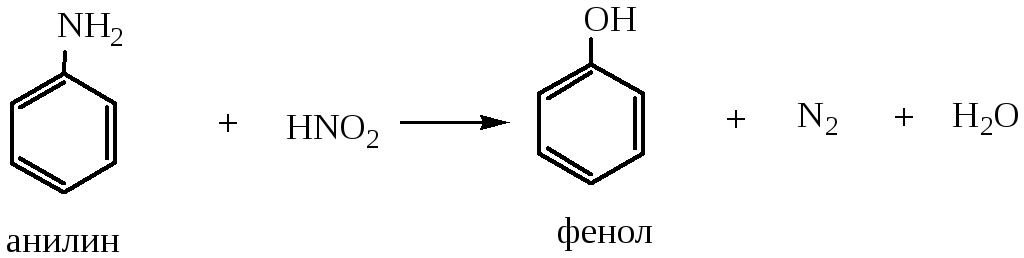
2) Замена аминогруппы на гидроксил проводится действием азотистой кислоты:
3) Разложение гипериза (гидропероксида кумила) действием разбавленного раствора H2SO4 при нагревании – промышленный способ получения фенола и ацетона

4) Из бензолсульфокислот – сплавление ароматических сульфокислот со щелочами:

Физические свойства
Фенолы и нафтолы – кристаллические вещества, труднорастворимые в воде. Обладают специфическим запахом, более высокими tкип и ρ по сравнению со спиртами. Очень токсичны.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства фенолов обусловлены наличием гидроксигруппы и ароматического ядра. Фенолы – более сильные кислоты, чем спирты, способны вступать в реакцию со щелочами и даже Na2CO3, т.к. неподеленная электронная пара атома кислорода вступает во взаимодействие с бензольным ядром (+М),

атом водорода может легко отщепляться в виде Н+.
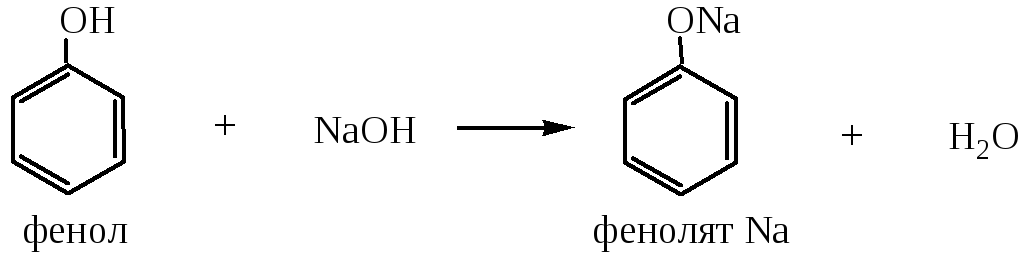
1) Образование фенолятов происходит при взаимодействии с Na, K или щелочами (NaOH, KOH):
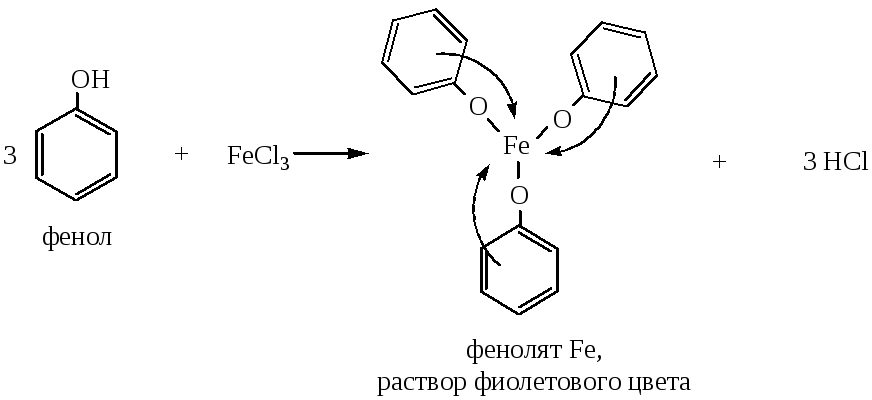
2) Взаимодействие с FeCl3 – качественная реакция на фенолы, образуются интенсивно окрашенные комплексные соединения:
3) Образование простых эфиров происходит в присутствии водных растворов щелочей при нагревании. Образуется фенолят Na, действием на который галогенопроизводных, диметилсульфата и некоторых др. реагентов можно получить простые эфиры фенола.

4) Образование сложных эфиров – при взаимодействии с хлорангидридами и ангидридами кислот:

Для фенолов затруднены реакции, связанные с заменой группы –ОН.
5) Восстановление фенолов происходит водородом при 150 оС и р=20·105Па над катализатором Ni/Al2O3. В результате получаются циклические спирты:
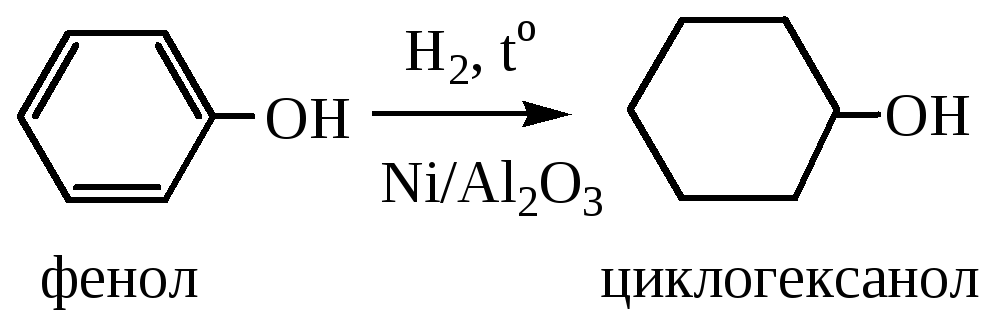
6) Окисление фенолов протекает очень легко. Даже при стоянии при tкомн. фенолы быстро темнеют, поглощая кислород воздуха. Легкая окисляемость позволяет использовать пространственно затрудненные фенолы в качестве антиоксидантов в пищевой промышленности (для сохранения свойств жиров, масел, кондитерских изделий, концентратов, рыбы, мяса и т.д.) и химической промышленности (замедление старения каучука).



7) Реакции углеводородного радикала. Взаимное влияние группы –ОН и ароматического ядра сильно активирует реакции электрофильного замещения, которые протекают в о- или п-положение по отношению к гидроксилу.

Имея сильно активированное ядро, фенолы вступают во взаимодействие даже со слабыми электрофилами, например, с азотистой кислотой:

