
- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Физические свойства
Спирты с длиной
углеродной цепочки до С11
– жидкости с характерным запахом,
содержащие более 11 атомов углерода –
твердые вещества без запаха. Спирты
легче воды, многие ядовиты (10 мл метанола
вызывает слепоту, большее количество
– смерть), все – токсичны. Из-за ассоциации
молекул за счет водородных связей 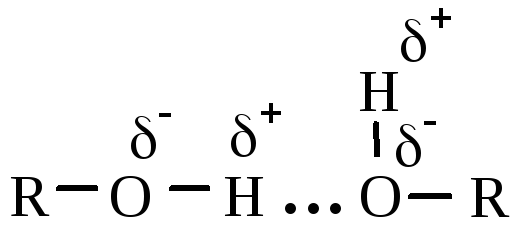 спирты имеют более
высокие tкип
по сравнению с ранее изученными классами
органических соединений. Зависимость
tкип
и tпл
от строения молекул спиртов имеет
обычные, ранее наблюдавшиеся в других
гомологических рядах закономерности.
спирты имеют более
высокие tкип
по сравнению с ранее изученными классами
органических соединений. Зависимость
tкип
и tпл
от строения молекул спиртов имеет
обычные, ранее наблюдавшиеся в других
гомологических рядах закономерности.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства спиртов обусловлены наличием группы –ОН. Кислород гидроксила как более электроотрицательный атом оттягивает на себя электронную плотность от атома водорода и от атома углерода, связанных с ним:
![]()
Поэтому спирты в определенных условиях могут проявлять либо слабые кислотные, либо щелочные свойства, т.е. являются амфотерными соединениями.
Строение углеводородного радикала и положение группы –ОН существенно влияют на реакционную способность спиртов.
Все химические свойства спиртов можно разделить на реакции, протекающие с разрывом связей О–Н, С–ОН, а также дегидрирование и окисление.
1) Реакции, протекающие с разрывом связи О–Н.
Подвижность водорода в гидроксиле уменьшается в ряду метанол > первичные спирты > вторичные спирты > третичные спирты, т.е. по мере роста цепи реакционная способность уменьшается.
1.1 Образование алкоголятов. Спирты – слабые кислоты, но при действии металлов: К, Na, Mg или Al дают соли – алкоголяты, представляющие собой твердые вещества белого цвета.

1.2 Реакция Чугаева-Церевитинова – взаимодействие спиртов с магнийорганическими соединениями – протекает с выделением газообразного алкана, по количеству выделившегося газа судят о количестве групп –ОН.

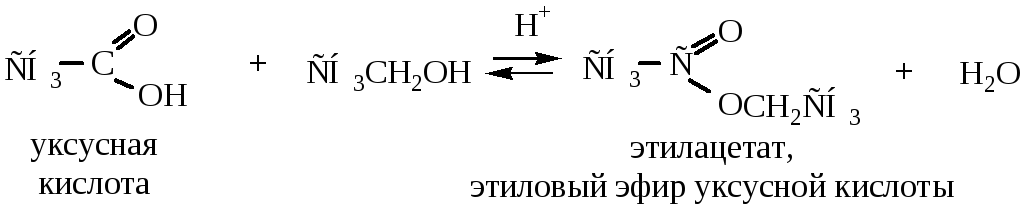
1.3 Реакция этерификации. При взаимодействии спиртов с органическими или неорганическими кислотами образуются сложные эфиры. В реакции выделяется вода (молекула воды образуется из водорода гидроксила спирта и –ОН кислоты), при ее накоплении в продуктах происходит гидролиз полученного сложного эфира. Поэтому, из-за обратимости реакции этерификацию ведут при подкислении минеральными кислотами.
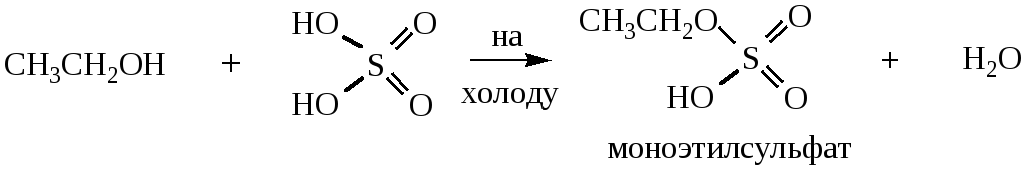
1.4 Образование простых эфиров. При взаимодействии двух молекул спирта при нагревании в присутствии водоотнимающих средств (Al2O3, H2SO4, H3PO4) происходит межмолекулярная дегидратация и образуется простой эфир.

Механизм реакции:

2) Реакции, идущие с разрывом связи С–ОН.
2.1 Замена гидроксила на галоген происходит при действии на спирты НСlсух, SOCl2, PCl3 или PCl5.
По уменьшению реакционной способности спирты располагаются в ряд: аллиловый > бензиловый > третичный > вторичный > первичный > метиловый.

2.2 Дегидратация спиртов. При нагревании молекулы спирта в присутствии водоотнимающих средств происходит внутримолекулярная дегидратация (отщепление воды происходит по правилу Зайцева). Реакционная способность падает в ряду: третичный спирт > вторичный > первичный.

Механизм реакции:

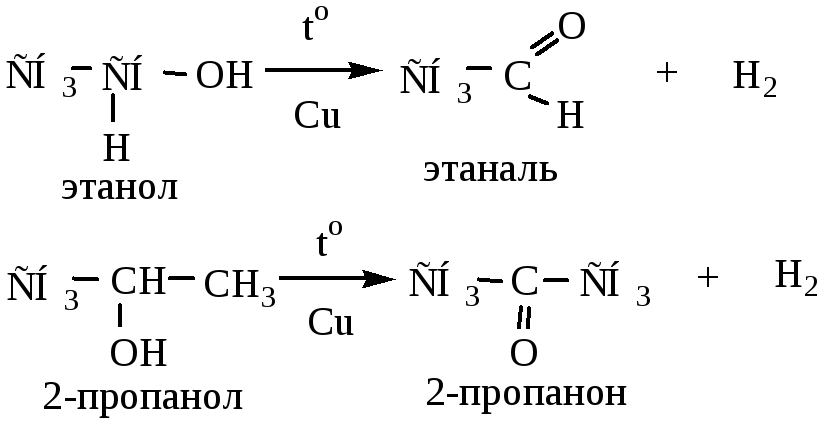
3) Дегидрирование спиртов протекает при пропускании спирта над раскаленными катализаторами Cu, Fe или Ni. При дегидрировании первичных спиртов образуются альдегиды, вторичных – кетоны.
4) Окисление происходит под действием на спирты KMnO4конц. при нагревании, хромовой смеси (H2SO4 + K2Cr2O7), О2 в присутствии катализатора (Сu). Первичные спирты окисляются до альдегидов, вторичные – до кетонов, третичные – с разрывом углеродной цепочки до смеси карбонильных соединений.
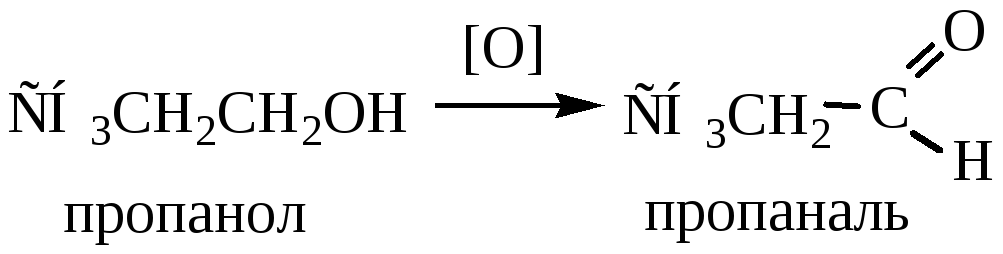


Легче окисляются первичные, труднее – вторичные, еще труднее – третичные спирты.
