
Задачи для самостоятельного решения
-
Сколько молекул содержится в 2 л кислорода, находившегося при температуре 170С и давлении 0,2 МПа?
-
Сосуд емкостью 1 л содержит 1,5 г некоторого газа под давлением 0,25 МПа. Определить среднюю квадратичную скорость молекул газа.
-
Среднеквадратичная скорость молекул газа при давлении 0,1 МПа составляет 500 м/с. Определить плотность газа при этих условиях.
-
При какой температуре средняя квадратичная скорость атомов гелия станет равной второй космической скорости (11,2 км/с)?
-
Определить массу одной молекулы углекислого газа.
-
В сосуде емкостью 5 л находится 0,2 моля некоторого газа. Определить, какой это газ, если его плотность 1,12 кг/м3.
-
Газ при температуре 309 К и давлении 0,7 МПа имеет плотность 12 кг/м3. Определить молярную массу этого газа.
-
Сколько молекул газа содержится в баллоне вместимостью 30 л при температуре 300 К и давлении 5 МПа?
-
Плотность некоторого газа 0,06 кг/м3, средняя квадратичная скорость молекул этого газа 500 м/с. Найти давление, которое газ оказывает на стенки сосуда.
-
Давление газа 1 МПа; концентрация молекул 1010 см-1. Найти температуру газа и среднюю кинетическую энергию поступательного движения одной молекулы.
-
Плотность воздуха при температуре 0 0С и давлении 760 мм рт. ст. равна 0,001293 г/см3. Сколько весит литр воздуха при температуре 27,3 0С и давлении 750 мм рт. ст.?
-
Баллон содержит газ при t1 = 500С и давлении 30 атм. Каково давление, когда из баллона будет выпущена половина массы газа, а температура понизится до t2 = 10 0С?
-
Сосуд ёмкостью V = 0,01 м3 содержит азот массой m1 = 7 г и водород массой m2 = 1 г при температуре Т = 280 К. Определить давление P смеси газов.
-
Найти плотность ρ газовой смеси, состоящей по массе из одной части водорода и восьми частей кислорода, при давлении P = 0,1 МПа и температуре Т = 290 К.
-
Баллон емкостью V = 15 л содержит смесь водорода и азота при температуре Т = 300 К и давлении P = 1,23 МПа. Масса смеси m = 145 г. Определить массу m1 водорода и массу m2 азота.
-
Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением P = 1 МПа. Считая, что масса кислорода составляет 20% от массы смеси, определить парциальные давления P1 и P2 от дельных газов.
-
Два сосуда с объемами V1 = 1 л и V2 = 3 л соединены трубкой с краном. До открытия крана в первом сосуде содержался азот под давлением P1 = 0,5 атм и при температуре t1 = 0 0С, а во втором - аргон под давлением P2 = 1,5 атм и при температуре t2 = 100 0С. Определить, какое давление установится в смеси газов, если открыть кран. Температура смеси 79 0С.
-
Плотность газа ρ при давлении P = 720 мм рт. ст. и температуре t2 = 0 0С равна 1,3 г/л. Найти массу моля μ газа.
-
Сколько молекул водорода находится в объеме 1,55 л при температуре 27 0С и давлении 750 мм рт. ст.?
-
Найти число молекул N в 1 см3 и плотность ρ азота при давлении 1,0010-11 мм рт. ст. и температуре 15 0С.
-
Два баллона соединены трубкой с краном. В первом находится газ под давлением 105 Н/м2, во втором – при 6ּ104 Н/м2. Емкость первого баллона 1 л, второго – 3 л. Какое давление установится в баллонах (в мм рт. ст.), если открыть кран? Температуре постоянна. Объемом трубки можно пренебречь.
-
Найти число ν молей и число N молекул, содержащихся в объеме V = 1см3 водяного пара при температуре t = 4 0С.
-
В баллоне емкостью V = 20 л находится аргон под давлением P1 = 800 кПа и температуре Т1 = 325 К. когда из баллона было взято некоторое количество аргона, давление в баллоне снизилось до P2 = 600 кПа, а температура установилась Т2 = 300 К. Определить массу m аргона, взятого из баллона.
-
Баллон емкостью V = 40 л заполнен азотом. Температура азота Т = 300 К. Когда часть азота израсходовали, давление в баллоне понизилось на ∆P = 400 кПа. Определить массу израсходованного азота. Процесс считать изотермическим.
-
В баллоне находился идеальный газ при давлении 4ּ107 Па и температуре 300 К. Затем 3/5 содержащегося в баллоне газа выпустили, а температура понизилась до 240 К. Под каким давлением находится оставшийся в баллоне газ?
-
Какой объем V занимает смесь азота массой m1 = 1 кг и гелия m2 = 1 кг при нормальных условиях – давлении 760 мм рт. ст. и температуре 273 К?
-
Один баллон емкостью V1 = 20 л содержит азот под давлением P1 = 24 атм, другой – емкостью V2 = 44 л содержит кислород под давлением P2 = 16 атм. Оба баллона были соединены между собой и оба газа смешались, образовав однородную смесь (без изменения температуры). Найти парциальные давления P1 и P2 обоих газов в смеси и полное давление Р.
-
В сосуде при температуре t = 100 0С и давлении P = 4ּ105 Па находится 2 м3 смеси кислорода и сернистого газа SO2. Определить парциальные давления компонентов, если масса сернистого газа т2 = 9 кг.
-
Три баллона емкостью 3 л, 7 л и 5 л наполнены соответственно кислородом (2 атм), азотом (3 атм) и углекислым газом (0,6 атм) при одной и той же температуре. Баллоны соединяют между собой, причем образуется смесь той же температуры. Каково давление смеси?
-
Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением P = 720 мм рт. ст. Считая, что масса кислорода составляет 40 % от массы смеси, определить концентрацию молекул отдельных газов при температуре 290 К.
-
Зная функцию распределения молекул по скорости, вывести формулу наиболее вероятной скорости.
-
Используя функцию распределения молекул по скорости, получить функцию, выражающую распределение молекул по относительным скоростям u (u = υ/υв).
-
Определить относительное число молекул идеального газа, скорости которых заключены в пределах от нуля до одной сотой наиболее вероятной скорости.
-
Какая часть молекул азота при 150 0С обладает скоростями от 300 до 325 м/с?
-
Какая часть молекул кислорода при 00С обладает скоростью от 100 до 110 м/с?
-
Какая часть молекул азота, находящегося при температуре Т, имеет скорости, лежащие в интервале от υв до υв +∆υ, где ∆υ = 20 м/с, Т = 400 К.
-
Определить температуру кислорода для которой функция распределения по скоростям будет иметь максимум при скорости υ = 420 м/с.
-
Определить температуру водорода, при которой средняя квадратичная скорость молекул больше их наиболее вероятной скорости на ∆υ = 400 м/с.
-
Во сколько раз средняя квадратичная скорость молекул водорода больше средней квадратичной скорости молекул водяных паров при той же температуре?
-
Азот находится под давлением p = 105 Па при температуре Т =300 К. Найти относительное число молекул азота, скорости которых лежат в интервале от υв до υв +∆υ, где ∆υ = 1 м/с.
-
Зная функцию распределения молекул по скоростям, определить среднюю арифметическую скорость <υ> молекул.
-
По функции распределения молекул по скоростям определить среднюю квадратичную скорость <υкв.>.
-
Найти среднюю арифметическую, среднюю квадратичную и наиболее вероятную скорости молекул газа, плотность которого при давлении 300 мм рт. ст. равна 0,3 г/л.
-
При какой температуре средняя квадратичная скорость молекул азота больше их наиболее вероятной скорости на 50 м/с?
-
Какая часть общего числа N молекул имеет скорости: 1) больше наиболее вероятной скорости и 2) меньше наиболее вероятной скорости?
-
Пылинки, взвешенные в воздухе, имеют массу m = 10-18 г. Во сколько раз уменьшится их концентрация n при увеличении высоты на ∆h =10 м? Температура воздуха Т = 300 К.
-
Масса т каждой из пылинок, взвешенных в воздухе, равна 1 аг. Отношение концентрации n1 пылинок на высоте h1 = 1 м к концентрации п0 их на высоте h0 = 0 равно 0,787. Температура воздуха Т = 300 К. Найти по этим данным значение постоянной Авогадро NA.
-
Насколько уменьшится атмосферное давление p = 100 кПа при подъеме наблюдателя над поверхностью Земли на высоту h = 100 м? Считать, что температура Т воздуха равна 290 К и не изменяется с высотой.
-
На какой высоте h над поверхностью Земли атмосферное давление вдвое меньше, чем на её поверхности? Считать, что температура Т воздуха равна 290 К и не изменяется с высотой.
-
Барометр в кабине летящего вертолета показывает давление p = 90 кПа. На какой высоте h летит вертолет, если на взлетной площадке барометр показывал давление p0 = 100 кПа? Считать, что температура Т воздуха равна 290 К и не изменяется с высотой.
-
Найти изменение высоты ∆h, соответствующее изменению давления на ∆p = 100 Па, в двух случаях: 1) вблизи поверхности Земли, где температура T1 = 290 К, давление p1 = 100 кПа; 2) на некоторой высоте, где температура Т2 = 220 К, давление p2 = 25 кПа.
-
Барометр в кабине летящего самолета все время показывает одинаковое давление p = 80 кПа, благодаря чему летчик считает высоту h полета неизменной. Однако температура воздуха изменилась на ∆Т = 1 К. Какую ошибку ∆h в определении высоты допустил летчик? Считать, что температура не зависит от высоты и что у поверхности Земли давление p0 = 100 кПа.
-
Высотная космическая станция расположена на горе Алагез в Армении на высоте 3250 м над уровнем моря. Найти давление воздуха на этой высоте. Температуру воздуха считать постоянной и равной 50С. Массу одного киломоля воздуха принять равной 29 кг/моль. Давление воздуха на уровне моря равно 760 мм рт. ст.
-
На какой высоте давление воздуха составляет 75 % от давления на уровне моря? Температуру считать постоянной и равной 0 0С.
-
Пассажирский самолет совершает полеты на высоте 8300 м. чтобы не снабжать пассажиров кислородными масками, в кабинах при помощи компрессора поддерживается постоянное давление, соответствующее высоте 2700 м. Найти разность давлений внутри и снаружи кабины. Среднюю температуру наружного воздуха считать равной 0 0С.
-
Найти в предыдущей задаче, во сколько раз плотность воздуха в кабине больше плотности воздуха вне её, если температура наружного пространства равна минус 200С и температура внутри кабины 200С.
-
Какова масса 1 м3 воздуха: 1) у поверхности Земли, 2) на высоте 4 км от поверхности Земли? Температуру воздуха считать постоянной и равной 00С. Давление воздуха у поверхности Земли равно 105 Па.
-
На какой высоте плотность газа составляет 50 % от его плотности на уровне моря? Температуру считать постоянной и равной 0 0С. Задачу решить для: 1) воздуха и 2) водорода.
-
На поверхности Земли барометр показывает 101 кПа. Каково будет давление при подъеме барометра на высоту 540 м. Температуру считать одинаковой и равной 7 0С.
-
Определить высоту горы, если давление на её вершине равно половине давления на уровне моря. Температура всюду одинакова и равна 0 0С.
-
Найти количество азота, прошедшего вследствие диффузии через площадку 10 см2 за 5 с, если градиент плотности азота в направлении, перпендикулярном площадке, 1,26 мг/см4. Коэффициент диффузии 1,42 см2/с.
-
За какое время 720 мг углекислого газа продиффундируют из почвы в атмосферу через 1 м2 её поверхности при градиенте плотности 500 мг/см4? Коэффициент диффузии принять равным 1,42 см2/с.
-
Определить динамическую вязкость кислорода при нормальных условиях. Принять среднюю длину свободного пробега молекул 100 нм.
-
При некоторых условиях длина свободного пробега молекул водорода равна 0,5 мкм. Определить диаметр молекулы, если эти условия таковы: давление 0,2 МПа, температура 17 0С.
-
Найти количество азота, прошедшего вследствие диффузии через площадку 100 см2 за 10 с, если градиент плотности в направлении, перпендикулярном к площадке, равен 1,26 кг/м4.
-
Коэффициенты диффузии и внутреннего трения кислорода при некоторых условиях соответствуют 0,12 Мм2/с и 19,5 мкПаּс. Найти при этих условиях плотность кислорода.
-
В сосуде объемом 2 л находится 4,0ּ1022 молекул двухатомного газа. Коэффициент диффузии равен 2,0ּ10-5 м2/с. Определить коэффициент теплопроводности газа при этих условиях.
-
Какой толщины следовало бы сделать деревянную стену здания, чтобы она давала такую же потерю теплоты, как кирпичная стена толщиной 40 см при одинаковых температурах внутри и снаружи здания? Коэффициенты теплопроводности кирпича и дерева равны соответственно 0,70 и 0,175 Вт/(мּК).
-
Между двумя пластинками, находящимися на расстоянии 1 мм друг от друга, находится воздух. Между пластинками поддерживается разность температур 10С. Площадь каждой пластины равна 100 см2. Какое количество тепла передается за счет теплопроводности от одной пластины к другой за 10 мин? Считать, что воздух находится при нормальных условиях. Диаметр молекулы равен 0,3 нм.
-
Найти коэффициент теплопроводности водорода, если известно, что коэффициент внутреннего трения для него при этих условиях 8,6 мкПаּс.
-
Средняя длина свободного пробега молекулы углекислого газа при нормальных условиях равна 50 нм. Определить среднюю арифметическую скорость молекулы и число соударений, которое испытывает молекула. d = 0,7 нм.
-
В колбе объемом 100 см3 находится 0,5 г азота. Найти среднюю длину свободного пробега молекул азота при этих условиях, d = 0,3 нм.
-
В сосуде объемом 0,5 л находится кислород при нормальных условиях. Найти общее число столкновений между молекулами кислорода за одну минуту. d = 0,3 нм.
-
Найти среднее время между двумя последовательными столкновениями молекул азота при температуре 10 0С и давлении 1 мм рт. ст. d = 0,3 нм.
-
Какое предельное число молекул газа должно находиться в 1 см3 сферического сосуда диаметром 15 см, чтобы молекулы не сталкивались друг с другом? Диаметр молекулы газа принять равным 0,3 нм.
-
Как изменится число ударов молекул одноатомного газа о стенку баллона площадью 1м2 за 1 с, если давление газа увеличится в 4 раза в 1) изотермическом и 2) изохорном процессах?
-
При каком давлении средняя длина свободного пробега молекул азота равна 1 мм, если при нормальном давлении она равна 8ּ10-6 см? d = 0,3 нм.
-
Плотность фотосферы, оцениваемая оптическими методами, составляет 2ּ10-4кг/м3. Определить длину свободного пробега атомов водорода в фотосфере, d = 0,23 нм.
-
В сосуде вместимостью 1 дм3 находится азот при температуре 7 0С и давлении 0,2 МПа. Определить число столкновений молекул азота в этом сосуде за 1с, d = 0,3 нм.
-
Какое давление нужно создать в колбе диаметром 0,1 м, содержащей азот при температуре 20 0С, чтобы получить вакуум? d = 0,3 нм.
-
Средняя длина свободного пробега молекул водорода при некотором давлении и температуре 21 0С равна 90 нм. В результате изотермического процесса давление газа увеличилось в 3 раза. Найти среднее число столкновений молекул водорода за 1 с в конце процесса. d = 0,23 нм.
-
При каком давлении средняя длина свободного пробега молекул водорода равна <λ> = 2,5 см? Температура t =68 0С, d = 0,23 нм.
-
В баллоне вместимостью 10 дм3 находится гелий массой 2 г. Определить среднюю длину свободного пробега молекул гелия, d = 0,2 нм.
-
Средняя длина свободного пробега молекул гелия при нормальных условиях 230 нм. Найти среднюю продолжительность свободного пробега молекул гелия при давлении 1,0 МПа и температуре 17 0С, d = 0,2 нм.
-
В сферическом сосуде вместимостью 2 дм3 находится водород. При какой плотности водорода молекулы его практически не будут сталкиваться друг с другом? d = 0,23 нм.
-
Определить коэффициент диффузии двухатомного газа, находящегося в сосуде объемом 2,0 л с числом молекул 4,0ּ1022, если коэффициент теплопроводности этого газа 144 мВт/(мּК).
-
Определить среднюю длину свободного пробега молекул кислорода, если при температуре 0 0С коэффициент диффузии кислорода 0,20 см2/с, d = 0,3 нм.
-
Найти коэффициент теплопроводности водорода, если коэффициент вязкости для него при этих условиях 8,6 мкПаּс.
-
Определить коэффициент диффузии гелия, если средняя длина свободного пробега атомов гелия при нормальных условиях 180 нм.
-
Углекислый газ и азот находятся при одинаковых температурах и давлениях. Найти для этих газов отношение коэффициентов диффузии, внутреннего трения, теплопроводности. Диаметры молекул этих газов: d1 = 0,4 нм, d2 = 0,3 нм.
Основные положения термодинамики
Термодинамика – раздел физики, изучающий общие свойства макроскопических систем и процессы перехода между различными состояниями. В основе термодинамики лежат установленные из опыта и подтверждающиеся всей совокупностью вытекающих из них следствий законы, называемые началами термодинамики.
Первое начало термодинамики по существу представляет собой закон сохранения энергии, примененный к термодинамическим процессам: количество теплоты, сообщенное термодинамической системе, идет на увеличение ее внутренней энергии U и совершение системой работы против внешних сил.
![]() .
.
Для процессов, в которых термодинамические параметры системы меняются бесконечно мало можно записать первое начало в дифференциальной форме.
![]() .
.
Под внутренней энергией системы подразумевают энергию этой системы за вычетом кинетической энергии системы как целого и потенциальной энергии системы в поле внешних сил. Внутренняя энергия, в отличие от работы и количества теплоты, является функцией состояния. Выражение для внутренней энергии предельно упрощается при рассмотрения простейшей термодинамической системы – идеального газа. В этом случае
![]() .
.
где i - число степеней свободы молекул газа (i = 3 для одноатомного, i = 5 для двухатомного, i = 6 для многоатомного газа с жесткой связью между атомами в молекуле).
Элементарная
работа, совершаемая газом против внешних
сил при изменении его объема:
![]() .
При изменении объема газа от V1
до V2
газ совершит работу
.
При изменении объема газа от V1
до V2
газ совершит работу
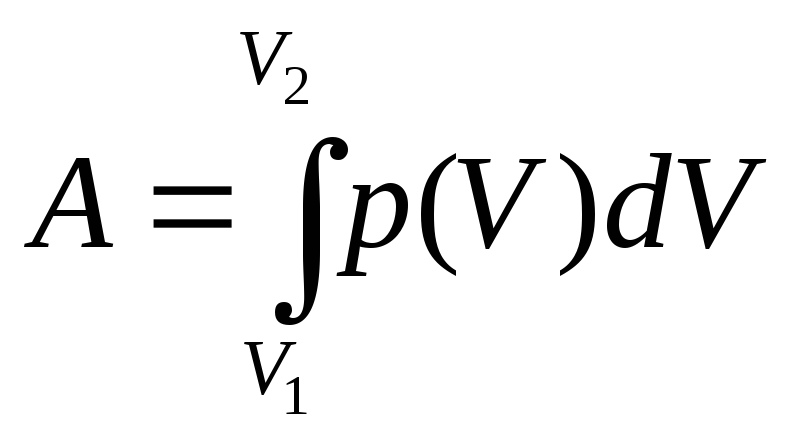 .
.
где p(V) зависимость давления от объема в процессе расширения газа. Для изобарического процесса эта формула принимает вид
![]() ,
,
а для изотермического
![]() .
.
Для расчета
количества теплоты, переданного системе,
вводится понятие теплоемкости –
величины, равной количеству теплоты,
необходимому для нагревания
вещества на 1 К:
![]() . Удобно ввести также удельную теплоемкость
– величину, равную количеству теплоты,
необходимому для нагревания 1
кг вещества на 1 К:
. Удобно ввести также удельную теплоемкость
– величину, равную количеству теплоты,
необходимому для нагревания 1
кг вещества на 1 К:
![]() и молярную теплоемкость – величину,
равную количеству теплоты, необходимому
для нагревания одного моля вещества на
1 К:
и молярную теплоемкость – величину,
равную количеству теплоты, необходимому
для нагревания одного моля вещества на
1 К:
![]() .
Удельная теплоемкость связана с молярной
соотношением
.
Удельная теплоемкость связана с молярной
соотношением
![]() .
.
Различают теплоемкости при постоянном давлении и постоянном объеме, если в процессе нагревания вещества поддерживается постоянным соответственно давление или объем. В случае нагревания при постоянном объеме не совершается работа против внешних сил, поэтому теплоемкость при постоянном объеме меньше теплоемкости при постоянном давлении. Применяя первое начало термодинамики, можно получить выражения для молярных теплоемкостей при постоянном объеме и давлении, а также уравнение связи между ними:
![]()
Последнее выражение называется уравнением Майера.
Адиабатическим называется процесс, происходящий без теплообмена с окружающей средой, при адиабатическом процессе давление, объем и температура газа связаны уравнениями Пуассона:
![]()
![]() ,
,
где
![]() отношение
теплоемкостей при постоянном давлении
и объеме, которое называют показателем
адиабаты или коэффициентом Пуассона.
Работа в адиабатическом процессе
совершается за счет убыли внутренней
энергии
отношение
теплоемкостей при постоянном давлении
и объеме, которое называют показателем
адиабаты или коэффициентом Пуассона.
Работа в адиабатическом процессе
совершается за счет убыли внутренней
энергии
![]() и выражается следующими формулами:
и выражается следующими формулами:
 .
.
Круговым процессом или циклом называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. Коэффициентом полезного действия тепловой машины называется выражение, определяемое формулами:
![]() ,
,
где А работа, совершенная рабочим веществом тепловой машины за цикл, QН количество теплоты, полученное рабочим веществом от нагревателя, QХ количество теплоты, отданное рабочим веществом холодильнику за то же время.
Второе начало
термодинамики определяет направление
протекания термодинамических процессов
и может быть сформулировано несколькими
эквивалентными способами. Наиболее
часто встречаются формулировки Клаузиуса
и Томсона: 1) невозможен процесс,
единственным результатом которого
является передача теплоты от холодного
тела к горячему; 2) невозможен процесс,
единственным результатом которого
является совершение работы за счет
охлаждения одного тела. Основываясь на
втором начале термодинамики, Карно
вывел теорему, носящую его имя: из всех
периодически действующих тепловых
машин, имеющих одинаковые температуры
нагревателя и холодильника, наибольшим
КПД обладают обратимые машины; при этом
КПД обратимых машин, работающих при
одинаковых температурах нагревателей
и холодильников, равны друг другу и не
зависят от конструкции машин. Введя в
рассмотрение абстрактный обратимый
цикл, состоящий из двух изотерм и двух
адиабат, Карно установил формулу
максимально возможного КПД тепловой
машины
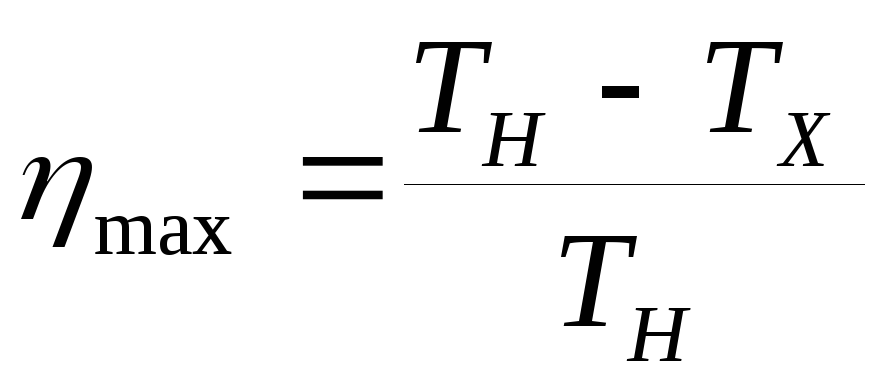 (ТН, ТХ
температуры нагревателя и
холодильника).
(ТН, ТХ
температуры нагревателя и
холодильника).
Введя специальную
функцию состояния системы
энтропию S, можно дать
еще одну формулировку второго начала
термодинамики: энтропия адиабатически
изолированной системы при любых
процессах, происходящих в ней, не
уменьшается она
возрастает при необратимых процессах
и остается постоянной при обратимых
![]() .
Если система совершает переход из
состояния 1 в состояние 2, то изменение
энтропии
.
Если система совершает переход из
состояния 1 в состояние 2, то изменение
энтропии
![]() ,
,
(знак
равенства относится к обратимым
процессам). Физический смысл энтропии
раскрывает формула Больцмана
![]() ,
где k - постоянная Больцмана,W
термодинамическая
вероятность состояния системы - число
способов, которыми может быть реализовано
данное состояние макросистемы.
,
где k - постоянная Больцмана,W
термодинамическая
вероятность состояния системы - число
способов, которыми может быть реализовано
данное состояние макросистемы.
Примеры решения задач
Задача № 1
Газ, занимавший объем 2 л при давлении 0,1 МПа, расширился изотермически до 4 л. После этого, охлаждая газ изохорически, уменьшили давление в 2 раза. Далее газ изобарически расширился до 8 л. Начертите график зависимости давления от объема, найдите работу, совершенную газом.
|
Дано: V1 = 2 л P1= 0,1 МПа V2 = 4 л
P3
=
V3 = 8 л |
|
A - ? |
Построим график
зависимости давления от объема. Первый
процесс, происходящий с газом, является
изотермическим. Выразим давление через
объём и температуру при помощи уравнения
Менделеева – Клапейрона
![]() .
Так как T
= const,
давление в данном процессе обратно
пропорционально объёму, и линия,
изображающая данный процесс на p-V
диаграмме, будет участком гиперболы
начинающейся в точке V1,
p1
и
заканчивающейся в точке V2,
p2.
.
Так как T
= const,
давление в данном процессе обратно
пропорционально объёму, и линия,
изображающая данный процесс на p-V
диаграмме, будет участком гиперболы
начинающейся в точке V1,
p1
и
заканчивающейся в точке V2,
p2.
Второй процесс, происходящий с газом, является изохорическим. В этом процессе объём не изменяется и, следовательно, на P-V диаграмме он изображается в виде вертикальной прямой, идущей из точки V2, p2 в точку V2, p3.
Третий процесс происходящий с газом, по условию задачи, изобарический. На P-V диаграмме он будет выглядеть как горизонтальная линия, идущая из точки V2, p3 в точку V3, p3.
П оследовательно
изображая все процессы, получим
следующую P-V
диаграмму.
оследовательно
изображая все процессы, получим
следующую P-V
диаграмму.
Рассчитаем работу, совершенную газом. Так как работа, совершаемая газом, аддитивная величина
А = А1+А2+А3 ,
где А1
– работа, совершенная в изотермическом
процессе, А2
–
работа,
совершенная в изохорическом процессе,
А3 –
работа,
совершенная в изобарическом процессе.
Каждую из работ можно вычислить по
формуле
 (V1
и V2
– начальные
и конечные объёмы занимаемые газом).
Применим эту формулу для определения
работы А1.
Согласно уравнению Менделеева –
Клапейрона, зависимость p(V)
имеет вид
(V1
и V2
– начальные
и конечные объёмы занимаемые газом).
Применим эту формулу для определения
работы А1.
Согласно уравнению Менделеева –
Клапейрона, зависимость p(V)
имеет вид
![]() .
.
Следовательно,
работа
 .
Множитель
.
Множитель
![]() RT
вынесем из-под знака интеграла как
постоянную величину, заменяя её на p1V1,
получим
RT
вынесем из-под знака интеграла как
постоянную величину, заменяя её на p1V1,
получим
![]() .
.
В изохорическом процессе изменение объёма газа не происходит, следовательно, А2 = 0.
При вычислении работы А3 учтём, что давление, как постоянная величина, может быть вынесена из под знака интеграла
 .
.
Для
расчёта необходимо знать давление P3.
Так как первый процесс изотермический,
![]() .
По условию задачи
.
По условию задачи
![]() ,
следовательно,
,
следовательно,
![]() .
.
Общая работа А = А1+А2+А3 = 238,63 Дж.
Ответ: работа, совершенная газом А = 238,63 Дж.
В качестве дополнения заметим, что существует еще один способ определения работы, совершаемой газом, – графический. Как известно, площадь на диаграмме pV между линией, изображающей процессы, происходящие с газом, и осью объема по модулю равна работе. Если объём газа увеличится, то работа положительна, в противном случае отрицательна. В ряде случаев этот метод позволяет найти работу, не прибегая к вычислению интегралов.
Задача № 2
Азот находящийся при температуре 400 К, подвергли адиабатическому расширению, в результате которого его объём увеличился в n = 5 раз, а внутренняя энергия уменьшилась на 4 кДж. Определите массу азота, считая его идеальным газом.
|
Дано:
i = 5 T1 = 400 K V2 = nV1 n = 5 ΔU = - 4 кДж |
|
m -? |
Составим выражение изменения внутренней энергии азота, считая его идеальным газом.
ΔU
=![]() ΔT
=
ΔT
=
![]()
Учитывая, что
процесс расширения происходил
адиабатически, воспользуемся уравнением
Пуассона, связывающим температуры и
объёмы ![]() (
(![]() -показатель
адиабаты). С помощью данного уравнения
сведём неизвестное отношение температур
к известному отношению объёмов:
-показатель
адиабаты). С помощью данного уравнения
сведём неизвестное отношение температур
к известному отношению объёмов:
 .
.
Д ля
изменения внутренней энергии в итоге
получаем формулу
ля
изменения внутренней энергии в итоге
получаем формулу
![]() .
.
Выразив массу и произведя расчеты, получим кг.
Ответ: масса азота m = 0.028 кг.
Задача № 3
Определите
показатель адиабаты
для смеси газов, содержащей гелий массой
![]() =
8 г и водород массой
=
8 г и водород массой
![]() =
2 г. Газы считать идеальными.
=
2 г. Газы считать идеальными.
|
Дано:
|
|
|
По
определению
![]() .
Рассчитаем удельные теплоёмкости для
смеси газов. Первой вычислим теплоёмкость
при постоянном объёме. Количество
теплоты, необходимое для нагревания
смеси газов на ΔT,
с одной стороны, по определению
теплоёмкости, равно
.
Рассчитаем удельные теплоёмкости для
смеси газов. Первой вычислим теплоёмкость
при постоянном объёме. Количество
теплоты, необходимое для нагревания
смеси газов на ΔT,
с одной стороны, по определению
теплоёмкости, равно
![]() .
.
С другой стороны, данное количество теплоты может быть представлено как сумма теплот, идущих на нагревание двух газов по отдельности:
![]() .
.
Приравнивая
выражения, получим
 .
.
Удельные теплоёмкости газов можно выразить через число степеней свободы молекул и молярные массы газов:
![]() ;
;
![]() ,
,
где
![]() = 3,
= 3,
![]() = 5. После подстановки получаем
= 5. После подстановки получаем
 .
.
Аналогичные рассуждения дадут для удельной теплоёмкости при постоянном давлении
 .
.
Соответственно, показатель адиабаты после подстановки полученных выражений
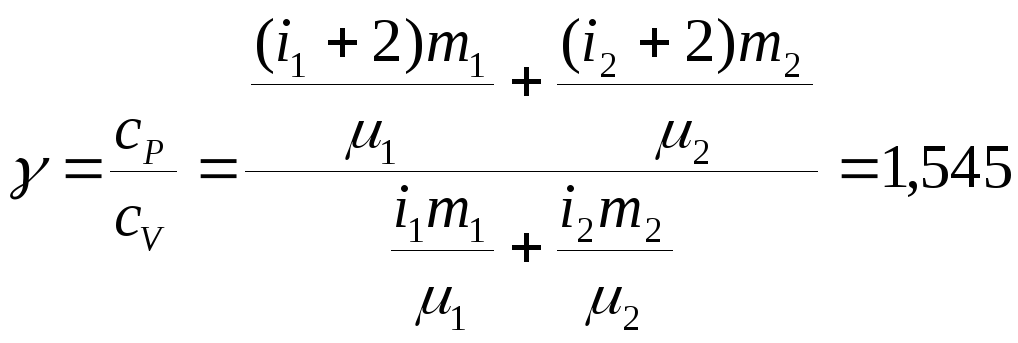 .
.
Ответ:
показатель адиабаты
![]() .
.
З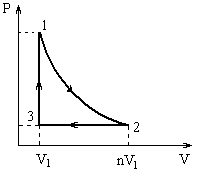 адача
№ 4
адача
№ 4
Некоторая тепловая машина работает по циклу, состоящему из адиабаты, изобары и изохоры, изображенному на рисунке. Определить теоретический к. п. д. такого двигателя если степень сжатия (отношение максимального объёма к минимальному) n = 10, а в качестве рабочего тела используется идеальный двухатомный газ.
|
Дано: n = 10 i = 5 |
|
|
Теоретический КПД тепловой машины можно определить по формуле
![]() .
.
Рассмотрим p-V диаграмму цикла, совершаемого тепловой машиной. На участке 1-2 машина не получает и не отдаёт теплоту, так как этот процесс адиабатический.
На участке 2-3 при постоянном давлении происходит уменьшение объёма, это возможно только в том случае, если уменьшаются температура газа, а следовательно, и его внутренняя энергия. Кроме того, работа, совершённая газом на этом участке, тоже отрицательна. Значит, согласно первому началу термодинамики (Q = A+ ΔU), отрицательным будет и количество теплоты, получаемой системой в данном процессе. Последнее означает, что процесс 2-3 это процесс, в котором система отдает теплоту холодильнику:
QX = - Q23
(в формуле поставлен знак минус потому, что в выражении КПД стоят модули количеств теплоты, полученных и отданных тепловой машиной).
Рассмотрим участок 3-1: на данном участке при постоянном объёме увеличивается давление газа. Из уравнения Менделеева Клапейрона следует, что увеличиваются температура газа и его внутренняя энергия. Так как работа в данном процессе не совершается (V = const), количество теплоты, полученное системой, равно изменению внутренней энергии и является положительной величиной - на участке 3-1 тело находится в контакте с нагревателем и
QH = Q31.
С учётом всего вышесказанного можно преобразовать выражение КПД
 ,
где
,
где
![]()
показатель адиабаты.
показатель адиабаты.
Используя уравнение изобары, можно получить связь между температурами T2 и T3 = T2/n.
Температуры в
первом и во втором состояниях можно
связать с помощью уравнения Пуассона:
![]() .
Применяя его к первому и второму
состояниям,
получим
.
Применяя его к первому и второму
состояниям,
получим

Подставляя выражения для T1 и T3 в формулу КПД, получим
 .
.
Учитывая, что для
двухатомного газа i
= 5 и
![]() ,
проводя расчёты, получим
,
проводя расчёты, получим
![]() .
.
Ответ:
![]() .
.
Задача № 5
О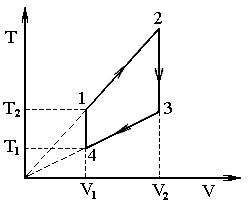 пределить
КПД тепловой машины, работающей по
циклу, изображенному на рисунке, если
известно, что V2
= 2V1,
Т2 =
2Т1,
а рабочим телом является идеальный
трехатомный газ.
пределить
КПД тепловой машины, работающей по
циклу, изображенному на рисунке, если
известно, что V2
= 2V1,
Т2 =
2Т1,
а рабочим телом является идеальный
трехатомный газ.
|
Дано: Т2 = 2Т1 V2 = 2V1 |
|
|
П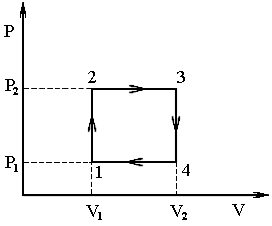 режде
всего проанализируем процессы,
происходящие с газом. Процессы 2 – 3 и
4 – 1, как видно из рисунка, являются
изохорическими. В процессах 1 – 2 и 3 –
4 температура прямо пропорциональна
объёму. Значит, данные процессы являются
изобарическими.
режде
всего проанализируем процессы,
происходящие с газом. Процессы 2 – 3 и
4 – 1, как видно из рисунка, являются
изохорическими. В процессах 1 – 2 и 3 –
4 температура прямо пропорциональна
объёму. Значит, данные процессы являются
изобарическими.
Перерисуем цикл машины в координатах p–V. По условию задачи температуры в начале и конце изохорического процесса отличаются в 2 раза. Значит, во столько же раз должны отличаться давления газа и можно записать, что p2 = 2p1.
КПД
цикла, по определению, равен отношению
работы, совершенной газом к количеству
теплоты, полученной от нагревателя:
![]() .
.
Работа, совершаемая газом за цикл, численно равна площади, ограничиваемой циклом на диаграмме p-V. В данном случае эта площадь представляет собой прямоугольник, следовательно:
A = (p2 - p1)(V2 - V1) = p1V1.
Используя рассуждения, аналогичные приведенным в предыдущей задаче, можно прийти к выводу, что тело получает теплоту от нагревателя на участках 1-2 и 2-3 (на участках 3-4 и 4-1 рабочее тело тепловой машины отдаёт теплоту холодильнику): Qн = Q12 + Q34.
Рассчитаем
количество теплоты Q12
=
![]() СV(T2
- T1).
СV
= 3R
молярная теплоемкость трёхатомного
газа при постоянном объёме. Учтем, что
для трёхатомного газа число степеней
свободы i
= 6. Т1
и Т2 температуры
в соответствующих точках цикла. Раскрывая
скобки и учитывая, что
СV(T2
- T1).
СV
= 3R
молярная теплоемкость трёхатомного
газа при постоянном объёме. Учтем, что
для трёхатомного газа число степеней
свободы i
= 6. Т1
и Т2 температуры
в соответствующих точках цикла. Раскрывая
скобки и учитывая, что
![]() RT1
= p1V1;
RT1
= p1V1;
![]() RT2
= p2V1
=
2p1V1,
RT2
= p2V1
=
2p1V1,
получим
Q12
=
3R![]() (T2-T1)
= 3 (
(T2-T1)
= 3 (![]() RT2-
RT2-
![]() RT1)
= 3(2p1V1
- p1V1)
=3 p1V1.
RT1)
= 3(2p1V1
- p1V1)
=3 p1V1.
Аналогично,
можно записать Q23
=
![]() Сp(T3-T2).
Ср =
4R
– молярная теплоёмкость трёхатомного
идеального газа при постоянном объёме.
Учитывая, что
Сp(T3-T2).
Ср =
4R
– молярная теплоёмкость трёхатомного
идеального газа при постоянном объёме.
Учитывая, что
![]() RT3
= p2V2
= 4p1V1,
RT3
= p2V2
= 4p1V1,
запишем
Q23
= 4R![]() (T3-T2)
= 4(4p1V1
– 2p1V1)
= 8p1V1,
(T3-T2)
= 4(4p1V1
– 2p1V1)
= 8p1V1,
QН = Q12 + Q23 = 11 p1V1.
Рассчитаем
коэффициент полезного действия
![]() .
.
Ответ:
![]() .
.
Задача № 6
В двух сосудах
одного и того же объёма находится гелий
массой 10 г (![]() 1=
4·10-3 кг/моль)
и азот массой 56 г (
1=
4·10-3 кг/моль)
и азот массой 56 г (![]() 2
= 28·10-3
кг/моль). Давление и температура газов
одинаковы. Сосуды соединяют и начинается
процесс диффузии. Определить изменение
энтропии системы в данном процессе.
2
= 28·10-3
кг/моль). Давление и температура газов
одинаковы. Сосуды соединяют и начинается
процесс диффузии. Определить изменение
энтропии системы в данном процессе.
|
Дано: m1 = 10 г
m2 = 56 г
|
|
ΔS -? |
Процесс диффузии в данной задаче можно рассматривать как процесс изотермического расширения. В этом случае изменениT энтропии гелия
![]() .
.
Так как процесс изотермический, Q1 = A1. Вычисляя работу в изотермическом процессе, получим
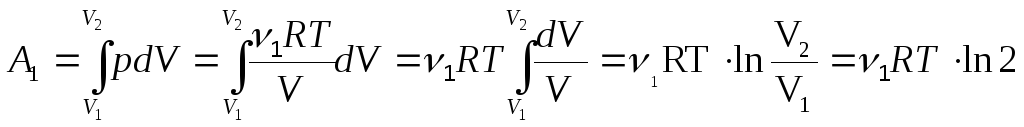 .
.
В последней формуле
учтено, что V2
= 2V1,
так как по
условию объёмы обоих сосудов равны.
Следовательно,
![]() .
.
Аналогичные
вычисления для второго газа дают
![]() .
.
Полное изменение энтропии всей системы
![]() .
.
Ответ:
изменение энтропии системы в данном
процессе
![]() .
.
Задачи, рекомендуемые для аудиторных занятий
1. Азот массой 5 кг, нагретый на 150 К, сохранил неизменный объем. Найти количество теплоты, сообщенное газу, изменение его внутренней энергии и совершенную газом работу.
2.Водород массой m = 4 г был нагрет на ∆T = 10 К при постоянном давлении. Определить работу расширения газа.
3. При изотермическом сжатии двух киломолей азота, находившегося при температуре 20 °С, до давления 2 атм. термостату отдано 20 кДж теплоты. Определить давление, под которым находился азот до сжатия, и работу, совершенную над газом при сжатии.
4. Водород при нормальных условиях имел объем V1 = 100 м3. Найти изменение внутренней энергии газа при его адиабатическом расширении до объема V2 = 150 м3.
5. В цилиндре под поршнем находится водород масcой m = 0,02 кг при температуре Т1 = 300 К. Водород сначала расширился адиабатически, увеличив свой объем в пять раз, а затем был сжат изотермически, причем объем газа уменьшился в пять раз. Найти температуру Т2 в конце адиабатного расширения и полную работу, совершенную газом. Изобразить процесс графически.
6. Кислород массой 2 кг занимает объем 1 м3 и находится под давлением 0,2 МПа. При нагревании газ расширился при постоянном давлении до объема 3 м3 , а затем давление его возросло до 0,5 МПа при неизменном объеме. Найти изменение внутренней энергии газа, совершенную им работу и переданное газу количество теплоты.
7. Какова удельная теплоемкость сv смеси газов, содержащей кислород m1 = 10 г и азот m2 = 20 г?

8 .
Идеальный двухатомный газ, содержащий
количество вещества
= 1 кмоль, совершает замкнутый цикл,
график которого изображён на рисунке.
Определить 1) количество теплоты
полученное, от нагревателя; 2) количество
теплоты, переданное охладителю; 3)
работу, совершаемую газом за цикл; 4)
к.п.д цикла .
.
Идеальный двухатомный газ, содержащий
количество вещества
= 1 кмоль, совершает замкнутый цикл,
график которого изображён на рисунке.
Определить 1) количество теплоты
полученное, от нагревателя; 2) количество
теплоты, переданное охладителю; 3)
работу, совершаемую газом за цикл; 4)
к.п.д цикла .

9. Идеальный двухатомный газ совершает цикл Карно, график которого изображен на рисунке. Объемы газа в состояниях В и C соответственно V1 = 12 л и V2 = 16 л. Найти к.п.д цикла .
10. Вычислить приращение энтропии ∆S при нагревании 1 кмоль трехатомного газа от 0 °С до 500 °С, если процесс нагревания происходит: а) при постоянном объеме; б) при постоянном давлении.
11. 2 кг льда, находящегося при t = 18°С, нагрели и превратили в пар. Определить изменение энтропии в этом процессе. Температура плавления 273 К, температура парообразования 373 К (удельная теплоемкость льда сл = 2,1·103 Дж/(кгК), удельная теплоемкость воды св = 4,2·103 Дж/(кгК), удельная теплота плавления льда = 3,3·105 Дж/(кгК), удельная теплота парообразования r = 23·105 Дж/кг).
