
Примеры решения задач
Задача № 1
В сосуде объёмом V = 1 л находится углекислый газ массой m = 0,2 г. При температуре T =2600 K некоторая часть молекул диссоциировала на молекулы кислорода и окиси углерода. При этом давление газа в сосуде оказалось равным 108 кПа. Определить какая часть молекул диссоциировала.
|
Дано: V = 1 л m = 0,2 г Т=2600 К Р=108 кПа |
|
α -? |
Рассмотрим уравнение диссоциации углекислого газа
![]()
Таким образом, каждый моль углекислого газа, распадаясь вызывает появление одного моля окисла углерода и половину моля кислорода. В результате распада части молекул в сосуде будут находиться три газа: CO2, CO, O2. По закону Дальтона найдём выражение для давления, создаваемого данной смесью газов
![]() .
.
Введём степень
диссоциации
![]() -
отношение числа молей распавшихся
молекул к начальному числу молей вещества
-
отношение числа молей распавшихся
молекул к начальному числу молей вещества
![]() .
Тогда число молей CO2
.
Тогда число молей CO2
![]() ,
,
число
молей CO
![]() ,
,
число
молей O2
(с учётом
уравнения реакции)
![]() .
.
И![]() з
уравнения Менделеева–Клапейрона
з
уравнения Менделеева–Клапейрона
![]() ,
,
![]() ,
,
![]() .
.
Общее давление
будет связано со степенью диссоциации
![]() уравнением
уравнением
![]() .
.
Так
как
![]() (
= 44·10-3
кг/моль –
молярная масса CO2)
, то
(
= 44·10-3
кг/моль –
молярная масса CO2)
, то
![]() .
Выражая
.
Выражая
![]() и производя расчет, получим
и производя расчет, получим
![]() .
.
Ответ: степень диссоциации газа = 0,2.
Задача № 2
Используя функцию распределения Максвелла по скоростям, найдите наиболее вероятное значение кинетической энергии атомов гелия, который при давлении P = 105 Па имеет плотность =160 г/м3.
|
Дано: p = 105 Па
|
|
|
Запишем функцию распределения Максвелла по скоростям.
![]() .
.
Поскольку
нужно найти наиболее вероятное значение
энергии, имеет смысл перейти от
распределения по скоростям к распределению
по энергиям f(![]() ).
По смыслу функции распределения
относительное число молекул скорости
которых лежат в интервале скоростей
).
По смыслу функции распределения
относительное число молекул скорости
которых лежат в интервале скоростей
![]() ,
которому соответствует
интервал энергий
,
которому соответствует
интервал энергий
![]() ,
равно
,
равно
![]() .
.
Из данного выражения
можно получить соотношение связывающее
две функции распределения:
![]() .
Из формулы видно: для перехода от
распределения по скоростям к распределению
по энергиям недостаточно просто выразить
скорость через энергию. Поскольку
.
Из формулы видно: для перехода от
распределения по скоростям к распределению
по энергиям недостаточно просто выразить
скорость через энергию. Поскольку
![]() ,
,
 ,
то производная
,
то производная
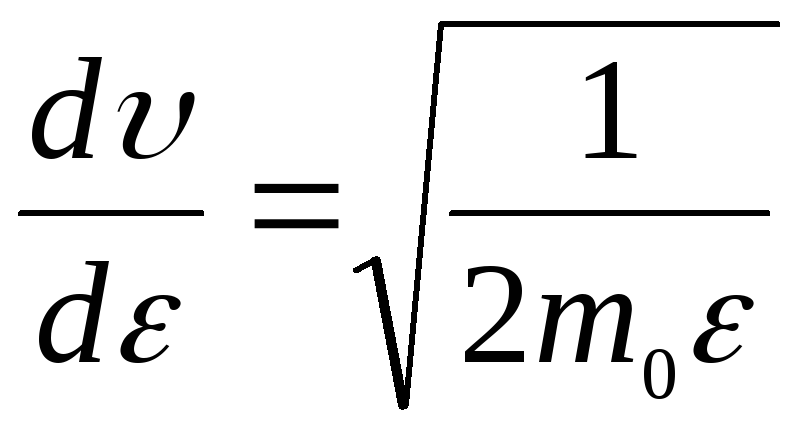 ,
и выражения для распределения по
энергиям будет иметь вид.
,
и выражения для распределения по
энергиям будет иметь вид.
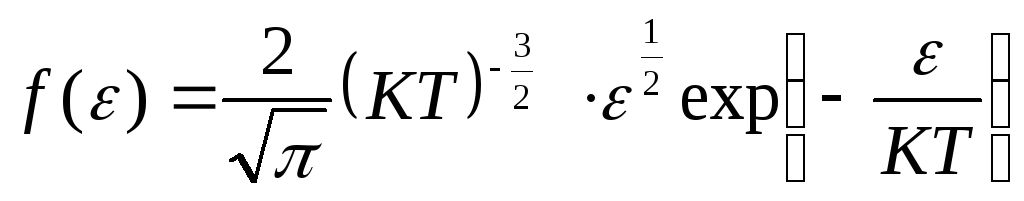 .
.
Наиболее вероятное
значение энергии
![]() соответствует максимуму функции
распределения. Соответственно производная
соответствует максимуму функции
распределения. Соответственно производная
![]() должна быть равна нулю:
должна быть равна нулю:
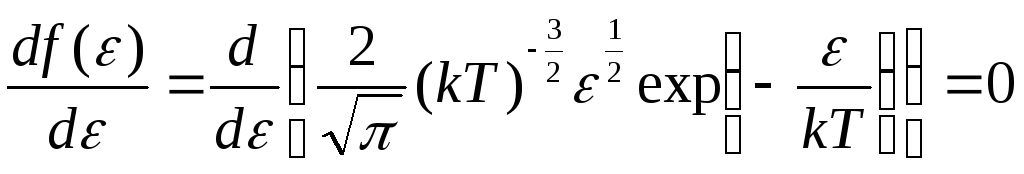 ,
,
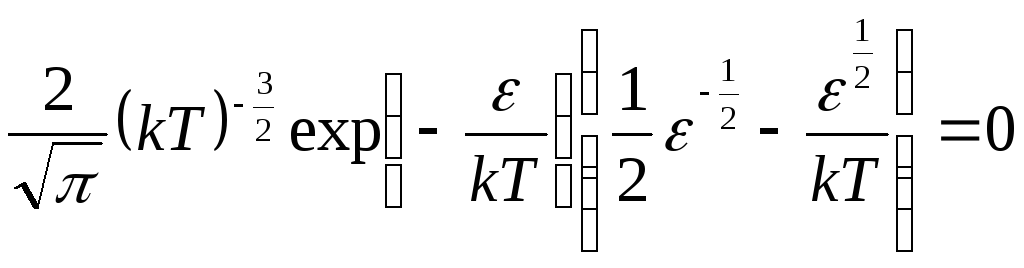 ,
,
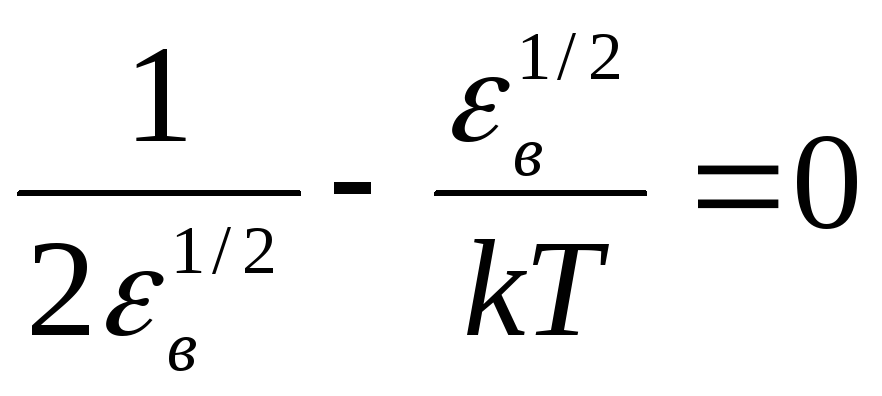 ,
,
![]() .
.
Обращаем внимание,
что выражение для наиболее вероятной
энергии нельзя получить подставив в
формулу
![]() выражения для наиболее вероятной
скорости
выражения для наиболее вероятной
скорости
![]() (в этом случае получилось бы
(в этом случае получилось бы
![]() ).
).
Из уравнения
МенделееваКлапейрона
следует, что
![]() , значит
, значит
![]()
(в
последней формуле учтено, что R
= NA·k).
Подставляя данные из условия и молярную
массу гелия
![]() = 4·10-3 кг/моль,
получим
= 4·10-3 кг/моль,
получим
![]() Дж.
Дж.
Ответ:
наиболее вероятное значение кинетической
энергии атома гелия
![]() Дж.
Дж.
Задача № 3
Ротор центрифуги,
заполненный радоном, вращается с частотой
![]() = 50 Гц. Радиус ротора a
= 0,5 м. Определить давление газа на стенку
ротора, если в его центре давление p0
= 105
Па. Температуру по всему объёму считать
постоянной, равной
Т=300 К.
= 50 Гц. Радиус ротора a
= 0,5 м. Определить давление газа на стенку
ротора, если в его центре давление p0
= 105
Па. Температуру по всему объёму считать
постоянной, равной
Т=300 К.
|
Дано:
a = 0,5 м. p0= 105 Па. Т=300 К. |
|
p -? |
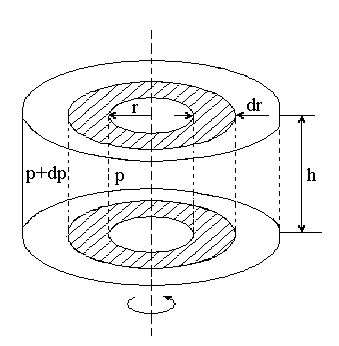 ешение:
ешение:
Рассмотрим находящийся в центрифуге цилиндрический слой воздуха бесконечно малой толщины dr, такой, что можно считать, что все молекулы данного слоя находятся на одинаковом расстоянии r от оси вращения.
Запишем для данного слоя второй закон Ньютона :
F = ma
Под силой F в данном случае нужно понимать разность сил давления действующих с внешней и внутренней стороны слоя
F =
((p+dp)-p)2![]() r
h = dp 2
r
h = dp 2![]() r
h,
r
h,
где
произведение 2![]() r
h
даёт площадь боковой поверхности слоя
воздуха. Массу данного слоя можно
получить, умножив плотность воздуха
на объём слоя dV
= 2
r
h
даёт площадь боковой поверхности слоя
воздуха. Массу данного слоя можно
получить, умножив плотность воздуха
на объём слоя dV
= 2![]() r
dr
h;
m
=
r
dr
h;
m
=
![]() dV
=
dV
=![]() 2
2![]() r
dr
h.
Все молекулы данного слоя вовлечены во
вращательные движения с угловой скоростью
r
dr
h.
Все молекулы данного слоя вовлечены во
вращательные движения с угловой скоростью
![]() и находятся на одинаковом расстоянии
r
от оси вращения, следовательно, обладают
одинаковым нормальным ускорением
и находятся на одинаковом расстоянии
r
от оси вращения, следовательно, обладают
одинаковым нормальным ускорением
![]() .
Объединяя выражения, получим
.
Объединяя выражения, получим
dp
=![]() dr·
dr·![]()
(в
правой и левой части сокращён одинаковый
множитель 2![]() r
h).
Из уравнения Менделеева–Клапейрона
следует
r
h).
Из уравнения Менделеева–Клапейрона
следует
![]() .
Подставляя в предыдущее выражение и
разделяя переменные, получим
.
Подставляя в предыдущее выражение и
разделяя переменные, получим
![]() .
.
Проинтегрируем полученное уравнение:
![]()
где А - некоторая постоянная интегрирования. Представим её в виде натурального логарифма от некоторой другой постоянной С:A = ln C. Тогда
![]()
или
![]() .
.
По условию задачи на оси центрифуги давление должно быть p0, это возможно только в случае, когда C= p0. Заменяя C на p0, определим давление как функцию расстояния до оси вращения:
![]() .
.
Вспоминая,
что
![]() ,
получим расчетную формулу для давления
,
получим расчетную формулу для давления
![]() .
.
Подставляя в последнюю формулу r = a = 0,5 м и молярную массу радона
![]() = 0,222 кг/моль,
вычислим давление газа на стенку
центрифуги p
= 3 105
Па.
= 0,222 кг/моль,
вычислим давление газа на стенку
центрифуги p
= 3 105
Па.
Ответ: давление на стенку ротора p0 =3 105 Па.
Задача № 4
Стальной стержень длиной ℓ = 20 см с площадью поперечного сечения S = 3 см2 нагревается с одного конца до температуры t1 = 3000С, а другим концом упирается в лёд. Предполагая, что передача тепла происходит исключительно вдоль стержня (без потерь через стенки), подсчитать массу льда, растаявшего за время t = 10 мин. Теплопроводность стали = 60 Вт/(м∙К).
|
Дано: t1 = 3000С S = 3см2 t2 = 00С ℓ = 20см.
= 60 Вт/м∙К |
|
m -? |
Найдём количество теплоты полученное льдом. Для этого запишем уравнение теплопроводности.
![]() .
.
Считая, что поток тепла не изменяется со временем и постоянен в пределах сечения стержня, данную формулу можно записать в виде
![]() .
.
Производная
![]() представляет собой градиент температуры
в стержне. Так как длина стержня равна
ℓ, а разность температур на его концах
t1-t2,
можно произвести замену
представляет собой градиент температуры
в стержне. Так как длина стержня равна
ℓ, а разность температур на его концах
t1-t2,
можно произвести замену
![]() .
Знак минус в выражении Q
можно не учитывать, так как он показывает,
что направление переноса теплоты
противоположно направлению возрастания
температуры. С учётом этого количество
теплоты получённое льдом:
.
Знак минус в выражении Q
можно не учитывать, так как он показывает,
что направление переноса теплоты
противоположно направлению возрастания
температуры. С учётом этого количество
теплоты получённое льдом:
![]() .
.
Так
как всё это количество теплоты идёт на
плавление льда, Q
= m
(
= 3,3105
Дж/кг – удельная теплота плавления
льда). Объединяя выражения и производя
расчеты получим
![]()
Ответ: масса растаявшего льда m = 0,049 кг = 49 г.
Задача № 5
В результате
некоторого процесса вязкость некоторого
идеального газа увеличилась в
![]() раза,
а коэффициент диффузии – в
раза,
а коэффициент диффузии – в
![]() раза.
Во сколько раз увеличилось давление
газа.
раза.
Во сколько раз увеличилось давление
газа.
|
Дано:
|
|
|
Согласно молекулярно кинетической теории,
![]() ,
,
![]() ,
,
где
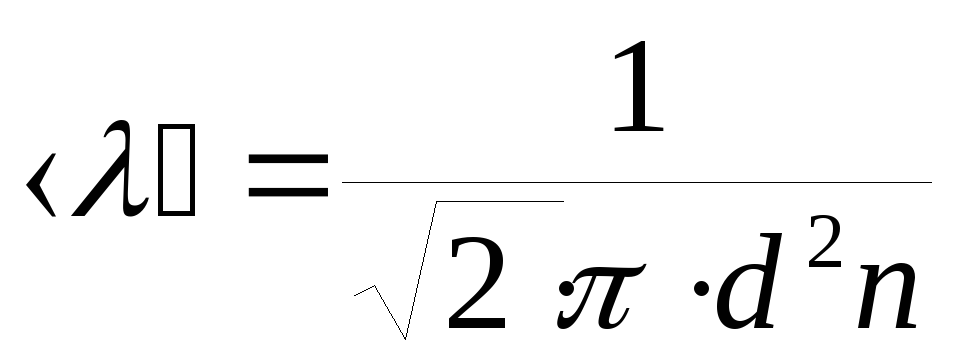
средняя длина свободного пробега,
средняя длина свободного пробега,
![]() -
средняя скорость движения молекул,
=m0n-
плотность газа.
-
средняя скорость движения молекул,
=m0n-
плотность газа.
По
основному уравнению МКТ
![]() ,
поэтому
,
поэтому
![]() .
Подставим в выражение для
значения
.
Подставим в выражение для
значения
![]() ,
,
![]() и ,
тогда
и ,
тогда
![]()
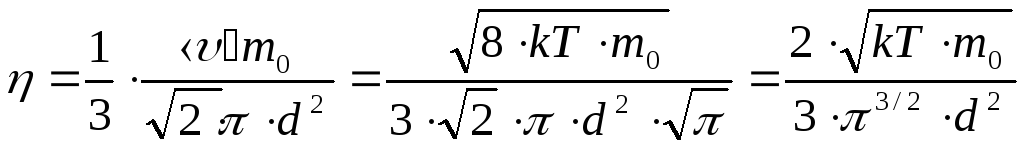 ;
;
Из
формул видно, что
![]() ~
~![]() ,
значит,
,
значит,
![]() .
Для того чтобы найти отношение
.
Для того чтобы найти отношение
![]() ,
свяжем между собой
,
свяжем между собой
![]() и D.
Из формул видно, что
и D.
Из формул видно, что
![]() .
Отсюда
.
Отсюда
![]() ,
а отношение
,
а отношение
![]() .
В итоге получаем отношение давлений
.
В итоге получаем отношение давлений
![]()
![]() .
.
Ответ: давление возрастет в два раза.
Задачи, рекомендуемые для аудиторных занятий
1. 12 г газа занимают объем 4 дм3 при температуре 70С. После нагревания газа при постоянном давлении его плотность стала равна 0,6 мг/см3. До какой температуры нагрели газ?
Ответ: до 1400 К.
2. В сосуде находится 14 г азота и 9 г водорода при температуре 100С и давлении 1 МПа. Найти молярную массу смеси и объем сосуда.
Ответ: 4,6 г/моль; 12 дм3.
3. В двух сосудах емкостями 3 и 4 л находится газ под давлениями 0,2 и 0,1 МПа соответственно. Температура в обоих сосудах одинакова. Под каким давлением будет находиться газ, если соединить сосуды трубкой?
Ответ: 140 кПа.
4. В баллоне емкостью 150 см3 содержится газ при температуре 30 0С. Вследствие утечки из колбы вышло 4∙1018 молекул. Определить, на сколько понизилось при этом давление газа?
Ответ: 112 Па.
5. Плотность некоторого газа равна 6∙10-2 кг/м3, средняя квадратичная скорость молекул этого газа равна 500 м/с. Найти давление, которое газ оказывает на стенки сосуда.
Ответ: 5 кПа.
6. В баллоне емкостью 5 л находится 25∙1021 молекул азота. Найти среднюю квадратичную скорость его молекул, если давление в баллоне P = 720 мм рт.ст.
Ответ: 1100 м/с.
7. Найти число молекул азота в 1 см3 при нормальных условиях и обладающих скоростью: а) между 99 м/с и 101 м/с; б) между 499 м/с и 501 м/с.
Ответ: 8,6∙1018; 4,9∙1019.
8. Найти для газообразного азота температуру, при которой скоростям молекул υ1 = 300 и υ2 = 600 м/с соответствуют одинаковые значения функции распределения Максвелла.
Ответ: 330 К.
9. Полагая температуру воздуха и ускорение свободного падения не зависящими от высоты, определить, на какой высоте h над уровнем моря плотность воздуха меньше своего значения на уровне моря в 2 раза. Температура воздуха t = 00С.
Ответ: 5,5 км.
10. Вычислить среднюю длину свободного пробега молекул воздуха при температуре 17 0С и нормальном давлении. Эффективный диаметр молекул воздуха принять равным 3∙10-8 см.
Ответ: 10-7 м.
11. Определить среднее число всех столкновений между молекулами, которые происходят в течение 1 с в 1 см3 кислорода при температуре 17 0С и давлении 5 мм рт. ст. Эффективный диаметр молекулы кислорода 2,9∙10-8 см.
Ответ: 2,27∙1024.
12. Найти среднюю длину свободного пробега азота, если его динамическая вязкость 17 мкПас, d = 0,3 нм.
Ответ: 0,09 нм.
13. Найти коэффициент теплопроводности воздуха при температуре 10 0С и давлении 100 кПа, если диаметр молекулы воздуха принять равным 0,3 нм.
Ответ: 13 мВт/(мּК).
14. Вычислить коэффициент диффузии и динамическую вязкость азота при давлении 0,1 МПа и температуре 7 0С.
Ответ:14ּ10-6 м2/с и 17ּ10-6 Паּс.
