
- •Лекция №12 Молекулярная физика и термодинамика
- •12.1. Система, параметры состояния, равновесное состояние и процесс, закон Авогадро, уравнение Клайперона-Менделеева.
- •12.2. Парциальное давление в газах
- •12.3. Внутренняя энергия.
- •12.4. Экспериментальные подтверждения молекулярно-кинетической теории
12.2. Парциальное давление в газах

Таким образом
Г![]() деn
чило молекул газа в еденице объема.
деn
чило молекул газа в еденице объема.
- средняя кинетическая энергия молекулы при данной температуре Т
При этом эта формула не зависит от сорта молекул, так как все молекулы имеют одно значение средней кинетической энергии. Теперь предположим, что мы имеем смесь газов тоесть справедливо выражение. n =n1+n2+n3+…….
У![]() множив
обе части этого равенства на
множив
обе части этого равенства на
![]()
Получим
![]()
Но
Где Рi давление одного из компонент смеси газа так как если бы он находился без присутствия других газов. Это давление принято называть парциальным.
Таким образом справедлив закон Дальтона:
Давление в газовой смеси равно сумме парциальных давлений компонент этой смеси.

12.3. Внутренняя энергия.
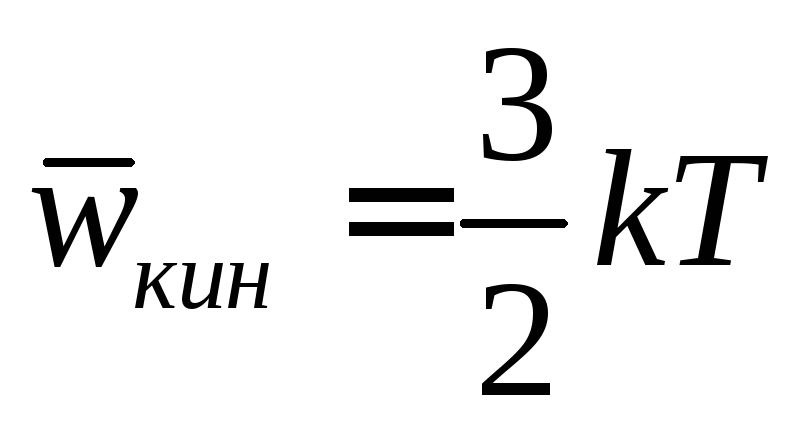
Как видно из уравнения
Средняя кинетическая энергия молекулы газа пропорциональна абсолютной его температуре. Для идеальных газов (состоящих из упругих шариков) кинетическая энергия беспорядочного движения всех молекул определяет внутреннюю энергию этого газа.
Для реальных газов дополнительно необходимо принимать во внимание потенциальную энергию взаимодействия молекул между собой, но она во многих случаях пренебрежимо мала.
Кинетическая энергия молекулы вообще говоря кроме «поступательной» части может иметь и «вращательную» и «колебательную» часть. Для того, чтобы распределить энергию между всеми видами движения введем понятие степеней свободы.
Под числом степеней свободы мы будем понимать число независимых координат, которые необходимо задать, чтобы определить положение тела в пространстве.
Точечное тело имеет 3 степени свободы. Тело состоящее из двух точек имеет пять степеней свободы. Число степеней свободы молекулы состоящей из двух и более частиц определяется как i=3n-1 где n- число атомов в молекуле.
Основной предпосылкой молекулярно кинетической теории является утверждение о беспорядочном движении молекул газа. Это относится не только к поступательному движению, но и к любым другим видам движения: вращательному, колебательному и т.д. Поэтому разумно положить, что на каждую степень свободы приходитя равная доля энергии. Поэтому исходя из того, что одноатомный газ обладая тремя степенями свободы имеет энергию молекулы 3/2kT можно утверждать, что на одну степень свободы приходится 1/2kT энергии. Отсюда можно написать общее выражение для средней энергии молекулы произвольного газа:

Г![]() деi
число степеней свободы молекулы газа.
Таким образом полная внутренняя энергия
газа
деi
число степеней свободы молекулы газа.
Таким образом полная внутренняя энергия
газа
Но вспоминая, что PV = NkT = (m/μ)RT получим так же и другое выражение для внутренней энергии U =(i/2)(m/μ)RT
Из этого выражения можно видеть, что внутренняя энергия выражается через число степеней свободы молекул, число молей (количества молекул) и абсолютную температуру. (В физике принята абсолютная шкала температур Кельвина в которой за ноль принята температура абсолютного нуля и температура таяния льда за 2730 ). Внутренняя энергия идеального газа не зависит от его объема и давления. В случае реальных газов, где есть слабое взаимодействие между молекулами, внутренняя энергия газов слабо зависит и от давления и от объема. Таким образом температура есть параметр характеризующий уровень внутренней энергии газа.
