
Лекция №14 Молекулярная физика и термодинамика
Теплоемкость идеальных газов, процессы переноса в газах
14.1. Теплоёмкость идеального газа
Как
показывают результаты экспериментов,
во многих случаях приращение температуры
тела прямо пропорционально количеству
теплоты, сообщенного ему. Для количественного
описания этого соотношения вводится
коэффициент
пропорциональности ![]() между
количеством теплоты, сообщаемого телу,
и изменением его температуры, называемым
теплоёмкостью:
между
количеством теплоты, сообщаемого телу,
и изменением его температуры, называемым
теплоёмкостью:
|
|
(14.1) |
Этот
коэффициент позволяет определить
количество теплоты
![]() ,
которое необходимо сообщить телу для
повышения его температуры на величину
,
которое необходимо сообщить телу для
повышения его температуры на величину![]() .
.
В самом общем случае для произвольного тела его теплоемкость может зависеть от параметров состояния этого тела, например, от его температуры или объема. Очевидно, что теплоемкость термодинамической системы изменяется при изменении количества вещества в ней. Для систем, находящихся в состоянии термодинамического равновесия, их теплоемкость пропорциональна количеству вещества. Это позволяет ввести для описания свойств тела удельную теплоемкость:
|
|
(14.2) |
и, соответственно, молярную теплоемкость:
|
|
(14.3) |
где:
![]() -
масса тела,
-
масса тела,![]() -
количество вещества в нем. Эти теплоемкости
связаны между собой через молярную
массу
-
количество вещества в нем. Эти теплоемкости
связаны между собой через молярную
массу![]() следующим
соотношением:
следующим
соотношением:
|
|
(14.4) |
Теплоемкость, так же как и количество переданной телу теплоты, зависит от того, каким образом, а точнее при осуществлении какого процесса, теплота передавалась этому телу (при каких условиях они нагревались при условии сохранения объема, либо при постоянном давлении)
Пользуясь представлением о внутренней энергии, можно найти выражение для теплоемкости идеального газа. Рассмотрим процесс когда объем остается неизменным. В этом случае все тепло передающееся телу идет на увеличение его внутренней энергии, а работа при этом не совершается. Помня, что молярная теплоемкость равняется количество теплоты переданное молю тела при изменении его температуры на один градус, можно записать
![]()
Н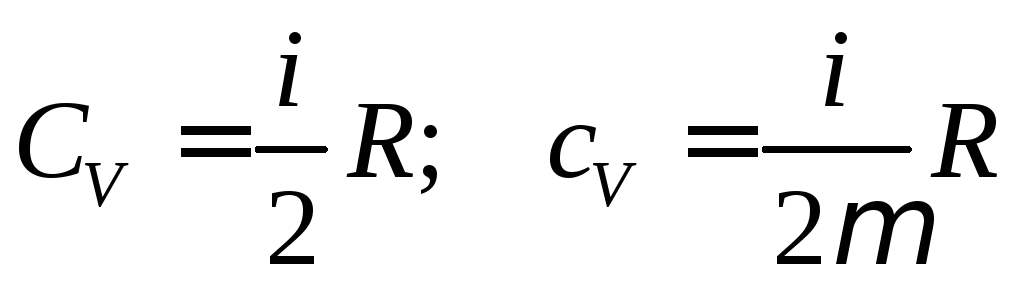 о
это, как следует из определения,
приведенного выше) является молярной
теплоемкость тела. Таким образом:
о
это, как следует из определения,
приведенного выше) является молярной
теплоемкость тела. Таким образом:
Из этого следует, что молярная теплоемкость идеального газа при постоянном объеме зависит лишь от числа степеней свободы его молекулы.
При нагревании газа при сохранении постоянным его давления Р, газ расширяется и совершает при этом какую то работу (Рис.14.1) на которую уходит часть тепла передаваемое телу. Другая часть как и в первом случае идет на увеличение внутренней энергии газа.
![]()
![]()
Или для одного моля это соответствует
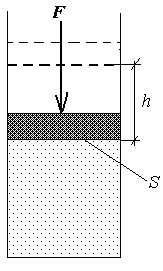
Рис.14.1
![]()
Д![]() ля
одного моля газа справедливо
ля
одного моля газа справедливо

Т![]() аким
образом
аким
образом
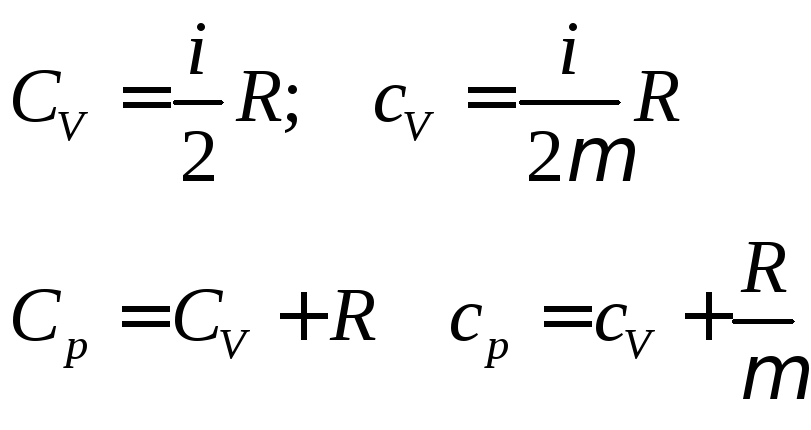
Беспорядочное движение молекул в газе ведет к их непрерывному перемешиванию, отсюда два разнородных газа взаимно проникают друг в друга (они диффундируют). Такое движение молекул обуславливает также механизмы внутреннего трения и теплопроводности в газах.
Эти явления получили общее название: явления переноса
Скорость газовых молекул велика, и как предсказывает молекулярно кинетическая теория, достигает нескольких сотен метров в секунду. В этом случае диффузия в газах на первый взгляд должна была бы происходить весьма быстро, что на практике не наблюдается. Считая так, мы не учитываем, что реально газовые молекулы испытывают огромное число столкновений, поэтому они движутся не по прямой, а по сложной весьма запутанной траектории. Рассмотрим эти явления подробнее
